单纯高胆固醇或其合并玉米油饮食建立兔动脉粥样硬化模型的比较*
2014-11-08张南荣王红丽吕保峰靳三庆
文 依, 周 燕, 刘 翔, 张南荣, 王红丽, 吕保峰, 靳三庆
动脉粥样硬化(atherosclerosis,AS)是严重威胁人类健康的常见疾病,未有有效的预防和治疗方法,为攻克这一难题,研究者们进行着各种各样的动物实验。高脂饮食法建立AS模型是常用的建模方法,但国内外建立AS模型的高脂饮食配方报道不一,国内多数研究者选用胆固醇溶解于玉米油或猪油后,与普通饲料混匀配成高胆固醇合并玉米油或猪油的饲料[1-2],国外则大多仅选择胆固醇溶解于酒精后与普通饲料混匀配成高胆固醇饲料[3-4]。究竟2种饲料配制方法对AS模型的建立有何影响、是否必须于饲料中添加猪油或玉米油?这些问题未见报道。大鼠和兔是用于建立AS模型最常用的动物,但由于大鼠具有一定的抗动脉粥样硬化特性,相对较难形成AS模型。兔是草食性动物,对高脂饮食具有高度敏感性,其脂代谢与人相似。同时有研究表明人的AS斑块与兔的AS斑块具有一定的相似性[5]。我们分别用上述2种方法建立了兔AS模型,以比较单纯高胆固醇饲料和高胆固醇饲料合并玉米油对兔AS模型形成的异同,为AS模型的建立提供基本数据。
材料和方法
1 动物及分组
健康雄性新西兰兔18只,4月龄,体重2.0~2.5 kg。动物入组前,为适应环境变化均先给予普通饲料喂养(中山大学实验动物中心提供,室温20℃下保存)1周。实验过程中动物均单笼喂养、自由饮水,维持室内温度20℃,湿度50%;并以12 h∶12 h光照与黑暗交替。经过1周的适应性喂养后随机分为3组,每组6只,普通饲料组(C组)、单纯高胆固醇饲料组(H1组)和高胆固醇玉米油饲料组(H2组)。本研究获中山大学动物伦理委员会批准,批准号为IACUC-2010-0901。
2 动物饲养
每只动物给予150 g/d饲料喂养,饮水不限,饲养12周,并每周测量1次体重。具体饲养方法如下:C组每天早晨和晚上分别给予普通饲料70和80 g喂养。H1组每天早晨给予含1%胆固醇饲料150 g。饲料配制方法:先用电子秤称好相应量的胆固醇和普通饲料待用;然后每1.5 g胆固醇配20 mL的无水乙醇,在60~70℃下溶解后立即与148.5 g普通饲料混匀;待饲料铺开冷却24 h,乙醇完全挥发后使用。H2组每天早晨给予普通饲料70 g,晚上给予高胆固醇加玉米油饲料80 g(1.5 g胆固醇+9 g玉米油+69.5 g普通饲料),这种喂养方法相当于每日摄取150 g高胆固醇加玉米油饲料(1%胆固醇+6%玉米油+93%普通饲料)。高胆固醇加玉米油饲料配制方法:先用电子秤称好相应量的胆固醇(国药集团化学试剂有限公司,避光保存)、玉米油(市售的100%纯度的金龙鱼玉米油)及普通饲料待用;然后加热玉米油,将胆固醇溶解于玉米油中,立即与普通饲料混匀;待饲料完全冷却后使用。饲料每日现配现喂。
3 血脂测定
实验开始前(0周)及实验第12周末(12周),各组动物禁食12 h后,自耳中动脉取2 mL血于普通干燥管中,置于4℃、1 500×g离心15 min(台式高速冷冻离心机5810R,Eppendorf AG),收集血清标本。用全自动生物化学分析仪(ADVIA-2400,Bayer)检测血清高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)浓度。
4 标本收集及保存
实验第12周末,经耳缘静脉注射3%戊巴比妥钠1 mL/kg麻醉动物,打开胸腔,取胸主动脉8 cm(自主动脉根部算起)。纵行剖开动脉,用生理盐水轻轻冲洗,并在4℃、Kreb’s缓冲液中剪去血管外膜及结缔组织。Kreb’s缓冲液 pH 7.4,配方如下(mmol/L):NaCl 118.3,KCl 4.7,KH2PO41.2,MgSO41.2,NaHCO324.9,Glucose 11.1,CaCl22.5。将动脉用10%中性甲醛(广州市艾发生物医学技术有限公司)固定24 h,然后进行脂肪染色。
5 脂肪染色
动脉内膜脂肪染色采用苏丹IV染色或油红O染色。
5.1 苏丹IV溶液配制方法 0.1 g苏丹IV干粉(Amresco),溶于50 mL丙酮中,再加入70%乙醇50 mL,充分混合后使用。动脉内膜染色方法步骤如下:(1)PBS洗5 min;(2)70%乙醇洗3 min;(3)苏丹IV溶液3~5 min;(4)80%乙醇洗3~5 min;(5)自来水洗1~2min。
5.2 油红O染色方法步骤 (1)双蒸水洗2 min;(3)60%异丙醇洗2 min;(3)0.5%油红O溶液(Sigma)15 min;(4)60%异丙醇洗3次,每次5 min;(5)双蒸水洗2 min。
6 动脉粥样硬化斑块的观察和面积的测定
动脉染色后,轻轻将其铺平,内膜朝上,并用大头针固定于白色泡沫板上,首先用肉眼观察动脉粥样硬化斑块的形成情况,然后用数码相机(Canon EOS550D)拍照。使用ImageJ2x软件自动测量并计算斑块面积占血管内膜面积百分比(plaque area/intimal area,PA/IA)。
7 统计学处理
采用 SPSS 16.0软件,数据用均数 ±标准差(mean±SD)表示。重复测量资料比较采用重复测量资料方差分析,多组间结果的比较采用单因素方差分析,进一步的两组间比较采用Bonferroni方法,以P<0.05为差异有统计学意义。
结 果
1 动物基本情况
C组兔精神状况良好,食欲正常。H1组兔精神状态尚可,食欲较好。H2组兔精神状态稍差,逐渐出现食欲下降。C组死亡1只,H1组无死亡,H2组死亡2只。
2 体重变化
3组动物体重均随饲养时间增加而增加,在不同时点各组间实验动物体重增加量比较无显著差异(P >0.05),见图1。
Figure 1.Body weight gain in rabbits fed with different diets.Group C:normal diet(n=5);group H1:a diet enriched with 1%cholesterol(n=6);group H2:1%cholesterol diet containing 6%corn oil(n=4).Mean±SD.图1 各组动物体重增加情况
3 血脂变化情况
实验开始前(0周),各组间LDL-C、TC和TG基础值无显著差异(P>0.05),H1组HDL-C水平高于C组(P<0.05)。实验第12周末,H1组和 H2组HDL-C、LDL-C和TC水平均高于 C组(P<0.05);H2组TG高于C组(P<0.05),H1组与C组间的TG无显著差异(P>0.05);H1组HDL-C水平低于H2组(P<0.05),但2组间LDL-C、TC及TG水平无显著差异(P >0.05),见表1。
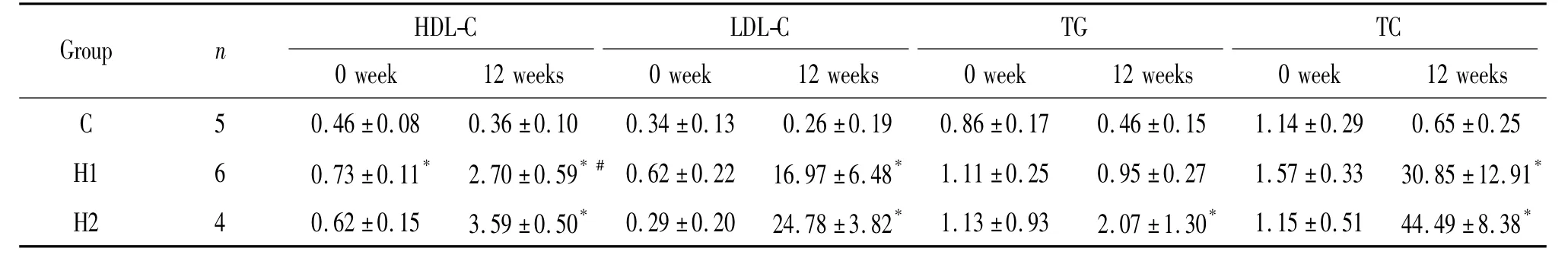
表1 血清HDL-C、LDL-C、TG及TC水平变化Table 1.Serum levels of HDL-C,LDL-C ,TG and TC(mmol/L.Mean±SD)
4 大体标本观察
C组动脉内膜光滑,管壁较薄且柔软;H1组及H2组动脉内膜可见大量高于内膜的乳白色斑块,管壁增厚并僵硬。经过染色后,可见C组动脉内膜光滑,未见红染的脂质条纹及斑块;H1组及H2组所有兔动脉内膜粗糙,呈现大量红染的、高于内膜的斑块,斑块大小不一,并见一些斑块相互融合成大片,2组造模成功率均为100%,见图2。
5 PA/IA结果
C 组PA/IA 为0%,H1组为(49.74±18.78)%,H2组为(56.95±26.74)%。H1组、H2组分别与C组相比,组间均有显著差异(P<0.05);H1组与H2组的PA/IA相比无显著差异(P>0.05),见图3。

Figure 2.Fat-stained images of aorta intima.A:the normal aorta intima stained by Sudan IV;B:the atherosclerotic aorta intima stained by Sudan IV;C:the normal aorta intima stained by oil red O;D:the atherosclerotic aorta intima stained by oil red O.“↗”indicates plaques stained by Sudan IV or oil red O.图2 主动脉内膜脂肪染色图片
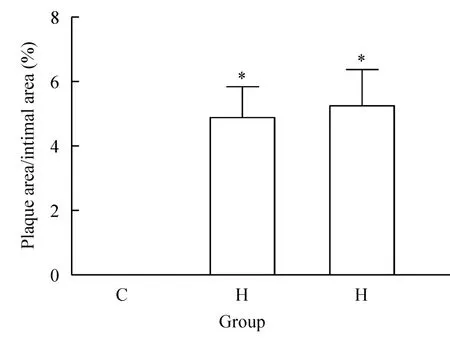
Figure 3.The percentage of plaque area in the total aortic intimal area.Mean±SD.Group C:n=5;group H1:n=6;group H2:n=4.*P <0.05 vs group C.图3 斑块面积占内膜总面积百分比
讨 论
AS是心脑血管疾病发病的重要原因[6],AS及其并发症可导致较高的死亡率,关于AS的防治仍是研究热点。在AS的研究中,动物实验研究具有重要的意义。建立良好的AS动物模型成为探讨和评价AS防治方法的有力工具。目前关于动物AS模型的建立有多种方法,包括长期高脂饮食饲养、基因敲除或转基因动物、损伤动脉内膜等[1,7-8],各有其优缺点。由于高脂饮食制备AS模型更符合人类AS疾病发生发展特点,因而被广为使用。目前不同研究所用的高脂饮食建模饲料配方不同,如单纯高胆固醇饲料、高胆固醇合并玉米油或猪油饲料等[1,3]。那么,究竟添加油类成分对于AS模型的建立是否有促进作用呢?由于市售的猪油质量和其成分的一致性难以保证,而玉米油的纯度及质量较为可靠,因此我们选用玉米油作为高脂物质进行添加。本实验对高胆固醇合并玉米油饲料和单纯高胆固醇饲料建立的AS模型进行比较,探究2种饲料造模的异同,为AS模型的建立提供基本数据。
脂质代谢紊乱被认为是AS发病的重要病理基础。AS斑块主要包括含有脂质的平滑肌细胞、淋巴细胞及巨噬细胞增殖;胆固醇或胆固醇酯蓄积;胶原、弹力蛋白等结缔组织基质形成[9]。粥样斑块中的脂质主要来自血脂,因此血液中TC、TG及LDL-C的增高和HDL-C的降低有助于动脉壁斑块的形成,并会导致血液流变学异常。Toshima等[10]研究表明,血液中氧化修饰的LDL-C长期增高可损伤血管内皮细胞,而HDL-C则可抑制LDL-C对内皮细胞的损伤。内皮细胞损伤被认为是动脉粥样硬化发生发展的始动环节,因此血脂水平是评价AS动物模型成功建立与否的重要参考指标。本研究中实验动物饲养12周后,H1组和H2组血清LDL-C、TC均比普通饲料组明显增高(P<0.05),这与其它实验报道一致[11],证实2种饲料配方均可诱导兔产生高脂血症,其发生AS风险相应增加。本实验发现动物饲养12周时,H2组TG高于 C组(P<0.05),H2组 HDL-C水平高于H1组(P<0.05),这可能与H2组添加玉米油有关。目前关于玉米油对AS发挥的作用仍存在争议,有研究表明玉米油中含有86%的不饱和脂肪酸,还有固醇、卵磷脂等成分,可抑制小肠对胆固醇的吸收,具有抗动脉粥样硬化的作用[12];也有研究表明玉米油高脂饮食可使血脂增高,导致AS病变[13]。
在AS防治的研究中,多数研究者判断干预措施是否有效及AS病变程度主要使用AS模型的血脂变化,斑块面积(或厚度)占内膜总面积(或厚度)的百分比等指标[14-16]。因此本实验中,判断AS是否发生及其严重程度使用了PA/IA这一指标。我们发现C组无AS斑块形成,H1及H2组主动脉内壁均能见到AS斑块,说明无论是否添加玉米油的高胆固醇饮食均能建模成功。这与 Romero等[4]及 Misiacos等[2]用相似的高脂饮食造模方法研究结果一致,同时也间接证实了2种饮食建模法可靠、易重复。而H1组与H2组组间PA/IA无统计学意义(P>0.05),饲养12周时2组间LDL-C、TC及TG水平无统计学意义(P>0.05),说明在12周的饲养周期条件下,与单纯高胆固醇饮食相比,高胆固醇合并玉米油饮食并没有加重AS斑块形成的作用。
本实验发现2组高脂饮食组动物体重增加量并没有低于普通饲料饮食组动物体重增加量(P>0.05)。这与 Ramachandran等[17]研究结果一致,而Hartvigsen等[18]研究表示高脂饮食组动物体重增加量比普通饲料饮食组动物体重的增加偏低。本研究发现自第7周开始,H2组动物体重增加量低于H1组,但2组相比无统计学意义(P>0.05),可能由于高胆固醇合并玉米油饲料较单纯高胆固醇饲料油腻,影响动物饮食摄入,导致体重偏低。
本研究先后采用2种动脉内膜的染色方法:苏丹IV染色和油红O染色。苏丹IV染料和油红O染料均为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织内甘油三酯、胆固醇等显色。虽然2种染色方法使血管内膜的染色存在色差,但由于其染色原理一样,对AS斑块面积计算并无影响。另外,H1组HDL-C基础水平高于C组(P<0.05),可能是本研究样本量偏小,个体差异较大导致的结果。本研究只观察了12周,2种不同饮食法饲养更短或更长时间对AS形成是否有差异仍待探讨。粥样斑块的成分主要是胆固醇及胆固醇酯,Ozaki等[19]研究表明斑块中脂质成分含量并不随血脂增高而平行增加,因此2种饮食法对AS斑块组成、稳定性及斑块是否易脱落等病理特征是否有差异,有待于进一步研究。
虽然2种饮食法均能成功建立AS模型,造模成功率均为100%,但与单纯高胆固醇饲料配方相比,高胆固醇合并玉米油的制作方法复杂,花费成本较高,且玉米油与AS的关系尚不明确。本研究在预实验时还发现添加玉米油的饲料较油腻,减少兔饮食摄入,不利于高脂饮食兔的长期饲养;这也是我们在H2组动物的饲养时将所有高脂饮食(含有1天量的胆固醇和玉米油)放在晚上,而早上使用正常饲料的原因,我们发现这样基本上可以保证兔高脂饮食的摄入。
综上所述,我们认为在12周的饲养周期内,单纯高胆固醇饮食建立兔AS模型更加方便可靠。
[1] 李淑莲,王晓红,薛 林,等.动脉粥样硬化家兔血浆及组织金属硫蛋白含量变化[J].中国病理生理杂志,2000,16(7):600-602.
[2] Misiakos EP,Kouraklis G,Agapitos E,et al.Expression of PDGF-A,TGFb and VCAM-1 during the developmental stages of experimental atherosclerosis[J].Eur Surg Res,2001,33(4):264-269.
[3] Lee LS,Cho CW,Hong HD,et al.Hypolipidemic and antioxidant properties of phenolic compound-rich extracts from white ginseng(Panax ginseng)in cholesterol-fed rabbits[J].Molecules,2013,18(10):12548-12560.
[4] Romero F,Rodriguez-Iturbe B,Pons H,et al.Mycophenolate mofetil treatment reduces cholesterol-induced atherosclerosis in the rabbit[J].Atherosclerosis,2000,152(1):127-133.
[5] Haunstetter A,Izumo S.Apoptosis:basic mechanisms and implications for cardiovascular disease[J].Circ Res,1998,82(11):1111-1129.
[6] Larosa JC,Grundy SM,Waters DD,et al.Intensive lipid lowering with atorvastatin in patients with stable coronary disease[J].N Engl J Med,2005,352(14):1425-1435.
[7] 周 程,刘福林,李鹤飞,等.辛伐他汀对兔动脉粥样硬化斑块结构及巨噬细胞移动抑制因子的影响[J].实用医学杂志,2012,28(22):3703-3705.
[8] 张 敏,宁亚媛,陈丽娟,等.阿托伐他汀对ApoE-/-小鼠动脉粥样硬化模型中血清一氧化氮、肿瘤坏死因子-α表达的影响[J].实用医学杂志,2012,28(5):715-717.
[9] Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s[J].Nature,1993,362(6423):801-809.
[10] Toshima S,Hasegawa A,Kurabayashi M,et al.Circulating oxidized low density lipoprotein levels.A biochemical risk marker for coronary heart disease[J].Arterioscler Thromb Vasc Biol,2000,20(10):2243-2247.
[11]Morel DW,de la Llera-Moya M,Friday KE.Treatment of cholesterol-fed rabbits with dietary vitamins E and C inhibits lipoprotein oxidation but not development of atherosclerosis[J].J Nutr,1994,124(11):2123-2130.
[12]霍 超,纳文娟,徐桂花.玉米油的主要功效成分及开发应用前景[J].中国食物与营养,2008,14(10):37-38.
[13] Kritchevsky D,Tepper SA,Wright S,et al.Cholesterol vehicle in experimental atherosclerosis 24:avocado oil[J].J Am Coll Nutr,2003,22(1):52-55.
[14]王 佐,吕运成,唐朝克,等.苦瓜抗兔动脉粥样硬化实验研究[J].中国病理生理杂志,2005,21(3):514-518.
[15]Boger RH,Bode-Boger SM,Kienke S,et al.Dietary L-arginine decreases myointimal cell proliferation and vascular monocyte accumulation in cholesterol-fed rabbits[J].Atherosclerosis,1998,136(1):67-77.
[16]刘军妮,徐冬玲,杜贻萌,等.脂蛋白相关磷脂酶A2与兔易损斑块的相关性研究[J].中国病理生理杂志,2010,26(4):669-675.
[17] Ramachandran HD, NarasimhamurthyK, RainaPL.Effect of oxidative stress on serum and antioxidant enzymes in liver and kidney of rats and their modulation through dietary factors[J].Indian J Exp Biol,2002,40(9):1010-1015.
[18] Hartvigsen K,Binder CJ,Hansen LF,et al.A diet-induced hypercholesterolemic murine model to study atherogenesis without obesity and metabolic syndrome[J].Arterioscler Thromb Vasc Biol,2007,27(4):878-885.
[19] Ozaki MR,de Almeida EA.Evolution and involution of atherosclerosis and its relationship with vascular reactivity in hypercholesterolemic rabbits[J].Exp Toxicol Pathol,2013,65(3):297-304.
[5] Xu F,Zhang C,Graves DT.Abnormal cell responses and role of TNF-α in impaired diabetic wound healing[J].Biomed Res Int,2013,2013:754802.
[6] Hao ML,Dai YY,Ni SR,et al.The role of JNK in apoptosis of renal tubular epithelial cells in diabetic rats with fluctuant high blood glucose[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2012,28(4):309-312.
[7] 李素娟,李剑敏,汪 洋,等.氧化应激和P53参与波动高糖诱导的肾小管上皮细胞凋亡[J].中国病理生理杂志,2011,27(12):2302-2306.
[8] Risso A,Mercuri F,Quagliaro L,et al.Intermittent high glucose enhances apoptosis in human umbilical vein endothelial cells in culture[J].Am J Physiol Endocrinol Metab,2001,281(5):E924-E930.
[9] 金可可,林艳红,王万铁,等.血糖波动对糖尿病大鼠肾小球内皮细胞和肾小管上皮细胞凋亡的影响[J].中国病理生理杂志,2007,23(3):570-573.
[10]Vlassara H,Bucala R,Striker L.Pathogenic effects of advanced glycosylation:biochemical,biologic,and clinical implications for diabetes and aging[J].Lab Invest,1994,70(2):138-151.
[11]Peppa M,Brem H,Ehrlich P,et al.Adverse effects of dietary glycotoxins on wound healing in genetically diabetic mice[J].Diabetes,2003,52(11):2805-2813.
[12] Goova MT,Li J,Kislinger T,et al.Blockade of receptor for advanced glycation end-productsrestoreseffective wound healing in diabetic mice[J].Am J Pathol,2001,159(2):513-525.
[13] Zhu P,Yang C,Chen LH,et al.Impairment of human keratinocyte mobility and proliferation by advanced glycation end products-modified BSA[J].Arch Dermatol Res,2011,303(5):339-350.
