气相色谱方法同时测定果蔬及粮谷中6种除草剂残留
2014-07-25李丽娟翁柔丹王秀珍吴诗韵
李丽娟,吴 青,翁柔丹,王秀珍,吴诗韵
(华南农业大学食品学院,广东省食品质量安全重点实验室,广东广州 510642)
近年来,我国对除草剂的需求量和使用量逐年上涨,氟乐灵(trifluralin)、2,4-D丁酯(2,4-D butylate)、乙草胺(acetochlor)、甲草胺(alachlor)、异丙甲草胺(metolachlor)、丁草胺(butachlor)是其中需求量较大的几个品种[1]。除草剂的广泛使用会导致其在农作物产品上的残留,从而通过食物链进入人体,进而危害人类健康。氟乐灵是一种二硝基苯胺类除草剂,有研究[2]证明它可能会对大鼠肝、肾微粒体酶产生影响。2,4-D丁酯是一种苯氧羧酸类除草剂,在我国生产量、使用量和出口量非常大,有研究[3]显示2,4-D丁酯会影响6~10岁儿童的行为和智力。酰胺类除草剂在全球除草剂市场中位列第三,销量最大的品种主要包括甲草胺、乙草胺、异丙甲草胺和丁草胺[4]。动物实验[5-7]证明,甲草胺、乙草胺、异丙甲草胺和丁草胺本身或通过一系列酶反应后具有致癌或致突变性。传统的样品前处理技术(索氏提取、振荡提取、液-液萃取法)费时,消耗大量溶剂且不适合大批量样品的处理[8-9],已无法满足农药残留快速准确检测的需要。QuEChERS方法是2003年美国农业部开发的一种新的农残分析前处理方法,主要应用于农药多残留分析检测领域,具有操作简单、节约溶剂、分析时间短、成本低、应用范围广的特点[10]。目前国内外对这6种除草剂的检测以单残留分析[11-12]或同一类的多残留分析[13-16]较多,也有对某几种不同类除草剂同时检测的报道[17-18],其中QuEChERS方法已应用到同一类除草剂的多残留检测中[15-16],但目前未见同时检测这6种除草剂的QuEChERS-GC方法报道。本文研究建立了可同时检测果蔬和粮谷等基质复杂样品中这6种除草剂的QuEChERS-GC方法。此方法快速、简便、节约溶剂,适合于样品的批量处理,并能满足分析要求。
1 材料与方法
1.1 材料与仪器
氟乐灵(99.0%)、2,4-D丁酯(99.0%)、乙草胺(97.0%)、甲草胺(99.0%)、异丙甲草胺(98.0%)、丁草胺(98.0%)标准品 Sigma公司;正己烷(色谱纯)
Honeywell公司;石墨化炭黑(GCB)、乙二胺-N-丙基硅烷(PSA)、十八烷基硅烷(ODS C18) Agela Technologise公司;其他试剂 均为分析纯。
Clarus 600气相色谱仪带电子捕获检测器(ECD)、82位自动进样器 美国Perkin Elmer公司;DB-1701色谱柱(30m×0.25mm,0.25μm) 美国Agilent公司;KQ-100DE数控超声波清洗器 昆山市超声仪器有限公司;高速离心机 德国Eppendorf公司;旋转蒸发仪 日本EYELA公司;WX-80A旋涡混合器 上海精科实业有限公司;搅拌机 飞利浦家庭电器有限公司;高速组织匀浆机 上海标本模型厂。
1.2 实验方法
1.2.1 样品前处理 蔬菜水果类:将样品搅碎,用高速匀浆机(15000r/min)匀浆至糊状,称取10.0g样品(精确到0.01g)于50mL聚四氟乙烯离心管中,加入20mL乙腈,加入3g氯化钠和5g无水硫酸镁,振荡1min,超声(135W,42kHz)10min,4000r/min离心5min。取上清液5mL置于另一50mL离心管中,加入175mg PSA、25mg C18、60mg GCB和500mg无水硫酸镁,涡旋振荡4min,4000r/min离心10min,将上清液全部转移至梨形瓶中,旋转蒸发仪上蒸干,用正乙烷复溶,定容至1mL,溶液经0.22μm滤膜过滤,备用。
粮谷类:将样品粉碎,过40目筛,称取5.0g样品(精确到0.01g)于50mL聚四氟乙烯离心管中,加入5mL水轻轻摇晃使样品分散,加入20mL乙腈,加入3g氯化钠和5g无水硫酸镁,振荡1min,超声(135W,42kHz)10min,4000r/min离心5min。取上清液10mL置于另一50mL离心管中,加入250mgPSA、200mg C18和500mg无水硫酸镁,涡旋振荡3min,4000r/min离心10min,将上清液全部转移至梨形瓶中,旋转蒸发仪上蒸干,用正乙烷复溶,定容至1mL,溶液经0.22μm滤膜过滤,备用。
1.2.2 色谱条件 色谱柱:DB-1701(30m×0.25mm,0.25μm);载气:氮气,恒流模式,流速为1.0mL/min;尾吹气:氮气,60mL/min;进样口温度:230℃;检测器温度:300℃;进样量:1.0μL;进样方式:不分流进样。升温程序:150℃保持1min,以20℃/min升温到245℃保持10min,再以5℃/min升温到260℃保持5min。
1.2.3 净化条件的优化 通过预实验选取对除草剂回收率影响大的因素做正交实验。果蔬样品采用PSA含量、C18含量、GCB含量以及净化时间进行四因素三水平L9(34)正交表设计实验,粮谷样品采用PSA含量、C18含量、净化时间进行三因素三水平L9(33)正交表设计实验,以除草剂的回收率为指标,筛选出最佳的净化条件,正交实验因素水平如表1、表2所示。

表1 果蔬正交实验因素水平表Table 1 Factors and levels table of orthogonal test of vegetables and fruits

表2 粮谷正交实验因素水平表Table 2 Factors and levels table of orthogonal test of cereals
2 结果与分析
2.1 提取溶剂的选择
分别采用0.1%冰乙酸-正乙烷饱和的乙腈溶液、乙酸乙酯、丙酮和乙腈对样品中的除草剂进行提取,结果发现,用0.1%冰乙酸-正乙烷饱和的乙腈溶液、乙酸乙酯、丙酮提取时,蔬菜提取液颜色较深,且出现黄绿色粘稠状液层;而粮谷类样品提取液较浑浊,浓缩之后也有黄色的粘稠状物质析出,这样的提取液容易污染仪器系统,影响色谱柱的使用寿命,且在色谱图中出现基质干扰严重的现象,回收率偏高(在120%以上),影响目标物的检测和定量。而用乙腈作提取溶剂时,无论是果蔬样品还是粮谷类样品,提取出的脂溶性色素、油脂等杂质较少,提取液经吸附剂净化后颜色较浅,净化效果好,回收率高。在80%~110%之间。因此选用乙腈作为提取剂。
2.2 净化条件的选择
2.2.1 吸附剂的选择 乙二胺-N-丙基硅烷(PSA)同时含有伯胺、仲胺两个氨基,是一种弱阴离子交换吸附剂,对果蔬中的色素、有机酸、糖及其他基质共萃取物均有良好净化能力,配合使用石墨化炭黑粉吸附色素,其净化效果更佳[19];石墨化炭黑(GCB)能有效去除色素如叶绿素和类胡萝卜素,特别对含色素丰富的果蔬样品有较好净化能力[20];十八烷基硅烷(C18)具有疏水作用,对非极性组分有吸附作用,去除蛋白质和脂肪的效果较好[21]。对于果蔬样品,研究发现仅采用PSA,色素去除效果不理想,干扰峰多,影响定量,见图1A;而复配使用PSA、C18和GCB净化提取液,可使净化液呈浅色或无色,干扰峰少,基质干扰小,净化效果好,见图1B。对粮谷样品,仅复配使用PSA和C18就能够有效去除样品中的色素、脂肪和蛋白质等杂质。依此结果设计果蔬及粮食的正交实验因素。

图1 PSA处理样品(A)和PSA、C18、GCB混合处理样品(B)色谱图Fig.1 Chromatograms of samples after dealt with PSA(A)and with mixture of PSA,C18,GCB(B)
2.2.2 净化条件的优化 通过单因素实验得到最佳的单因素水平,在最佳单因素水平附近选取另外两个水平,设计四因素三水平的正交实验L9(34),对果蔬中6种除草剂的净化剂用量和净化时间进行优化,以6种除草剂的平均回收率为参考指标,结果见表3。
由R值大小可知,影响6种除草剂回收率的因素顺序为C(GCB)>A(PSA)>B(C18)>D(净化时间)。选择各因素最大K值对应的水平,确定出果蔬最佳净化条件为A3B1C1D3,即PSA为175mg,C18为25mg,GCB为60mg,净化时间(涡旋振荡)4min,按这个条件进行了样品前处理分析和平行实验,得出平均回收率是93.25%。这个结果虽然略低于正交实验中的第8组实验结果,但它的回收率以及相对标准偏差仍在标准范围内,且B1对应的C18的用量(25mg)低于第8组中B2对应的C18的用量(50mg),降低了前处理成本。
粮谷类由于色素含量不高,仅复配PSA和C18就能够去除样品中的油脂、蛋白质、色素等杂质,因此选择PSA用量、C18用量和净化时间三个单因素设计三因素三水平L9(33)的正交实验,以6种除草剂的平均回收率为参考指标,结果见表4。

表3 果蔬正交实验结果表Table 3 Analysis of orthogonal test of vegetables and fruits

表4 粮谷正交实验结果表Table 4 Analysis of orthogonal test of cereals
由R值大小可知,影响6种除草剂回收率的因素顺序为A(PSA)>B(C18)>C(净化时间)。选择各因素最大K值对应的水平,确定出粮谷类最佳净化条件为A3B2C1,即PSA为250mg,C18为200mg,净化时间(涡旋振荡)3min,此时的回收率为99.78%。
2.3 方法学考察
2.3.1 标准曲线、线性范围和检出限(LOD) 采用摸索出的最佳色谱条件分析6种除草剂,获得的色谱图见图2。从图2可见,6种除草剂得到良好的分离,且在18min内完成检测。
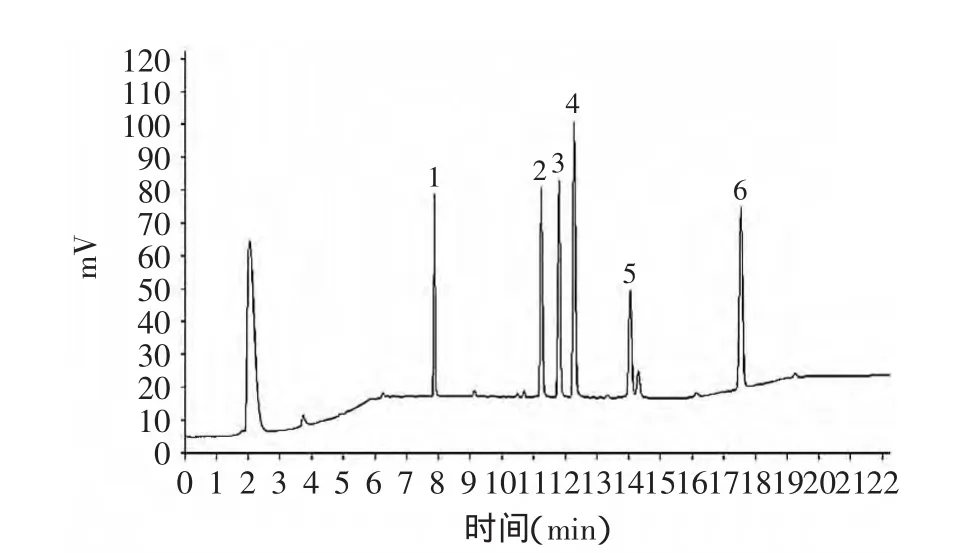
图2 6种除草剂色谱图Fig.2 Chromatogram of six herbicides
取空白样品提取液作为6种除草剂标准品的稀释液,配制一系列浓度的标准工作液:氟乐灵的浓度为0.005、0.01、0.02、0.05、0.1μg/mL,2,4-D丁酯、乙草胺、甲草胺、异丙甲草胺和丁草胺的浓度为0.05、0.1、0.2、0.5、1.0μg/mL,以各浓度峰面积Y对相应浓度X绘制标准曲线,计算回归方程和相关系数,结果见表5。氟乐灵在0.005~0.1μg/mL范围内有良好的线性关系,其余5种除草剂在0.05~1.0μg/mL范围内有良好的线性关系,R2均大于0.999。
以信噪比S/N=3计算6种除草剂的检出限(LOD),从表5可知,6种除草剂的检出限在0.002~0.03μg/mL之间。

表5 6种除草剂的线性范围、回归方程、相关系数及检出限Table 5 Linear ranges,regression equations,correlation coefficients and limit of detection of six herbicides
2.3.2 加标回收率、相对标准偏差及最低定量限(LOQ) 在10.0g空白青菜中添加适量6种除草剂标准混合液,每个添加量平行三份,采用摸索出的最佳净化条件处理样品,进行加标回收率实验,得到的回收率、相对标准偏差和LOQ见图3和表6。
结果表明,三份平行样品中,6种除草剂的平均回收率均大于80%;相对标准偏差在2.02%~8.28%之间;以信噪比S/N=10计算6种除草剂的定量限LOQ,氟乐灵的LOQ为0.002mg/kg,2,4-D丁酯、乙草胺、甲草胺、异丙甲草胺和丁草胺的LOQ为0.02mg/kg。
2.4 实际样品分析
采用本文建立的方法对市售的水果蔬菜、粮谷中的除草剂进行了检测,结果见表7。从表7可见,在6种除草剂中,除未检测出丁草胺外,其余5种除草剂在不同的食品中均有检出,有些食品还同时检测出2种除草剂。

图3 6种除草剂加标色谱图Fig.3 Chromatogram of six herbicides with the spiked sample

表6 6种除草剂的平均加标回收率、相对标准偏差及LOQTable 6 Recovery,relative standard deviation and the limit of quantification of six herbicides
GB2763-2012《食品中农药残留最大限量》中规定玉米中氟乐灵、2,4-D丁酯、乙草胺的最大残留限量为0.05mg/kg,甲草胺为0.2mg/kg,异丙甲草胺为0.1mg/kg,丁草胺为0.5mg/kg;花生仁中氟乐灵、甲草胺的最大残留限量为0.05mg/kg,乙草胺为0.1mg/kg,异丙甲草胺为0.5mg/kg;大豆中氟乐灵的最大残留限量为0.05mg/kg,乙草胺为0.1mg/kg,甲草胺为0.2mg/kg,异丙甲草胺为0.5mg/kg;糙米中乙草胺、甲草胺的最大残留限量为0.05mg/kg,异丙甲草胺为0.1mg/kg;大米中丁草胺的最大残留限量为0.5mg/kg。检测结果显示在所检的粮谷类样品中,未见6种除草剂残留量超标情况。目前国标还没有规定上述6种除草剂在蔬菜水果中的最大残留限量,但实际检测结果显示,在10种蔬菜中,有5种蔬菜有除草剂残留。

表7 样品分析结果Table 7 Analytical results of samples
3 结论
建立了测定蔬菜水果和粮谷类食品中6种除草剂(氟乐灵、2,4-D丁酯、乙草胺、甲草胺、异丙甲草胺、丁草胺)的QuEChERS-GC方法,样品前处理快速、简便,节约溶剂。所建立的方法在18min内即可完成6种除草剂的同时检测,具有快速、简便、可批量处理、实用性强等特点,可作为监控果蔬和粮谷中除草剂残留检测的一种快速、简便的方法。
[1]束放,赵青.我国农药市场2012年概况及2013年展望[J].中国植保导刊,2013,33(2):44-47.
[2]杜柳涛,邬惠琼,杨杏芬,等.氟乐灵对大鼠肝、肾微粒体酶的影响[J].中国职业医学,2000,27(5):16-18.
[3]鲁彦,祝丽玲,姚崇坡,等.儿童血清中2,4-D丁酯水平与行为、智力的关系[J].中国妇幼保健,2013,28(20):3294-3296.
[4]徐会娟,何红波,武叶叶,等.氯乙酰胺类除草剂的环境行为和生态效应研究[J].土壤通报,2009,40(5):1226-1230.
[5]王琪全,彭展雄.几种酰胺类除草剂的光降解及其致突变性[J].环境科学,1999,20(4):51-54.
[6]Coleman S.Comparative metabolism ofchloroacetamid herbicides and selected metabolites in human and rat liver microsomes[J].Envir Heaith Perspect,2000,108:1151-1159.
[7]Nelson G B,Ross A J.DNA adduct formation by the Pesticide alachlor and its metabolite 2-chloro-N-(2,6-diethylphenyl)acetamide(CDEPA)[J].Bull Environ.Contamon Tpxicol,1998,60(3):387-394.
[8]胥荣燕.食品中农药残留检测的样品前处理技术[J].科技创新导报,2012,20(7):10.
[9]王慧卿,于劲松,徐斐,等.食品农药残留检测中样品前处理技术研究进展[J].广东农业科学,2013(8):111-114.
[10]Anastassiadesl M,Katerina M,Steven J L.Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides[J].Chromatography A,2003,1015(1):163-184.
[11]李晓玉,王梅,隋涛,等.气相色谱-质谱法测定肉及肉制品中的2,4-D丁酯[J].食品科学,2011,32(4):193-195.
[12]王建华,储晓刚.凝胶渗透色谱-气相色谱-质谱测定花生中乙草胺的残留量[J].分析实验,2007,26(12):31-34.
[13]Rocha C,Pappas E A,Huang C H.Determination of trace triazine and chloroacetamide herbicides in tile-fed drainage ditch water using solid-phase micro-extraction coupled with GC-MS[J].Environmental Pollution,2008,152:239-244.
[14]周艳明,刘鹏宇,忻雪.GC-ECD法在玉米酰胺类除草剂多残留检测中的应用[J].江苏农业科学,2009(3):350-351.
[15]周瑶敏,熊艳,袁林峰,等.分散固相萃取法快速测定大米中的酰胺类除草剂[J].中国粮油学报,2010,25(8):113-116.
[16]陈其勇,郑文杰,肖亚兵,等.果蔬中二甲戊乐灵、氟乐灵、双丁乐灵残留测定[J].食品研究与开发,2011,32(9):155-158.
[17]藏小丹,牟光庆.气相色谱法同时测定大豆中多种除草剂的残留[J].食品研究与开发,2010,31(3):132-134.
[18]李瑞娟,张晓梅,于建垒,等.气相色谱法同时测定玉米和土壤中乙草胺和2,4-D丁酯残留[J].现代农药,2011,10(9):34-36.
[19]曾正宏,陈勇,杨瑞章,等.分散固相萃取-气相色谱-质谱法测定水果和蔬菜中扑草净和禾草丹残留量[J].理化检测-化学分册,2010,46(9):1046-1048.
[20]朱莉萍,朱涛,潘玉香,等.气相色谱法同时测定蔬菜及水果中多种农药残留量[J].分析化学研究简报,2008,36(7):999-1003.
[21]石丽丽,李军国,李俊,等.分散固相萃取-气相色谱-质谱方法快速检测奶牛饲料中的3种除草剂残留[J].中国畜牧兽医,2011,38(8):48-51.
