基于能带匹配理论设计CO2光催化还原催化剂的研究进展
2014-07-05彭辉吴志红张建林卢静吴晨啸李培强尹洪宗
彭辉,吴志红,张建林,卢静,吴晨啸,李培强,尹洪宗
(1山东农业大学化学与材料科学学院,山东泰安 271018;2黄河三角洲京博化工研究院,山东滨州 256600)
基于能带匹配理论设计CO2光催化还原催化剂的研究进展
彭辉1,吴志红2,张建林2,卢静1,吴晨啸1,李培强1,尹洪宗1
(1山东农业大学化学与材料科学学院,山东泰安 271018;2黄河三角洲京博化工研究院,山东滨州 256600)
光催化还原CO2过程中,能带隙小的材料具备优良的可见光吸收性能,但吸收的可见光并不一定能够有效地被光催化还原作用所利用,这与催化剂能带位置有着直接关系,改变材料的能带结构对调节材料的氧化还原性能有着重要影响。本文从光催化还原CO2的基本原理出发,介绍了半导体催化剂光催化还原CO2的基本过程及催化剂价带、导带位置的决定性作用,简述了当今光催化还原CO2过程中存在的催化剂价带、导带不匹配问题,并从特定晶面生长、材料复合、形成p-n结、第一性原理等方面综述了如何利用能带匹配理论来提高光催化还原CO2效率,为光催化还原CO2的材料的选择和设计提供了理论依据。
二氧化碳;光化学;还原;能带;半导体
据报道,2012年全球二氧化碳排放量又创下了历史新高,达到了356亿吨[1]。据政府气候变化专门委员会发布的最新气候变化评估报告显示,在过去的一百年里,由于CO2等气体造成了严重的温室效应,致使全球温度升高了0.3~0.6℃[2],海平面平均升高了10~25cm,自然灾害频繁发生,直接威胁到人类的生存与发展[3]。如何在保持并不断改善民众生活质量的同时控制CO2排放量,成为全球面临的巨大挑战。
在此问题的推动下,如何将CO2变废为宝成为人们研究的重点。CO2作为一种潜在的碳资源,催化加氢转化为醇类等[4]化学品已有相关报道,如将其还原成CO[5]、作为油田驱油材料[6]、与甲烷混合气综合利用[7]、逆化学合成[8-9]等。 这些传统的CO2转化方法主要存在两大技术难题:一是氢仍是从化石原料中获取,转化的同时还会伴随CO2产生,没有从根本上解决当前面临的温室效应问题[10-11];二是这些传统的方法仍是借助于高温高压的模式,需要大量的能耗,绿色、廉价、可持续再生驱动力的寻找也成为转化CO2的关键。
光催化还原CO2在此条件下应运而生,它是基于模拟绿色植物光合作用固定CO2而产生的[12]。自然界植物的光合作用是植物利用太阳能把CO2和水合成有机物,并放出氧气的过程。这一过程在常温常压的环境下进行,是以地球上最廉价易得的H2O作氢源,利用太阳能来驱动CO2的还原。因此,光合作用是CO2减排最具前景的方法[13-15]。基于此产生的光催化还原的氢来源于水,是洁净的环境友好型新能源,直接驱动力是太阳能,不会额外产生CO2。1978年,Halmann[16]在Nature上首次报道了利用半导体材料催化还原CO2,得到了甲醛、甲醇等产物,开启了人们催化还原CO2的新纪元。Ampelli等[17]报道了以自然光为光源,在常温常压下建立模拟光合作用,实现CO2循环。Yamashita 等[18]以TiO2为催化剂光催化还原CO2,成功检测到了产物甲醇。光催化还原CO2受到越来越多国内外科研工作者的关注。
但是CO2能级比较低,惰性大,难以活化,其本身也无法吸收200~900nm的可见光和紫外光,因此,CO2的光催化还原需要借助光催化剂[19]。用于光催化反应的催化剂材料主要是半导体,催化条件的发生主要有两个基本要求:一是对光频率的要求,即所吸收光子的能量,必须能使价带上的电子跨越禁带能隙达到导带,才能完成激发,即材料对光的吸收与能隙有关,不同的半导体有着不同的能带隙,即禁带宽度;二是半导体能带的位置决定着光生电子和空穴的氧化还原能力[20-22]。因此,能带匹配成为决定半导体光催化性能的关键因素。目前,还鲜有针对这一问题的详细综述,本文以此为出发点,从光催化还原CO2的基本原理出发,综述了如何利用能带匹配理论来改善提高光催化还原CO2效率,为光催化还原CO2材料的选择和设计提供了理论依据,具有一定的借鉴作用。
1 光催化还原CO2的基本原理
光催化反应中的半导体催化剂不同于其他金属材料,它的价带和导带是不连续的,中间有禁带的存在[23]。半导体的光催化反应是以光能为驱动力的氧化-还原过程,其电子的激发与传递过程与植物光合作用的过程相类似,具体包含两个基本过程:一是CO2在光催化材料表面反应位点的吸附;二是CO2与光生电子-空穴之间的转化过程[24-26]。因此,要激发并分离光生电子-空穴对,照射到半导体材料上光的能量要大于或等于禁带宽度,而这些光生载流子能量主要取决于光催化剂价带和导带的位置[27]。如图1所示,当照射到半导体材料上光的能量大于或等于禁带宽度时,晶体内的电子受到激发从价带跃迁到导带,从而在价带上产生空穴,由于空穴有很强的氧化能力,可以从H2O中夺取电子,并放出氧气,同时提供CO2还原所需要的氢质子;导带产生光生电子,光生电子用于CO2的还原[28]。
2 CO2光催化还原中催化剂材料价带、导带的不匹配问题
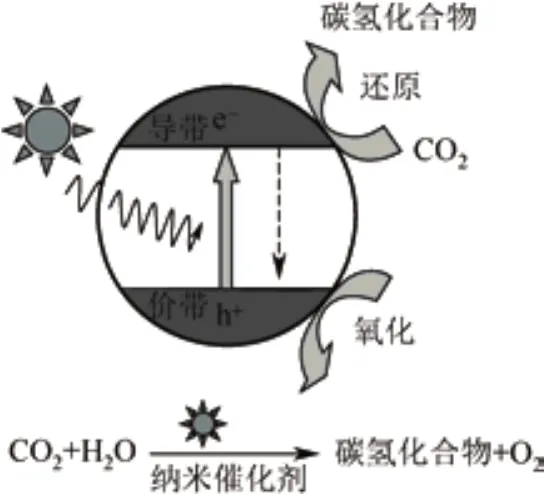
图1 光催化还原CO2为碳氢燃料结构示意图[29]
在实际实验中发现,有些材料虽然禁带宽度很小,但还是不能达到还原的目的,人们渐渐意识到,还原反应的发生不仅仅与禁带宽度有关,还与半导体导带、价带所处的电势位置有关[30-32]。不同的半导体材料有着不同的价带、导带,并且从热力学角度来讲,半导体导带要比表面电子受体的电势更高(更负),光生电子才能传递给电子受体;而价带要比表面电子给体的电势更低(更正),才能使电子由表面给体传递给空穴,这就解释了为什么某些半导体材料禁带宽度很小、依旧不能光催化还原CO2的原因,那就是它们的价带导带位置不合适,换言之,就是能带不匹配。因此,半导体材料裂解水光催化还原CO2必须要有合适的价带和导带。以将CO2光催化还原为甲醇为例,当参比电极为饱和甘汞电极时,CO2/CH3OH的还原电位为-0.38V,要达到将CO2还原为甲醇的目的,材料的导带电位要比CO2/CH3OH的还原电位更负(小于-0.38V),而材料的价带要比H2O/O2的氧化电位更正(大于0.82V),只有材料同时具备足够强的光还原能力和足够强的氧化能力将水裂解,为CO2光催化还原提供氢质子,才能真正原位完成CO2的光催化转化过程[33-36]。图2是不同产物的还原电位与主要半导体催化材料的能带分布示意图[23],该图可以为CO2选择性转化时材料的选择提供理论依据。
然而,通常单一的催化材料无法同时具备合适的氧化和还原能力。如CuO的价带为0.80eV(表1),略低于0.82V,不具备氧化裂解水的能力[10],但其导带位置为-0.80eV,比CO2/CH3OH的还原电位(-0.38V)更负,具备足够强的还原能力。而TiO2的价带虽然高于H2O/O2的氧化电位,但导带位置较正,还原能力差[37]。因此大部分单一的半导体材料很难同时满足既具有合适的价带又具有合适的导带,这就决定了无法直接光催化还原CO2,并将其还原转化为产物。如何改进催化材料的价带、导带与禁带宽度,使其与目标产物的氧化还原电位匹配,成为实现光催化还原CO2的关键性因素。
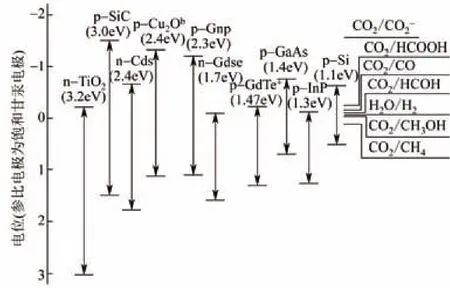
图2 不同产物的还原电位与主要半导体催化材料能带分布[23]
3 CO2光催化还原催化材料能带匹配的改进方法
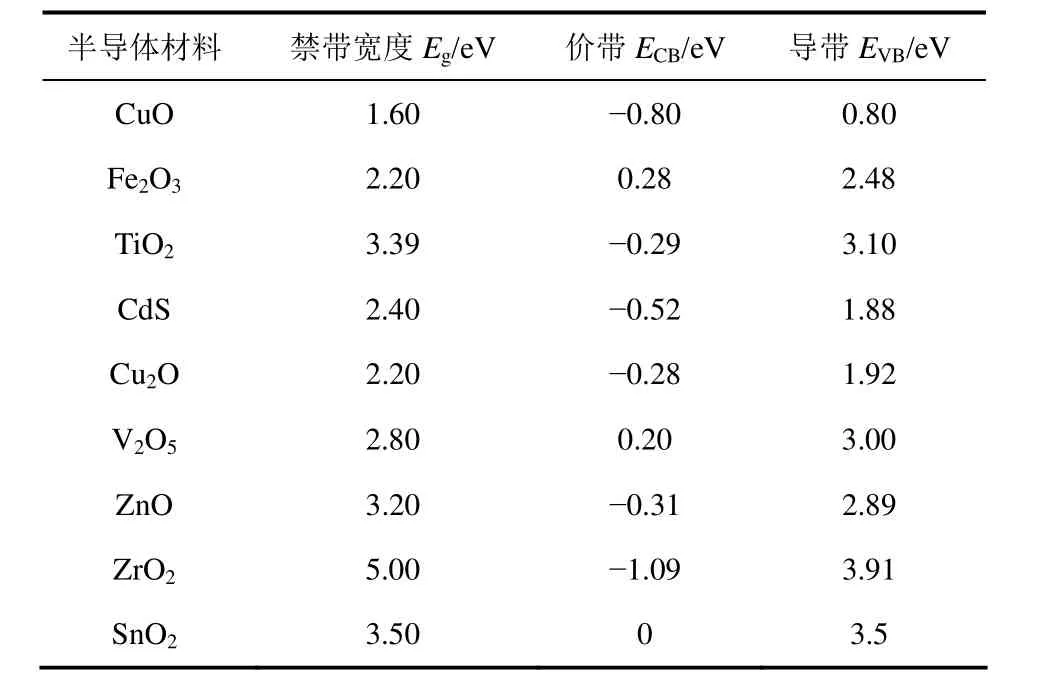
表1 常见半导体材料的价带和导带
针对以上单一材料无法满足能带匹配的问题,本文从以下四方面进行了综述分析,并提出了相应的改进方法。
3.1 单一材料的晶型结构改变对能带的影响
对于单一催化材料,改变材料的晶型结构对能带有明显影响。如常用光催化半导体材料TiO2,其(100)晶面的催化性能较好。与其他晶面相比,该晶面具有更好的原子结构,即Ti5c结构,该原子结构在光催化反应中起到活性位点的作用,可以提高材料的光催化还原性能[38-40];(100)晶面还具有优越的电子能带结构,相对于其他晶面的TiO2具有更窄的带隙,光激发后导带电位更负,光生电子还原能力更强,更有利于其光催化还原CO2,因此,为了提高TiO2材料表面(100)晶面比率,Xu等[41]制备了TiO2纳米片结构,与传统棱柱形TiO2单晶结构相比,该纳米片材料表面(100)晶面比率达到了95%(图3),大大提高了催化材料光催化还原CO2的能力。
晶型结构的改变也对半导体能带产生影响。如金红石型的TiO2相对于锐钛矿晶型,带隙能较小,有利于光的吸收[42]。但因其导带位置过正,价带位置过负,光生电子-空穴容易复合,大部分研究者也证实它的光催化活性低于锐钛矿型TiO2[43]。针对晶型结构对催化材料能带的影响,人们可以运用特定的方法,有针对性地制备特定晶型结构的材料,调制出带隙和导带、价带位置合适的催化剂,进而获得良好的催化活性。
3.2 不同材料复合改变能带结构

图3 锐钛矿TiO2单晶不同晶面结构示意图[41]
井华等[44]也运用此原理制备了CdSeTe负载的TiO2纳米管复合电极,用于光电催化还原CO2,TiO2由于其性能优越、价格低廉,成为现在研究最广泛的体系之一,但其禁带宽度为3.2eV,只能吸收波长小于385nm的紫外光,大大限制了其广泛应用[18,45-46]。CdSeTe具有优良的光学性能与热稳定性,但其带隙过小,在光催化过程中易被自身产生的光生空穴氧化为氧化物,从而失去活性[47-48]。研究者将CdSeTe负载到宽带隙的TiO2上,复合材料能隙为1.48eV,可以被838nm以下的太阳光激发,有效吸收利用可见光,导带、价带分别为-0.46eV、1.02eV,有足够的驱动力在催化还原CO2的同时裂解水,完成CO2的转化过程。本实验室的研究还发现,将两种不同带隙的材料复合,其中一个具有较正的价带,一个具有较负的导带,本身都无法单独完成光催化还原CO2,但结合后复合材料的价带与导带相对于原材料都发生明显变化,最终应用于光催化还原CO2。如图4所示,Fe2O3的价带位置高于H2O/O2的氧化电位,有足够的氧化能力裂解水产生氢气,但其导带位置高于CO2/CH3OH的还原电位,不具备还原CO2的能力[49-50]。将其与CuO复合后,复合材料在保持其氧化能力的同时,导带低于CO2/CH3OH的还原电位,具备了足够的还原能力光电催化还原CO2。因此,通过两种或两种以上材料的复合,可以完成光催化还原CO2的能带匹配。
3.3 形成p-n结提高电荷传递速率
通过研究发现,在n型半导体中,电子很多但空穴很少,而在p型半导体中,空穴很多但电子很少,这就使单一半导体电荷流动性差,催化效率低[52-53]。所以人们尝试将n型半导体与p型半导体复合,提高催化性能,从而导致了p-n结的发现。当形成p-n结时,不同半导体之间存在着载流子浓度梯度,空穴从p区到n区移动,而电子从n区到p区扩散[54]。如常用的半导体光催化剂TiO2,存在量子效率低、不能有效利用可见光等缺点[55],而异质结的内建电场能有效抑制光致电荷复合,从而提高量子效率。因此,将TiO2与窄带半导体构成异质结,能拓宽TiO2的光响应范围,从而克服其缺点。Li等[56]尝试将n-Fe2O3与p-NiO复合,改善赤铁矿价带与氢还原电位不匹配、电子对保留时间短、电荷流动性差等缺点。通过有光无光下Mott-Schottky曲线,证明了p-n结的确形成。如图5所示,Fe2O3与NiO结合形成p-n结后,电子从费米能级高的材料转移到费米能级低的材料,直至两者费米能级匹配。在可见光的照射下,Fe2O3中的光生电子向NiO价带转移,光生电子空穴有效分离,电荷转移速度明显增加,光催化活性增强。因此,人们可以尝试将单一半导体复合,通过异质结的特殊性能改善材料电荷转移速率,提高光催化能力。
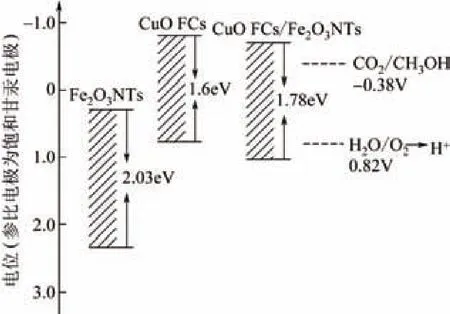
图4 CuO、Fe2O3与复合材料能带位置与CO2还原电势的能带匹配示意图[51]
3.4 第一性原理计算能带匹配程度
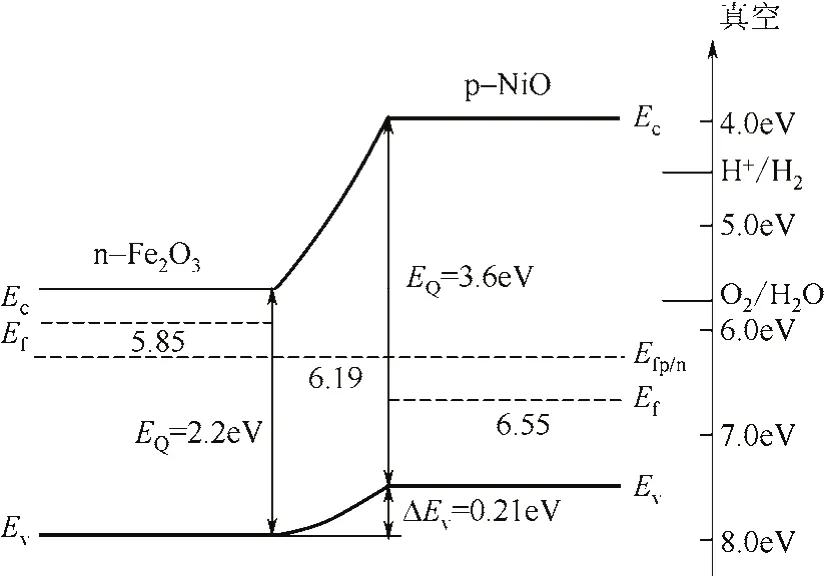
图5 赤铁矿与NiO形成p-n结后能带排布与价带偏移[56]
还可以利用第一性原理模拟设计材料,即在正确地描述电子状态和作用于各原子间力的基础上进行分子动力学模拟[57-58]的方法。Li[59]多次运用第一性原理计算研究不同半导体负载过程中材料结构、电子性能、氧化还原带等的变化,探究最佳条件下制备的催化材料。陈琨等[60]采用了基于密度泛函理论(DFT)的第一性原理平面波超软赝势方法,计算ZnO及Mn不同量掺杂ZnO的电子结构,成功分析了Mn的掺杂对ZnO能带结构的影响,结果表明,随掺杂量增加,ZnO禁带宽度增加,对紫外区光吸收能力增强。赵宗彦等[61]也运用此理论证明了3d过渡金属在禁带中的位置是决定TiO2吸收带边能否进行红移的关键性因素,为设计能带匹配TiO2掺杂材料提供了理论依据。第一性原理为设计出能带匹配的催化材料提供了理论依据和理论模型,势必在光催化还原CO2的研究中发挥重要作用。
4 结 语
具有匹配能带的材料设计是高效光催化还原CO2的关键。光催化剂的价带、导带位置决定了光生电子与空穴的氧化还原能力。本文从调节单一材料的晶型结构、不同带隙半导体材料复合、形成p-n结和运用第一性原理计算四方面综述了如何设计出能带匹配的光催化还原CO2的材料,为光催化还原CO2材料的选择和设计提供了理论依据,具有实际的借鉴作用。
[1] Cheng H F,Huang B B,Liu Y Y,et al. An anion exchange approach to Bi2WO6hollow microspheres with efficient visible light photocatalytic reduction of CO2to methanol[J].Chemical Communications,2012,48:9729-9731.
[2] Hoffmann M R,Martin S T,Choi W,et al. Environmental applications of semiconductor photocatalysis[J].Chemical Reviews,1995,95:69-96.
[3] Richardson P,Perdigoto M L,Wang W,et al. Heterogeneous photo-enhanced conversion of carbon dioxide to formic acid with copper-and gallium-doped titania nanocomposites[J].Applied Catalysis B:Environmental,2012,132:408.
[4] 熊卓,赵永椿,张军营,等. Ti基CO2光催化还原及其影响因素研究进展[J]. 化工进展,2013,32(5):1043-1052.
[5] Hori Y,Kikuchi K,Suzuki S. Production of CO and CH4in electrochemical reduction of CO2at metal electrodes in aqueous hydrogencarbonate solution[J].Chemistry Letters,1985,11:1695-1698.
[6] Issever K,Pamir A,Tirek A. Performance of a heavy-oil field under CO2injection,bati raman,turkey[J].SPE Reservoir Engineering,1993,8:256-260.
[7] Yang R Q,Xing C A,Lv C X,et al. Promotional effect of La2O3and CeO2on Ni/gamma-Al2O3catalysts for CO2reforming of CH4[J].Applied Catalysis A:General,2010,385:92-100.
[8] Olah G A,Goeppert A,Prakash G S. Chemical recycling of carbon dioxide to methanol and dimethyl ether:From greenhouse gas to renewable,environmentally carbon neutral fuels and synthetic hydrocarbons[J].The Journal of Organic Chemistry,2008,74:487-498.
[9] Jitaru M. Electrochemical carbon dioxide reduction-fundamental and applied topics[J].Journal of the University of Chemical Technology and Metallurgy,2007,42:333-344.
[10] Li C W,Kanan M W. CO2reduction at low overpotential on Cu electrodes resulting from the reduction of thick Cu2O films[J].Journal of the American Chemical Society,2012,134:7231-7234.
[11] Schmeier T J,Dobereiner G E,Crabtree R H,et al. Secondary coordination sphere interactions facilitate the insertion step in an iridium (III) CO2reduction catalyst[J].Journal of the American Chemical Society,2011,133:9274-9277.
[12] Roy S C,Varghese O K,Paulose M,et al. Toward solar fuels:Photocatalytic conversion of carbon dioxide to hydrocarbons[J].ACSNano,2010,4:1259-1278.
[13] Crous K Y,Reich P B,Hunter M D,et al. Maintenance of leaf N controls the photosynthetic CO2response of grassland species exposed to 9 years of free-air CO2enrichment[J].Global Change Biology,2010,16:2076-2088.
[14] Leakey A D,Ainsworth E A,Bernacchi C J,et al. Photosynthesis in a CO2-rich atmosphere[J].Photosynthesis,2012,34:733-768.
[15] Wijk V,Klaas J. Plant proteomics and photosynthesis[J].Photosynthesis,2012,34:151-173.
[16] Halmann M. Photoelectrochemical reduction of aqueous carbon dioxide on p-type gallium phosphide in liquid junction solar cells[J].Nature,1978,275:115.
[17] Ampelli C,Centi G,Passalacqua R,et al. Synthesis of solar fuels by a novel photoelectrocatalytic approach[J].Energy & Environmental Science,2010,3:292.
[18] Yamashita H,Nishiguchi H,Kamada N,et al. Photocatalytic reduction of CO2with H2O on TiO2and Cu/TiO2catalysts[J].Research on Chemical Intermediates,1994,20:815-823.
[19] Rakowski D M,Dubois D L. Development of molecular electrocatalysts for CO2reduction and H2production/oxidation[J].Accounts of Chemical Research,2009,42:1974-1982.
[20] Tsai C W,Chen H M,Liu R S,et al. Ni@NiO core–shell structure-modified nitrogen-doped in TaO4for solar-driven highly efficient CO2reduction to methanol[J].The Journal of Physical Chemistry C,2011,115:10180-10186.
[21] Yan Y,Zeitler E L,Gu J,et al. Electrochemistry of aqueous pyridinium:Exploration of a key aspect of electrocatalytic reduction of CO2to methanol[J].Journal of the American Chemical Society,2013,135:14020-14023.
[22] Heinemeyer A,Wilkinson M,Vargas R,et al. Exploring the “overflow tap” theory:Linking forest soil CO2fluxes and individual mycorrhizosphere components to photosynthesis[J].Biogeosciences,2012,9:79-95.
[23] Kumar B,Llorente M,Froehlich J,et al. Photochemical and photoelectrochemical reduction of CO2[J].Annual Review of Physical Chemistry,2012,63:541-569.
[24] Canfield D,Frese J K. Reduction of carbon dioxide to methanol on n-and p-GaAs and p-InP:Effect of crystal face,electrolyte and current density[J].Journal of the Electrochemical Society,1983,130:1772-1773.
[25] Taniguchi I,Aurian-Blajeni B,Bockris J M. The reduction of carbon dioxide at illuminated p-type semiconductor electrodes in nonaqueous media[J].Electrochimica Acta,1984,29:923-932.
[26] Liu C,Sun J,Tang J,et al. Zn-doped p-type gallium phosphide nanowire photocathodes from a surfactant-free solution synthesis[J].Nano Letters,2012,12:5407-5411.
[27] Benson E E,Kubiak C P,Sathrum A J,et al. Electrocatalytic and homogeneous approaches to conversion of CO2to liquid fuels[J].Chemical Society Reviews,2009,38:89-99.
[28] Dey G. Chemical Reduction of CO2to different products during photo catalytic reaction on TiO2under diverse conditions:An overview[J].Journal of Natural Gas Chemistry,2007,16:217-226.
[29] 吴聪萍,周勇,邹志刚. 光催化还原CO2的研究现状和发展前景[J]. 催化学报,2011,32(10):1565-1572.
[30] Sears W,Morrison S R. Carbon dioxide reduction on gallium arsenideelectrodes[J].The Journal of Physical Chemistry,1985,89:3295-3298.
[31] Gattrell M,Gupta N,Co A. A review of the aqueous electrochemical reduction of CO2to hydrocarbons at copper[J].Journal of Electroanalytical Chemistry,2006,594:1-19.
[32] Hara K,Sakata T. Electrocatalytic formation of CH4from CO2on a Pt gas diffusion electrode[J].Journal of the Electrochemical Society,1997,144:539-545.
[33] Barton E E,Rampulla D M,Bocarsly A B. Selective solar-driven reduction of CO2to methanol using a catalyzed p-GaP based photoelectrochemical cell[J].Journal of the American Chemical Society,2008,130:6342-6344.
[34] Barton C E,Lakkaraju P S,Rampulla D M,et al. Using a one-electron shuttle for the multielectron reduction of CO2to methanol:Kinetic,mechanistic,and structural insights[J].Journal of the American Chemical Society,2010,132:11539-11551.
[35] Kaneco S,Iiba K,Ohta K,et al. Electrochemical CO2reduction on a copper wire electrode in tetraethylammonium perchlorate methanol at extremely low temperature[J].Energy Sources,1999,21:643-648.
[36] Saeki T,Hashimoto K,Fujishima A,et al. Electrochemical reduction of CO2with high current density in a CO2-methanol medium[J].The Journal of Physical Chemistry,1995,99:8440-8446.
[37] Kim W,Seok T,Choi W. Nafion layer-enhanced photosynthetic conversion of CO2into hydrocarbons on TiO2nanoparticles[J].Energy & Environmental Science,2012,5:6066-6070.
[38] Yu J,Zhang L,Huang B,et al. Synthesis of spherical TiO2made up of high reactive facets of[J].Int. J. Electrochem. Sci.,2013,8:5810-5816.
[39] Liu S,Yu J,Jaroniec M. Anatase TiO2with dominant high-energy {001} facets:Synthesis,properties,and applications[J].Chemistry of Materials,2011,23:4085-4093.
[40] Xiong Z,Zhao X S. Nitrogen-doped titanate-anatase core–shell nanobelts with exposed {101} anatase facets and enhanced visible light photocatalytic activity[J].Journal of the American Chemical Society,2012,134:5754-5757.
[41] Xu H,Ouyang S,Li P,et al. High-active anatase TiO2nanosheets exposed with 95%{100} facets toward efficient H2evolution and CO2photoreduction[J].ACS Applied Materials & Interfaces,2013,5:1348-1354.
[42] Anpo M,Takeuchi M. The design and development of highly reactive titanium oxide photocatalysts operating under visible light irradiation[J].Journal of Catalysis,2003,216:505-516.
[43] Scanlon D O,Dunnill C W,Buckeridge J,et al. Band alignment of rutile and anatase TiO2[J].Nature Materials,2013,12:798-801.
[44] 井华,王祜英,徐金凤,等. CdSeTe NSs/TiO2NTs 的制备及其光电催化还原CO2的应用[J]. 化学学报,2013,71:421-426.
[45] Ozcan O,Yukruk F,Akkaya E,et al. Dye sensitized CO2reduction over pure and platinized TiO2[J].Topics in Catalysis,2007,44: 523-528.
[46] Cueto L F,Hirata G A,Sánchez E M. Thin-film TiO2electrode surface characterization upon CO2reduction processes[J].Journal of Sol-gel Science and Technology,2006,37:105-109.
[47] Wang C,Thompson R L,Baltrus J,et al. Visible light photoreduction of CO2using CdSe/Pt/TiO2heterostructured catalysts[J].The Journal of Physical Chemistry Letters,2009,1:48-53.
[48] Liu Q,Zhou Y,Kou J,et al. High-yield synthesis of ultralong and ultrathin Zn2GeO4nanoribbons toward improved photocatalytic reduction of CO2into renewable hydrocarbon fuel[J].Journal of the American Chemical Society,2010,132:14385-14387.
[49] Zhu X,Zhu Y,Murali S,et al. Nanostructured reduced graphene oxide/Fe2O3composite as a high-performance anode material for lithium ion batteries[J].ACS Nano,2011,5:3333-3338.
[50] Horváth D,Toth L,Guczi L. Gold nanoparticles:Effect of treatment on structure and catalytic activity of Au/Fe2O3catalyst prepared byco-precipitation[J].Catalysis Letters,2000,67:117-128.
[51] Li P Q,Wang H Y,Xu J F,et al. Reduction of CO2to low carbon alcohols on CuO FCs/Fe2O3NTs catalyst with photoelectric dual catalytic interfaces[J].Nanoscale,2013,5:11748.
[52] Yang L X,Luo S L,Li Y,et al. High efficient photocatalytic degradation of p-nitrophenol on a unique Cu2O/TiO2pn heterojunction network catalyst[J].Environmental Science & Technology,2010,44,7641-7646.
[53] Ye R,Ohta K,Baba M.In-situstudy of pn-heterojunction interface states in organic thin film transistors[J].Thin Solid Films,2014,554:137-140.
[54] Wang K,Qian X,Zhang L,et al. Inorganic-organic pn heterojunction nanotree5 arrays for high sensitive diode humidity sensor[J].ACS Applied Materials & Interfaces,2013,5,5825-5831.
[55] Robert D. Photosensitization of TiO2by MxOyand MxSynanoparticles for heterogeneous photocatalysis applications[J].Catalysis Today,2007,122:20-26.
[56] Li J T,Meng F K,Suri S,et al. Photoelectrochemical performance enhanced by a nickel oxide-hematite p-n junction photoanode[J].Chemical Communications,2012,48:8213-8215.
[57] Nolan M,Parker S C,Watson G W. CeO2catalysed conversion of CO,NO2and NO from first principles energetics[J].Physical Chemistry Chemical Physics,2006,8:216-218.
[58] Diep P,Jordan K D,Johnson J K,et al. CO2-fluorocarbon and CO2-hydrocarbon interactions from first-principles calculations[J].The Journal of Physical Chemistry A,1998,102:2231-2236.
[59] Li W X. International Workshop on Theoretical and Computational Catalysis[C]. Beijing:Tsinghua University,2009.
[60] 陈琨,范广涵,章勇. Mn掺杂ZnO光学特性的第一性原理计算[J].物理学报,2008,57(2):1054-1060.
[61] 赵宗彦,柳清菊,张瑾,等. 3d过渡金属掺杂锐钛矿相 TiO2的第一性原理研究[J]. 物理学报,2007,56(11):6592-6599.
Progress in designing CO2photocatalyst based on energy band match theory
PENG Hui1,WU Zhihong2,ZHANG Jianlin2,LU Jing1,WU Chenxiao1,LI Peiqiang1,YIN Hongzong1
(1College of Chemistry and Material Science, Shandong Agricultural University,Tai’an 271018,Shandong,China;
2Yellow River Delta Jingbo Research of Chemical Industry,Binzhou 256600,Shandong,China)
:In the process of photocatalytic reduction of CO2,visible light could be absorbed perfectly by the catalyst with a narrowed band gap,but those absorbed light could not be entirely devoted to photocatalytic reduction of CO2,as photocatalytic reduction performance is directly related to energy band location and band structure changing has an important influence on redox ability. Beginning with the CO2photocatalytic reduction basic principles,this paper is aimed to introduce the basic reduction process of CO2by semiconductor photocatalyst,the decisive role of valence band and conduction band;to briefly discuss the existing mismatch problem of valence band and conduction band in the process of photocatalytic reduction of CO2;and also to describe how to improve the CO2photocatalytic reduction efficiency using energy band match theory,such as crystal growth,composite materials,form “p-n junction” and the First Principles,which provides theoretical references for the selection and design of catalyst for the photocatalytic reduction of CO2.
carbon dioxide;photochemistry;reduction;energy band gap;semiconductor
O 613.71;O 643.36
A
1000-6613(2014)11-3007-06
10.3969/j.issn.1000-6613.2014.11.029
2014-04-15;修改稿日期:2014-07-18。
国家青年自然科学基金(21203114) 及山东省优秀中青年科学家科研奖励基金(BS2012NJ008)项目。
彭辉(1989—),女,硕士研究生,主要从事光电催化还原CO2的研究联系人:李培强,讲师。E-mail chem_carbon@ outlook.com。尹洪宗,教授。E-mail hzyin@sdau.edu.cn。
