自体CIK细胞治疗21例中晚期恶性实体瘤的肿瘤标志物变化观察
2014-05-05吕晓霞陈帼玲王学群李成芹韩晓颖
吕晓霞 陈帼玲 王学群 李成芹 韩晓颖
自体CIK细胞治疗21例中晚期恶性实体瘤的肿瘤标志物变化观察
吕晓霞 陈帼玲 王学群 李成芹 韩晓颖
目的观察自体细胞因子诱导的杀伤细胞(CIK)过继免疫疗法治疗中晚期恶性实体肿瘤的临床疗效及肿瘤标志物变化,初步对该疗法作出评价。方法取中晚期恶性实体肿瘤患者自体外周血50 ml,根据文献报道方法体外诱导扩增CIK细胞。培养约14 d后,一次性回输入患者体内,观察患者CIK细胞回输前2周及回输后4周左右外周血免疫指标变化、肿瘤标志物变化、生活质量及Karnofsky评分变化,随访1年观察1年生存率。采用t检验及寿命表法进行统计分析。结果在21例接受CIK回输治疗的患者中,治疗前出现有代表意义的肿瘤标志物异常升高的患者有14例,1次回输后有8名患者出现肿瘤标志物下降,其中1名患者降至正常范围;免疫指标在CIK细胞回输后4周较回输前2周均无有统计学意义,其中CD3由70.81﹪±10.52﹪升至71.91﹪±11.09﹪,t= 0.762,P= 0.455;CD4由39.06﹪±11.03﹪升至39.21﹪±8.74﹪,t= 0.093,P= 0.927;CD8由28.75﹪±8.22﹪升至29.88﹪±10.13﹪,t= 0.895,P= 0.382;CD16+CD56+(即NK细胞)由15.73﹪±9.52﹪升至15.37﹪±6.66﹪,t= -0.173,P= 0.865;EORTC QLQ-C30(vertion3.0)评分中总体健康状况(global health)由(41.67±17.28)分上升至(46.43±17.19)分,P= 0.076;以上各指标治疗前后差异均无统计学意义。但功能子量表中的躯体功能(physical functioning)单项[由(62.94±17.48)分上升至(66.67±17.37)分,P= 0.012]和症状子量表中的疲倦(fatigue)[由(51.33±20.03)分下降至(43.38±16.81)分,P= 0.012]、疼痛(pain)[由44.44﹪±19.24﹪下降至(36.51±14.55)分,P= 0.038]及食欲丧失(appetite loss)[由(52.38±19.92)分下降至(38.09±21.82)分,P= 0.016]单项差异均有统计学意义(P< 0.05);卡氏评分由[(61.42±3.59)分上升至(62.38±4.36)分,t= 1.000,P> 0.05];随访1年内有3名患者死亡,生存率约85.7﹪。结论自体CIK细胞回输治疗后肿瘤标志物有明显改变,同时对缓解晚期恶性实体瘤患者的临床症状、提高其生活质量有帮助。其治疗仍有待规范和改进,远期疗效仍待观察。
肿瘤;杀伤细胞;免疫治疗
基于对肿瘤免疫学的认识,生物治疗已逐渐成为了恶性肿瘤的第四种治疗手段[1-3]。该治疗的核心在于生物反应调节剂的作用与化疗药物不同,属0级动力学,即一定的免疫效应细胞或抗体可以消灭一定数量的细胞[4]。这种治疗的主要目的是通过调控肿瘤细胞或宿主免疫反应使肿瘤宿主自身免疫系统能够识别并清除肿瘤细胞,其特点是毒副作用相对较小,临床应用适应症广泛。
目前,在动物实验及体外实验的研究基础上,国内外多家医疗机构逐渐将细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)的研究成果应用到临床实践中,取得了较为乐观的治疗效果,作为手术、放疗和化疗的辅助治疗手段加以应用,目的为改善患者免疫功能、调节肿瘤微环境及消除微小残留。山东省立医院肿瘤科在2008年4月至12月期间曾对21名晚期恶性实体瘤患者进行自体CIK细胞过继免疫治疗,本文即以这些临床资料为依据进一步探索及评估自体CIK细胞回输疗法在晚期恶性实体肿瘤姑息治疗中的临床应用价值。
材料与方法
一、CIK细胞制备
1.体外诱导培养:抽取患者50 ml肝素抗凝的外周静脉血,用淋巴细胞分离液( fi collhypaque)密度梯度离心,分离出外周血单个核细胞(peripheral blood mononuclear cell,PBMC)悬于无血清培养基中置37℃、5﹪CO2培养箱内培养。加入重组白介素-2和抗CD3单克隆抗体培养,观察细胞生长情况,培养2周左右回收细胞。
2.CIK细胞的鉴定与质量控制:用台盼蓝拒染法进行活细胞百分比计数,分别进行细菌、真菌、支原体、内毒素检测,细胞表型分析。
3.CIK细胞回输:正常状态下培养约14~16 d细胞状态良好、质控合格且数量达1010收集CIK细胞一次性静脉回输到患者体内。
二、临床资料
患者山东省立医院肿瘤科自2008年4月至12月接受自体CIK回输治疗的恶性实体瘤患者,共21例,男性患者12例,女性9例,年龄41~83岁,中位年龄(60.0±10.6)岁;21例患者均经影像学及病理学检查确诊为恶性肿瘤,根据国际抗癌联盟(UICC)分期标准进行临床分期后均属Ⅲ-Ⅳ期;胃癌4例,结直肠癌3例,食管癌2例,胰腺癌1例,非小细胞肺癌2例,前列腺癌1例,胆管癌1例,乳腺癌4例,卵巢癌3例;所有患者接受CIK细胞回输治疗前至少1周停止放、化疗。
病例入选标准:(1)KPS评分≥60分,预期生存期大于3个月;(2)重要器官功能基本正常,血胆红素< 68 μmol/L,天冬氨酸氨基转移酶< 90 U/L,肌酐< 353 μmol/L;(3)无生物制品过敏史;(4)无严重的细菌或病毒感染;(5)非妊娠及哺乳期患者;(6)患者或其委托人对该治疗理解配合并签署治疗知情同意书。
三、疗效评估
1.免疫指标:分别于抽取50 ml外周血当日及第1周期CIK细胞回输后(28±3)d检测细胞免疫和体液免疫指标,前者包括CD3+、CD4+、CD8+T细胞的比例,CD4/CD8的值,CD16+CD56+细胞(即NK细胞)的比例,后者包括IgG、IgA、IgM、C3和C4的绝对值。
2.肿瘤标志物:分别化验抽血当日及第1周期回输后(28±3)d的外周血肿瘤标志物浓度,重点观测各种肿瘤最有临床意义的一种标志物,其中胃癌选择CA724,结直肠癌选择CEA,食管癌选择CEA,胰腺癌选择CA199,胆管癌选择CA199,非小细胞肺癌选择CEA,乳腺癌选择CA153,卵巢癌选择CA125,前列腺癌选择PSA[3](采用罗氏Cobas e601电化学免疫发光仪及其配套试剂、标准品、质控品检测)。
3.安全性:对比回输前2周和第1周期回输后1个月左右的肝肾功能及血常规检验结果,及时记录回输后患者出现的不能排除与CIK细胞治疗有相关性的不良反应。
4.生存质量判断:比较回输前后卡氏评分的改变;利用EORTC QLQ-C30(vertion3.0)问卷量化患者生活质量状况,治疗前2周及治疗后4周分别进行调查,不能当面采访者采用电话访问的形式,量表的具体计分方法见附录。
5.生存状况:随访1年,计算生存率(survival rate),作出生存率曲线(图1)。
四、统计学分析方法
应用SPSS16.0软件进行统计,年龄、血细胞计数、肝肾功能指标、免疫指标、肿瘤标志物、KPS评分、生活质量评分均以表示,CIK细胞回输治疗前后血细胞计数、肝肾功能指标、免疫指标、KPS评分、生活质量评分的变化采用配对t检验法,以P< 0.05为差异有统计学意义。
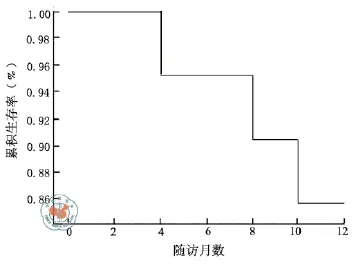
图1 21例恶性实体瘤患者进行CIK细胞回输后随访1年的生存曲线
结 果
一、免疫指标
采血当日取2 ml血样送至山东省立医院检验科行细胞免疫及体液免疫指标检测,首次CIK细胞回输约4周时再由我院检验科行免疫指标检测。结果显示:CD3、CD4及CD8比例均有所上升,但均无统计学意义(P> 0.05),CD4/CD8比值略有下降,无统计学意义(P> 0.05),CD16CD56比例下降,无统计学意义(P> 0.05),IgG、IgA、IgM、C3及C4在治疗前后的差异均无统计学意义(P> 0.05)(见表1)。
表1 21例恶性实体瘤患者CIK细胞回输前后外周血免疫指标改变(± s,n= 21)
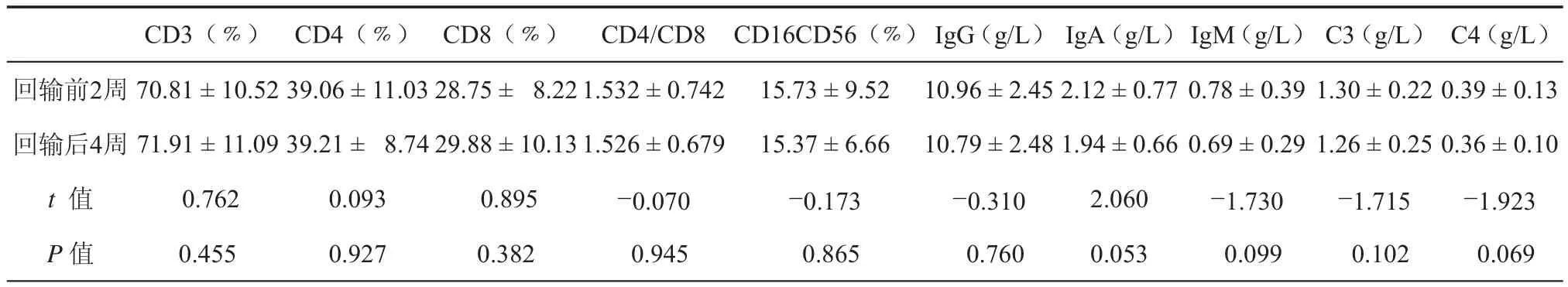
表1 21例恶性实体瘤患者CIK细胞回输前后外周血免疫指标改变(± s,n= 21)
CD3(﹪) CD4(﹪) CD8(﹪) CD4/CD8 CD16CD56(﹪)IgG(g/L)IgA(g/L)IgM(g/L)C3(g/L) C4(g/L)回输前2周70.81±10.52 39.06±11.03 28.75 ± 8.221.532±0.742 15.73±9.52 10.96±2.45 2.12±0.77 0.78±0.39 1.30±0.22 0.39±0.13回输后4周71.91±11.09 39.21 ± 8.74 29.88±10.131.526±0.679 15.37±6.66 10.79±2.48 1.94±0.66 0.69±0.29 1.26±0.25 0.36±0.10t值 0.762 0.093 0.895 -0.070 -0.173 -0.310 2.060 -1.730 -1.715 -1.923P值 0.455 0.927 0.382 0.945 0.865 0.760 0.053 0.099 0.102 0.069
二、肿瘤标志物的改变
CIK细胞回输治疗前2周检测外周血肿瘤标志物有14名患者出现异常升高,回输后4周复查,该14名患者中有8名出现肿瘤标志物下降,下降比例为57.14﹪,其中1名前列腺癌患者血清PSA降至正常范围,另外6名患者虽有指标升高,但数值未翻倍;治疗前肿瘤标志物正常者中有3名患者在回输后出现肿瘤标志物上升,但数值均未超出正常范围。(表2)
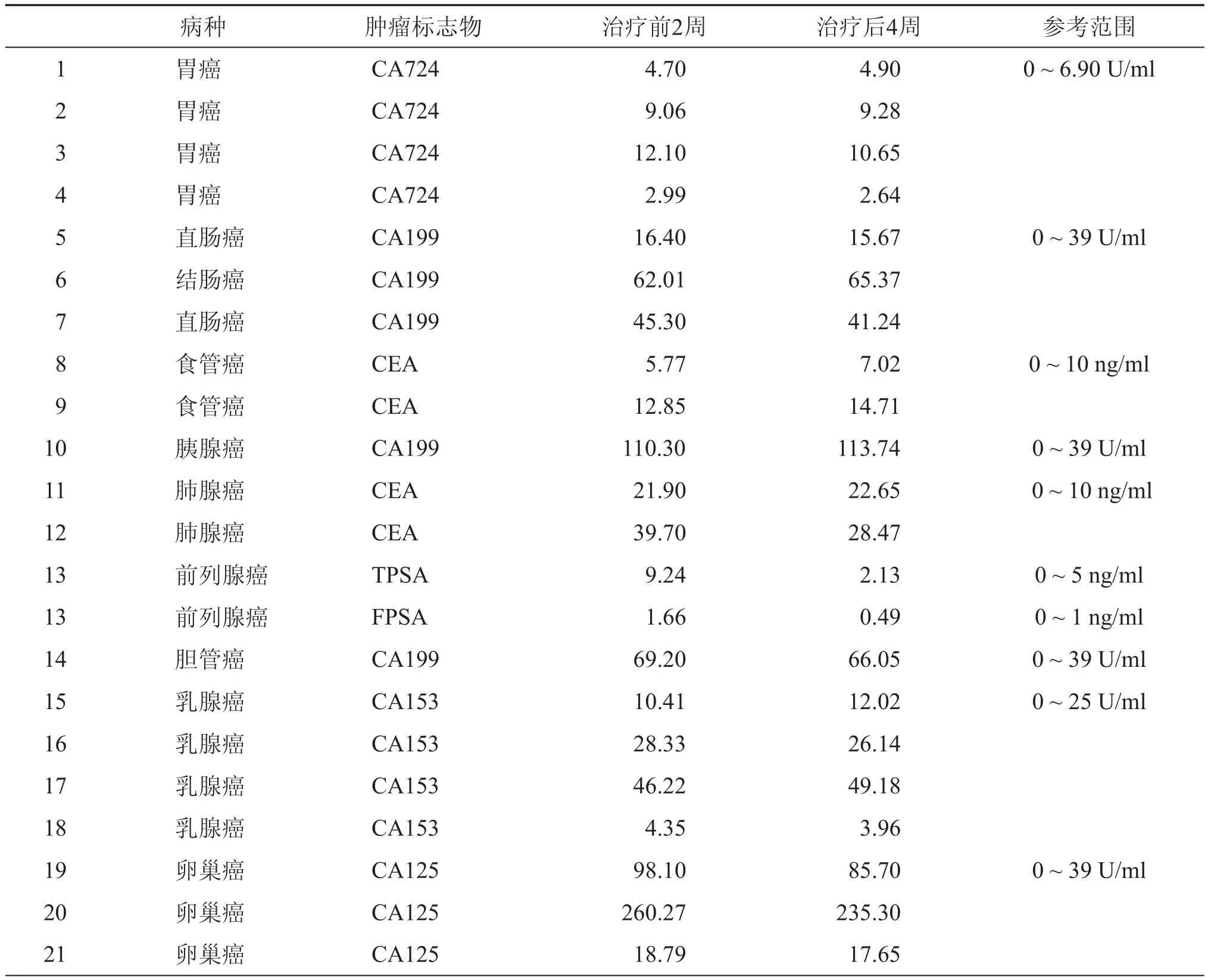
表2 21例恶性实体瘤患者CIK细胞回输前后血清肿瘤标志物变化
三、不良反应
21例患者共进行33周期CIK细胞回输,其中2名患者行3周期治疗,8名患者行2周期治疗,其余患者均行1周期治疗。所有患者回输过程中均未诉明显不适,2名患者在首次回输后24 h内出现一过性的低热(< 38.0℃),其余患者未出现体温异常。肝肾功能、血常规检查结果在CIK细胞回输前后未出现显著性变化(P> 0.05,表3)。
四、生活质量
有18名患者独立完成了治疗前后的问卷调查,3名患者由熟悉情况的委托人代为填写量表。最终结果显示:总体健康状况(global health)一项未出现有统计学意义的改变(P> 0.05),但功能子量表中的躯体功能(physical functioning)单项和症状子量表中的疲倦(fatigue)、疼痛(pain)及食欲丧失(appetite loss)单项均出现了有统计学意义的改变(P< 0.05,提示了躯体功能的改善和疲倦、疼痛及食欲的改善,经济困难一项的得分显示有恶化趋势,但无统计学意义(P> 0.05),其余各单项得分虽显示改善趋势,但差异均无统计学意义(P> 0.05);卡氏评分由61.42±3.59升高至62.38±4.36,差异无统计学意义(t= 1.000,P> 0.05,表4)。
五、生存情况
随访1年,失访率为0,至随访期结束时,有3名患者死亡,1年生存率为85.7﹪,生存率曲线见图1。
讨 论
生物治疗是建立在现代分子生物学、细胞生物学和分子免疫学等学科发展基础之上的肿瘤治疗新方法。它利用机体对肿瘤的免疫应答,通过生物手段改变肿瘤和机体之间的相互作用,调动机体对肿瘤的防御机制,达到控制肿瘤生长、延长患者生存期、提高患者生活质量的目的。Mitchell等[8]提出了生物反应调节剂(biological response modi fi ers,BRM)的概念:(1)直接增强宿主抗肿瘤反应,如细胞因子等;(2)或减少抑制性机制间接增强宿主抗肿瘤反应;(3)增强宿主对细胞毒性物质的耐受能力;(4)改变肿瘤细胞膜结构增强其免疫原性,或使肿瘤细胞对自身免疫或抗肿瘤药物更敏感;(5)预防或逆转细胞转化。随着该理念的提出,肿瘤生物治疗包涵的内容更为广泛,手段更为多样,已成为继手术、放疗、化疗之后的第四种肿瘤治疗模式,受到越来越多的重视。
表3 21例恶性实体瘤患者CIK细胞回输前后肝肾功能及血常规变化(± s,n= 21)
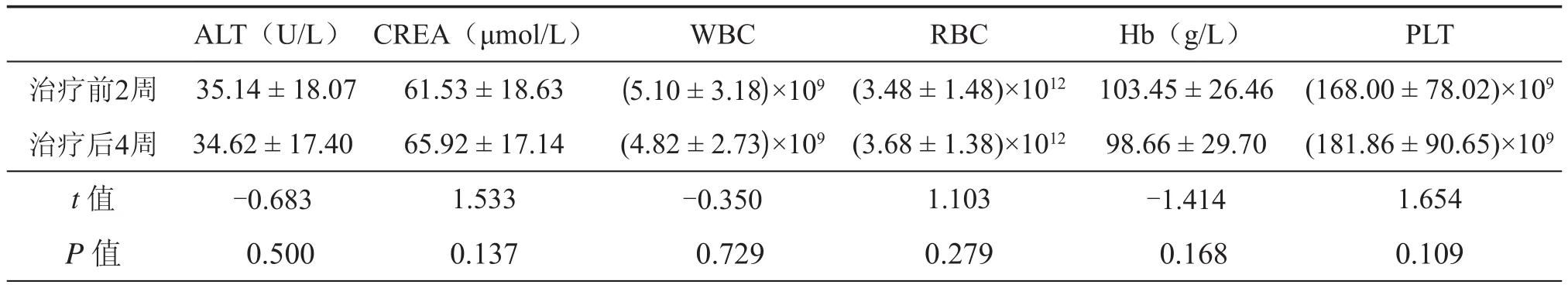
表3 21例恶性实体瘤患者CIK细胞回输前后肝肾功能及血常规变化(± s,n= 21)
ALT(U/L) CREA(μmol/L) WBC RBC Hb(g/L) PLT治疗前2周 35.14±18.07 61.53±18.63 (5.10±3.18)×109(3.48±1.48)×1012 103.45±26.46 (168.00±78.02)×109治疗后4周 34.62±17.40 65.92±17.14 (4.82±2.73)×109(3.68±1.38)×1012 98.66±29.70 (181.86±90.65)×109t值 -0.683 1.533 -0.350 1.103 -1.414 1.654P值 0.500 0.137 0.729 0.279 0.168 0.109
表4 21例恶性实体瘤患者CIK细胞回输前后QLQ-C30(version3.0)得分(标准分)情况(± s,n= 21)
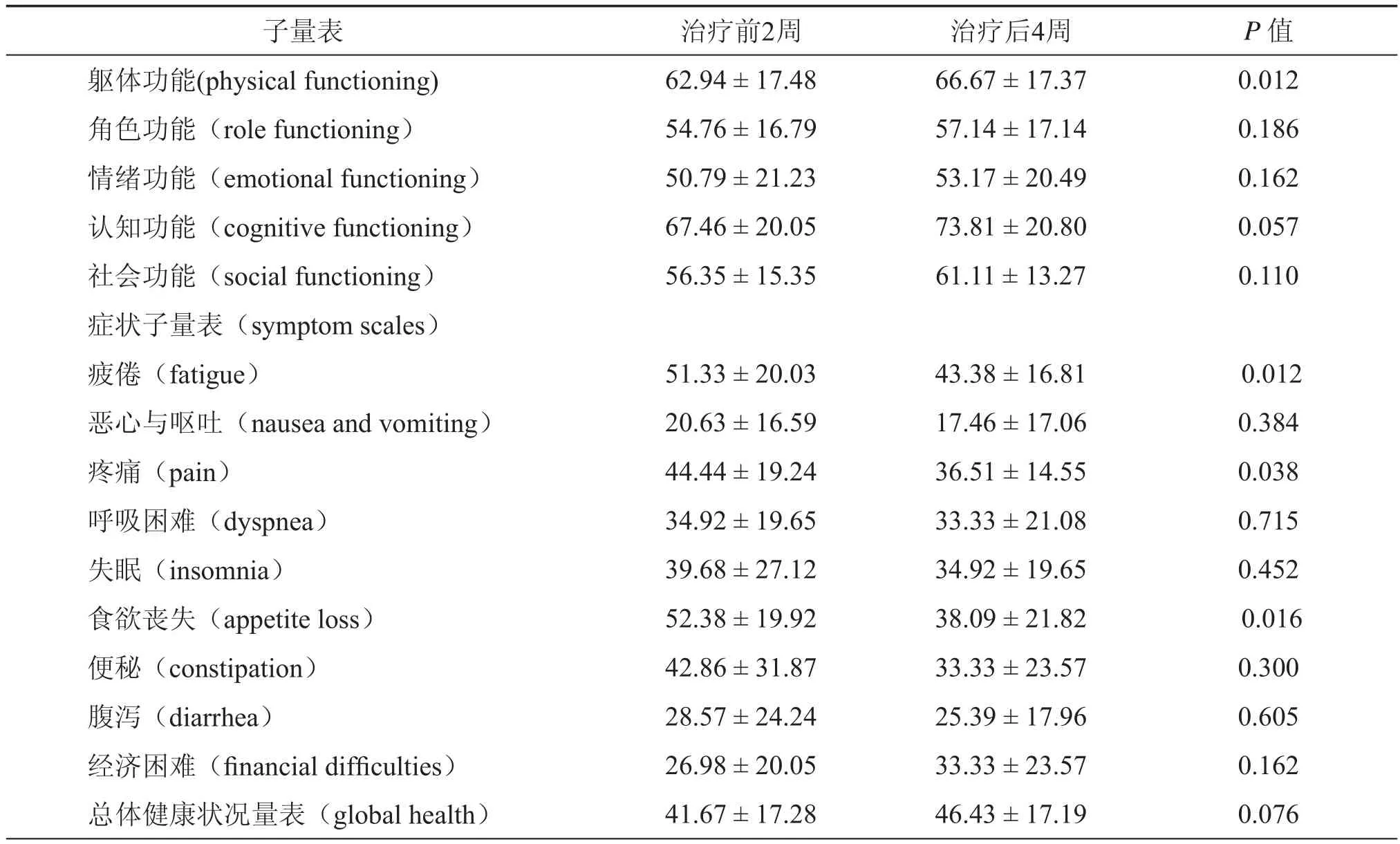
表4 21例恶性实体瘤患者CIK细胞回输前后QLQ-C30(version3.0)得分(标准分)情况(± s,n= 21)
子量表 治疗前2周 治疗后4周 P值躯体功能(physical functioning) 62.94±17.48 66.67±17.37 0.012角色功能(role functioning) 54.76±16.79 57.14±17.14 0.186情绪功能(emotional functioning) 50.79±21.23 53.17±20.49 0.162认知功能(cognitive functioning) 67.46±20.05 73.81±20.80 0.057社会功能(social functioning) 56.35±15.35 61.11±13.27 0.110症状子量表(symptom scales)疲倦(fatigue) 51.33±20.03 43.38±16.81 0.012恶心与呕吐(nausea and vomiting) 20.63±16.59 17.46±17.06 0.384疼痛(pain) 44.44±19.24 36.51±14.55 0.038呼吸困难(dyspnea) 34.92±19.65 33.33±21.08 0.715失眠(insomnia) 39.68±27.12 34.92±19.65 0.452食欲丧失(appetite loss) 52.38±19.92 38.09±21.82 0.016便秘(constipation) 42.86±31.87 33.33±23.57 0.300腹泻(diarrhea) 28.57±24.24 25.39±17.96 0.605经济困难( fi nancial dif fi culties) 26.98±20.05 33.33±23.57 0.162总体健康状况量表(global health) 41.67±17.28 46.43±17.19 0.076
抗肿瘤细胞的免疫效应细胞属于生物反应调节剂的一类,主要包括淋巴因子激活的杀伤细胞(lymphokine activated killer,LAK)、肿瘤浸润淋巴细胞(tumor-in fi ltrating lymphocyte,TIL)、CIK细胞和树突状细胞(dentritic cells,DC)等,其中LAK细胞、TIL细胞及CIK细胞主要通过过继免疫治疗(adoptive cellular immunotherapy,ACI)的方式发挥抗肿瘤作用,即取对肿瘤有免疫力的供者淋巴细胞转输给肿瘤患者,或取患者自身的免疫细胞在体外活化、增殖后,再回输入患者体内,使其在患者体内发挥抗肿瘤作用。CIK细胞是经IFN-γ、IL-2、抗CD3单克隆抗体及IL-1等共培养后得到的具有强大肿瘤杀伤活性的异质性淋巴细胞群[5]。CD3+CD56+细胞是CIK细胞中的主要效应细胞,具有非MHC限制性杀伤肿瘤的能力,与之前的LAK细胞、TIL细胞和CD3AK细胞相比细胞毒性更强、体外增殖能力更高。
有研究表明,肿瘤患者来源的CIK细胞与健康人来源者相比,扩增能力不敌后者,但杀伤能力不亚于后者[9],且自体血不易发生交叉感染或免疫排斥反应,相较脐血、骨髓等来源获取更简便,另外,CIK细胞为非肿瘤组织来源,不会引起肿瘤播散。本课题在进行过程中,发现并非所有患者的CIK细胞在培养2周时都能达到1010数量级,这在一定程度上说明了肿瘤患者确实存在免疫抑制。本课题应用的外源性细胞因子组合只保留了IL-2、抗CD3单克隆抗体及IFN-γ三种核心成分而未使用IL-1,培养结果证明CIK细胞扩增能力未受明显影响。其中IL-2为基础,抗CD3单克隆抗体主要起到丝裂原的作用,而IFN-γ提前24 h加入对提升细胞毒性起关键作用且能够降低IL-2用量,但对增殖不起作用,若与IL-2同时或在IL-2之后加入则降低CIK细胞毒力,这是因为先加入IFN-γ可促使PBMC上IL-2受体数量增加,从而有效地激活效应细胞。在培养基选取方面,本实验未采用经典的1640完全培养基,而是采用KBM-551无血清培养基。蒋永新等[10]研究发现,无血清培养基培养的CIK细胞增殖高峰较晚(14~17 d),增殖倍数高,在细胞表型、不同的效靶比时对肿瘤细胞的生长抑制与诱导凋亡方面,与完全培养基无显著差别,可完全取代完全培养基。
在近期疗效方面,治疗后1个月与治疗前2周相比,在原本有肿瘤标志物异常的患者中57.14﹪的患者出现了肿瘤标志物的下降且有1名前列腺癌患者血清PSA在1周期治疗后即降至正常。这一结果一方面说明CIK细胞具有杀伤肿瘤细胞的作用,另一方面反映了它的杀瘤谱广,对多种实体肿瘤均有抑制。
CIK细胞杀伤靶细胞的机制尚未完全阐明:(1)在靶细胞识别阶段,Schmidt-Wolf等[11]的研究发现抗LFA-1或抗ICAM-1的单克隆抗体可以阻断CIK细胞的细胞毒活性,由此推断IFA-1/ ICAM-1分子在此过程中的重要地位,刘苗等[12]进一步对IFA-1/ICAM-1黏附后的下游效应机制进行了基因层面的探讨,证实GATA-3和T-bet基因参与了该信号介导的杀瘤途径。使用主要组织相容性复合体(MHC)Ⅰ类和Ⅱ类抗体不能阻滞CIK细胞对靶细胞的杀伤作用,表明CIK细胞对肿瘤细胞的杀伤具有非MHC限制性[13],因而CIK细胞对多种不同组织来源的肿瘤细胞均有杀伤作用。NKG2D亦是CIK细胞识别靶细胞的重要受体。有研究表明,CD8+T细胞在高水平IL-2刺激下高表达NKG2D,可识别肿瘤细胞表面的MHC-Ⅰ类分子MICA、MICB等,并通过NKG2D/DAP10D信号途径激活杀伤细胞,但NKG2D在CIK细胞不同亚群中发挥的作用不尽相同,具体机制仍待进一步阐明[14]。
在杀伤阶段:CIK细胞受到外源性抗CD3单克隆抗体或敏感靶细胞刺激时会释放具有细胞毒性的胞浆颗粒至细胞外,其中CD3+CD56+T细胞颗粒释放量最大。Mehta等[15]认为CIK通过两条途径释放胞浆内容物发挥细胞外毒性作用:第一条途径与胞浆内环磷酸腺苷(cAMP)浓度无关,CIK细胞膜表面的CD11a分子为LFA-1α整合素链,与CD18形成完整的LFA-1,通过与配体ICAM-1的结合介导CIK对肿瘤细胞的识别、激活并释放含有α-氮-甲苯碳酰基-左旋-赖氨酸硫甲苯酯(BLT)的胞浆毒性颗粒攻击靶细胞;第二条途径与胞浆内cAMP的浓度有关,由CIK细胞表面的CD3样受体介导,与第一种途径一样最后也是通过胞浆毒性颗粒依赖性的溶细胞作用发挥杀瘤作用。该项研究还认为,虽然用双丁酸环磷腺苷(db-cAMP)几乎可以完全抑制CIK细胞释放含有BLT酯的颗粒,但是却不能完全抑制CIK细胞对于靶细胞的杀伤活性,提示CIK还有其他杀伤途径。
一些学者认为,CIK的细胞毒性作用还与穿孔蛋白(PFP)的形成[16]、炎性因子的释放[17]以及细胞凋亡密切相关。许多研究者发现CIK细胞在体外培养过程中表达凋亡配体FasL,FasL的表达不仅可以诱导Fas+的肿瘤细胞凋亡而且可以抵抗FasL+的肿瘤细胞诱导的凋亡作用[18]。另外,已知bcr-abl融合基因可能是一种抗凋亡基因,而CIK细胞能诱导bcr-abl表达阳性的K562细胞凋亡,说明CIK细胞能克服bcr-abl的抗肿瘤凋亡作用[19]。任欢等[20]通过对S180荷瘤鼠的研究发现CIK细胞的体内抗肿瘤作用可能与其促进荷瘤宿主体内T细胞增殖活化有关。岳欣[21]的研究表明肿瘤患者的外周血单个核细胞经诱导生成CIK细胞后,具有免疫抑制功能的细胞因子IL-10分泌减少,IFN-γ产生增多,推测这可能有助于接受回输治疗患者的免疫平衡由Th2向Th1漂移。然而,近来的研究发现IL-10在某些情况下能抑制肿瘤发展,例如体外实验发现应用IL-10后肿瘤细胞对NK细胞介导的杀伤作用更易感,经IL-10基因转染后的肿瘤细胞扩增能力减弱,免疫原性增强[22],因此就这一问题还需进一步深入的研究。本实验同种肿瘤收集的样本数过少,需进一步统计以比较各种特征性肿瘤标志物在治疗前后的变化,以便了解不同病种对CIK细胞治疗的反应程度。
以往研究证明,恶性肿瘤患者的免疫抑制与辅助性T细胞(CD4+)减少、抑制性T细胞(CD8+)增多有关,病情进展期有可能会出现CD4/CD8比值的倒置[23]。本实验所得资料显示多数患者治疗前的CD3及CD4比例在正常范围偏低的水平,然而有研究认为恶性肿瘤患者不能仅凭CD3、CD4细胞的比例来判断免疫状态,而应结合绝对值的检测,有些患者尽管比例正常但T细胞的绝对值是下降的,CD8+T细胞比例上升有可能只是CD4+比例减少的相应结果。多数研究发现CIK细胞治疗后可改善患者的免疫抑制,表现之一即为CD4比例显著上升,CD8比例显著下降,CD4/CD8比值恢复正常。本实验结果显示患者1周期CIK细胞回输治疗后4周CD3和CD4比例均较治疗前有上升趋势,但差异无统计学意义,CD8+T细胞的变化亦无统计学意义。考虑出现这种结果原因有如下几点:(1)CD28为CD8+T细胞上主要的共刺激分子,通过与B7结合提供CD8+T细胞活化的第二信号,并对T细胞的存活起维持和调节作用,通过一系列机制在机体精密调控的免疫应答网络中起调节枢纽作用,根据CD28表达与否可分为两个亚群,CD8+CD28+属细胞毒性T细胞(CTL),既能借助穿孔素、颗粒酶等细胞毒性物质的分泌溶解瘤细胞又可能分泌特定细胞因子来诱导瘤细胞凋亡,而CD8+CD28-T细胞由于缺乏共刺激信号、对丝裂原的刺激不敏感而被称为抑制性T细胞(Ts细胞),前阶段的研究并未将CD8+细胞进一步分类研究,CIK细胞治疗后的CD8比例升高有可能来源于细胞毒性T细胞的比例上升,已有研究证明许多恶性实体瘤患者外周血中,CTL比例较正常对照组显著降低,而Ts比例显著上升[24-25];(2)Chen等[25]通过研究认为胃肠道肿瘤患者的免疫抑制与肿瘤细胞自身产生的免疫抑制因子有关,免疫抑制因子可诱导Ts细胞的产生,同时阻止CD4+辅助性T细胞的形成和成熟,而CIK细胞具有强大的杀瘤活性,回输治疗后肿瘤细胞分泌的抑制因子减少,上述抑制作用可在一定程度上被削弱,因此治疗后CD8+T细胞的比例亦有可能因为Ts的降低而降低;(3)CD4+CD25+T细胞是一类具有免疫抑制作用、在介导机体肿瘤免疫耐受中起重要作用的淋巴细胞,具有免疫无能性和免疫抑制性两大特点,前者表现为既不对IL-2、抗CD3单克隆抗体等作出免疫应答,也不分泌IL-2等具有正性免疫调节作用的细胞因子,后者表现在其激活必须经过T细胞受体和共刺激信号的刺激,一旦被激活则表现出非特异性的抑制活性,能够同时抑制CD4+和CD8+T细胞的增殖和活化[25],而肿瘤微环境中CD4+CD25+T细胞的数量明显增多,有研究表明通过一定的手段去除CD4+CD25+T细胞可增强CIK细胞的治疗效果[26],因此CD3及CD4比例未出现理论上的显著升高可能与该调节性细胞的存在有关;(4)本实验样本数较小,不利于反映真实的规律;(5)由于实现患者定期随访有困难,本实验只是检测了CIK细胞回输治疗后4周的T细胞亚群改变,如果能多设定若干个观察点,可能会得到不一样的结论,有可能在4周之前已经出现过CD3和CD4的峰值,亦有可能高峰尚未出现。
本实验结果显示CIK细胞治疗后CD16+CD56+细胞(NK细胞)百分比未出现显著性变化,与刘继斌等的实验结果不符,但由于本实验样本数小且只观察了回输后4周这一个时间点,因此尚不能肯定CIK细胞回输对NK细胞无影响。事实上,CIK细胞培养过程涉及了较高浓度的IL-2,临床回输后又连续应用了5 d IL-2,而IL-2恰好可以增强骨髓祖细胞向NK细胞分化并延迟NK细胞的凋亡[27],因此理论上是有可能出现CIK细胞回输后NK细胞比例增多的。目前已知NK细胞的功能[28]包括:(1)对病毒感染细胞及恶性肿瘤细胞产生直接细胞毒作用;(2)通过分泌IFN-γ等多种免疫调节因子间接发挥细胞毒作用;(3)通过其细胞膜CD16(FcγRⅢ)与抗体Fc段的结合从而介导抗体依赖的细胞毒作用(ADCC)。有别于T、B淋巴细胞的是,NK细胞发挥作用时不发生编码抗原识别受体基因的重组,而主要借助表面一系列受体识别MHC-Ⅰ类或非MHC-Ⅰ类分子。
生活质量是评价肿瘤治疗方法的重要指标。本实验采用了欧洲癌症研究与治疗组织(EORTC)开发的生活质量量表QLQ-C30第3版的中文版,同时配合使用卡氏评分方法。QLQ-C30是专为癌症患者设计的调查问卷,内容全面且具有功能指向性,措辞通俗易懂且通篇未出现“肿瘤”等敏感字样,已经过了多国的临床验证,具有较好的信度、效度和敏感度,患者的依从性也较高。本研究结果发现,尽管总体健康状况及卡氏评分未出现有统计学意义的改善,但自体CIK细胞回输治疗后4周,乏力、食欲减退、疼痛等临床症状出现了有统计学差异的缓解,且大部分患者是在回输后的2~3 d即开始出现症状好转,同时出现了躯体功能的改善,提示该疗法确实提高了患者的生活质量。考虑症状及生活质量改善的机制可能有:(1)CIK细胞短期内发挥了积极的抗肿瘤作用,使原发病得到暂时的控制,从而相应的改善了患者症状;(2)李荣等[29]的研究表明,肿瘤患者的抑郁水平与NK、CD4呈负相关,CD8则呈正相关,而CIK细胞过继免疫治疗可以提高NK、CD4细胞水平,且本研究发现NK、CD4变化幅度大的患者治疗效果更好;(3)IL-2具有一定的镇痛作用[30],而CIK细胞培养过程及回输时也应用了IL-2,本身也可在体内产生IL-2,因此能够一定程度上改善患者的疼痛。但是,多数患者自诉症状缓解最明显期为回输后2~5 d,之后症状改善速度减缓,甚至有少数患者在回输后10 d症状再度恶化到治疗前水平。CIK细胞改善临床症状的作用可持续性较差的原因考虑有如下几点:(1)CIK细胞的诱导产生与扩增需要大量外源性细胞因子的作用,而体内环境不能满足这一条件;(2)根据Schreiber和Dunn提出的肿瘤免疫编辑学说(cancer immunoediting)[31],肿瘤细胞也可以反过来编辑免疫细胞,例如,NK细胞在与鼻咽癌、结肠癌等肿瘤细胞长期接触后,NK细胞表面的NKG2D受体表达会下调,细胞毒活性继而下降,因此有理由怀疑CIK细胞进入机体复杂的免疫环境后,会受到肿瘤细胞的免疫编辑而降低了杀瘤能力,这也许可以解释为何CIK细胞不能如同在体外培养环境中一般继续长期分泌自身扩增所需要的IL-2等细胞因子;(3)肿瘤患者体内的CD4+CD25+T细胞可能通过与CIK细胞的直接接触或下调CIK细胞上IL-2R的表达来发挥抑制作用[32]。这一结果提示单纯CIK细胞的回输治疗需要进行多个周期以延长症状缓解期。值得一提的是,21名入组患者中有1名老年晚期前列腺癌患者共接受了9次回输,后续随访发现该患者获得了6年的总生存期(OS)。大多数入组病例未能获得显著OS受益可能与回输总数较少有关。另外,研究者们也可以寻求一定的手段去除抑制CIK细胞的因素。如今比较热点的研究集中在抑制CD4+CD25+T细胞上,有人试图应用抗CD25单克隆抗体来阻断其作用,但因为同时阻断了具有抗肿瘤作用的CD8+CD25+T细胞而受到了限制,现在直接针对CTLA-4信号途径的抗CTLA-4单克隆抗体已经入了临床试验阶段,但是真正将这些研究成果应用于临床还是面临很大困难的,主要是因为CD4+CD25+T细胞与其他T细胞之间表面分子的区别尚未完全明确,精确的去除或抑制该群细胞难以做到,而且去除调节性T细胞后有可能诱发自身免疫性疾病;有学者发现注射小剂量的环磷酰胺可通过抑制增殖和诱导凋亡来减少机体中CD4+CD25+T细胞的数量,但这种抑制作用具有时间依赖性,连续应用环磷酰胺一段时间后抑制作用会消失[33],德国学者发现应用含氟达拉滨的化疗方案治疗后,调节性T细胞抑制功能和数量均有下降[34]。
目前的研究倾向于认为细胞免疫在肿瘤免疫中发挥主导作用,而体液免疫似乎处于较为次要的地位。事实上,目前对于B细胞在肿瘤免疫监视和抗肿瘤过程中的角色知之甚少。目前的研究很少能从肿瘤患者体内检测到抗肿瘤抗体,即使有时发现反应性抗体,也通常不是保护性抗体,有实验表明把小鼠肿瘤细胞分离出后再自体回输,可检测到高效价的IgG抗体[22]。本实验中各体液免疫指标在CIK回输前后并无显著性差异,一方面可能说明由于自体CIK细胞为正常T淋巴细胞来源因此不诱导机体产生体液免疫应答,另一方面说明体液免疫可能不参与CIK细胞抗肿瘤作用的发挥,不过由于本实验样本数小,说服力并不强。目前较为明确的是,由于CIK细胞表面不表达CD16,故不可能借助ADCC作用发挥杀瘤活性。
CIK细胞是目前同类细胞中应用最广泛、最为人们所看好的一类肿瘤免疫细胞。但CIK细胞一方面受到体内免疫抑制性细胞的负性影响,一方面又可能受到肿瘤源性的抑制作用,加之肿瘤终末期患者本身免疫状态紊乱,部分患者存在外周血白细胞数量低下,扩增倍数及细胞质量都可能受到影响。
关于CIK细胞过继免疫治疗,还需进行如下几个方面的探索:(1)与手术、放化疗及靶向治疗等现有治疗手段的关系,应如何配合,如何选取治疗时机;(2)建立治疗规范,标准化与个体化相统一;(3)对于肿瘤恶液质患者如何尽可能以少量的自体外周血扩增出足量的CIK细胞,其他来源CIK细胞应用的可行性如何;(4)CIK细胞生物学基础理论的进一步研究;(5)新技术的应用,如调节性T细胞去除或抑制的可行途径,利用基因工程改良CIK细胞等。
1 Dougan M,Dranoff G.Immune therapy for cancer[J].Annu Rev Immunol,2009,27:83-117.
2 Hontscha C,Borck Y,Zhou H,et al.Schmidt-Wolf IG.Clinical trials on CIK cells: fi rst report of the international registry on CIK cells (IRCC)[J].J Cancer Res Clin Oncol,2011,137(2):305-310.
3 Schwaab T,Schwarzer A,Wolf B,et al.Clinical and immunologic effects of intranodal autologous tumor lysatedendritic cell vaccine with Aldesleukin (Interleukin 2) and IFN-{alpha}2a therapy in metastatic renal cell carcinoma patients[J].ClinCancer Res,2009,15(15):4986-4992.
4 孙燕,石远凯.临床肿瘤内科手册[M].北京:人民卫生出版社,2007∶23.
5 Schmidt-Wolf IG,Negrin RS,Kiem HP,et al.Use of a SCID mouse/human lymphoma model to evaluate cytokineinduced killer cells with potent antitumor cell activity[J].J Exp Med,1991,174(1):139-149.
6 Rosenberg SA,Spiess P,Lafreniere R.A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes[J].Science,1986,233(4770):1318-1321.
7 王鸿利.实验诊断学[M].北京:人民卫生出版社,2001:245-246.
8 Mitchell MS.Combining chemotherapy with biological response modifiers in treatment of cancer[J].J Natl Inst,1988,80(18):1445-1450.
9 Scheffold C,Brandt K,Johnston V,et al.Potential of autologous immunologic effector cells for bone marrow purging in patients with chronic myeloid leukemia[J].Bone Marrow Transplant,1995,15(1):33-39.
10 蒋永新,李高峰,王熙才,等.无血清培养基与完全培养基体外诱导扩增CIK细胞分泌细胞因子水平的比较[J].肿瘤防治研究,2006,33(11):784-787.
11 Schmidt-Wolf IG,Lefterova P,Mehta BA,et al.Phenotypic characterization and I-dentification of effector cells involved in tumor cell recognition of cytokine-induced killer cells[J].Exp Hematol,1993,21(13)∶1673-1679.
12 刘苗,吴小艳,金润铭.细胞因子诱导的杀伤细胞生物活性及杀瘤机制[J].实用儿科临床杂志,2009,24(15):1163-1166.
13 Hoyle C,Bangs CD,Chang P,et al.Expansion of philadelphia chromosome-negative CD3+CD56+cytotoxic cells from chronic myeloid leukemia patients: in vitro and in vivo efficacy in severe combined immunodeficiency disease mice[J].Blood,1998,92(9): 3318-3327.
14 Walsh KB,Lanier LL,Lane TE.NKG2D receptor signaling enhances cytolytic activity by virus-speci fi c CD8+T cells:Evidence for a protective role in virus-induced encephalitis[J].J Virol,2008,82(6):3031-3044.
15 Mehta BA,Schmidt-Wolf IG,Weissman IL,et al.Two pathways of exocytosis of cytoplasmic granule contents and target cell killing by cytokine-induced CD3+CD56+killer cells[J].Blood,1995,86(9):3493-3499.
16 Ortaldo JR,Winkler-Pickett RT,Yagita H,et al.Comparative studies of CD3-and CD3+CD56+cells: examination of morphology,functions,T cell receptor rearrangement,and pore-forming protein expression[J].Cell Immunol,1991,136(2):486-495.
17 Schmidt-Wolf IG,Lefterova P,Johnston V,et al.Sensitivity of multidrug-resistant tumor cell lines to immunologic effector cells[J].Cell Immunol,1996,169(1):85-90.
18 Verneris MR,Kornacker M,Mainlander V,et al.Resistence of ex vivo expanded CD3+CD56+T cells to Fas-mediated apoptosis[J].Cancer Immunol Immunother,2000,49(6): 335-345.
19 McGahon A,Bissonnette R,Schimitt M,et al.BCR/ABL maintains resistance of chronic myelogenous leukemia cells to apoptotic cell death[J].Blood,1994,83(5):1179-1187.
20 任欢,邢淑贤,徐红薇,等.CIK细胞的体外扩增及体内外杀瘤活性的实验研究[J].中国肿瘤生物治疗杂志,1999,6(1):17-21.
21 岳欣.CIK细胞治疗恶性实体瘤的临床前研究[D].天津:天津医科大学,2005.
22 Tak W.Mak, Mary E.Saunders.The immune response: basic and clinical principles[M].Elsevier Academic Press,2006:847.
23 Herberg W,Muhonen T,Turunen JP,et al.The CD4/CD8 ratio as a prognostic factor in patients with metastatic melanoma receiving chemoimmunotherapy[J].J Clin Oncol,1996,14(5):1690-1696.
24 Tsukishiro T,Donnenberg AD,Whiteside TL.Rapid turnover of the CD8(+)CD28(-)T-cell subset of effector cells in the circulation of patients with head and neck cancer[J].Cancer Immunol Immunother,2003,52(10):599-607.
25 Chen T,Shi JH,Zhao RH,et al.Determination of four kinds of cell phenotypes of peripheral blood lymphocytes in patients with colorectal cancer[J].Ai Zheng,2003,22(7):758-761.
26 任鹏涛.肿瘤免疫治疗中CIK细胞、Treg细胞及相关性研究[D].石家庄∶河北医科大学,2009.
27 Henney CS,Kuribayashi K,Kern DE,et al.Kern & Steven Gillis Interleukin-2 augments natural killer cell activity[J].Nature,1981,291(5813):335-338.
28 MA Cooper,TA Fehniger,MA Caligiuri.The biology of human natural killer-cell subsets[J].Trends immunol,2001,22(11):633-640.
29 李荣,王杰军,钱建新,等.肿瘤患者血清IAP、T细胞亚群和NK与抑郁之间的关系[J].世界华人消化杂志,2008,16(3):335-337.
30 王军阳,曾晓艳,袁育康,等.白细胞介素-2对小鼠神经病理性痛的镇痛作用[J].西安交通大学学报(医学版),2006,27(4):391-393,407.
31 Dunn GP,Bruce AT,Ikeda H,et al.Cancer immunoediting: from immuno-surveillance to tumor escape[J].Nat Immunol,2002,3(11):991-998.
32 陈慰峰.医学免疫学[M].北京∶人民卫生出版社,2004∶109.
33 Mihalyo MA,Doody AD,McAleer JP,et al.In vivo cyclophosphamide and IL-2 treatment impedes selfantigen-induced effector CD4 cell tolerization:implications for adoptive immunotherapy[J].J Immunol,2004,172(9)∶5338-5345.
34 Beyer M,Kochanek M,Darabi K,et al.Reduced frequencies and suppressive function of CD4+CD25+regulatory T cells in patients with chronic lymphocytic leukemia after therapy with fludarabine[J].Blood,2005,106(6):2018-2025.
Self-derived cytokine-induced killer cells for patients with advanced malignant solid tumors
Lyu Xiaoxia*,Chen Guoling,Wang Xuequn,Li Chengqin,Han Xiaoying.*Provincial Hospital Affiliated to Shandong University,Jinan 250021,China
Han Xiaoying,Email:mylittlecarol@sina.com
Objective To observe the clinical effects of cytokine-induced killer cells (CIKs) for patients with advanced malignant solid tumor.MethodsPeripheral blood mononuclear cells (PBMCs) were obtained from 50ml of peripheral blood of 21 patients.CIK cells were induced by culturing the PBMCs with cytokines and intravenously infused.Immunity indexes,levels of tumor markers,quality of life and the Karnofsky’s score were recorded during one-year follow-up.ResultsDecreased levels of tumor markers were observed among 14 patients after CIK therapy 57.14﹪; flow cytometry showed that the percentage of CD3+(from 70.81﹪± 10.52﹪to 71.91﹪±11.09﹪,t= 0.762,P= 0.455),CD4+(from 39.06﹪± 11.03﹪ to 39.21﹪± 8.74﹪,t= 0.09,P= 0.927) and CD8+(from 28.75﹪±8.22﹪ to 29.88﹪±10.13﹪,t= 0.895,P= 0.382) tended to increase(P> 0.05),and that of CD16+CD56+(NK cells) (from 15.73﹪±9.52﹪ to 15.37﹪±6.66﹪,t= -0.173,P= 0.865) decreased slightly(P> 0.05);no statistical significance was observed in the average score of ‘globel health’ (from 41.67±17.28 to 46.43±17.19,P= 0.076),the average score of physical functioning(from 62.94±17.48 to 66.67±17.37,P= 0.012) increased significantly.The scores of fatigue (from 51.33±20.03 to 43.38±16.81,P= 0.012),pain(from 44.44±19.24 to 36.51±14.55,P= 0.038) and appetite loss decreased significantly (from 52.38±19.92 to 38.09±21.82,P= 0.016),KPS scores did not change (from 61.42±3.59 to 62.38±4.36,t= 1.000,P> 0.05).Three patients died during the follow-up and the one-year survival rate was 85.7﹪ .ConclusionInfusions of CIK cells are beneficial for patients with advanced malignant solid tumors.The long-term outcomes should be explored.
Neoplasms;Killer cells;Immunotherapy
2013-12-18)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2014.03.004
250021 济南,山东大学附属省立医院(吕晓霞、王学群、韩晓颖);美国罗彻斯特大学(陈帼玲);山东泰安市中心医院(李成芹)
韩晓颖,Email:mylittlecarol@sina.com
吕晓霞,陈帼玲,王学群,等.自体CIK细胞治疗21例中晚期恶性实体瘤的肿瘤标志物变化观察[J/CD].中华细胞与干细胞杂志:电子版,2014,4(3):165-174.
