间充质干细胞条件培养基对新生大鼠缺氧缺血脑损伤移植神经干细胞凋亡的影响
2014-05-05张艳莎杨印祥栾佐何志旭汪兆艳章波
张艳莎 杨印祥 栾佐 何志旭 汪兆艳 章波
间充质干细胞条件培养基对新生大鼠缺氧缺血脑损伤移植神经干细胞凋亡的影响
张艳莎 杨印祥 栾佐 何志旭 汪兆艳 章波
目的研究来源于人脂肪间充质干细胞(MSCs)的条件培养基对新生大鼠缺氧缺血脑损伤移植NSCs凋亡的影响。方法孕14.5天SD大鼠取乳鼠海马NSCs培养至第2~3代,DAPI标记后用于移植。7 d龄SD大鼠根据Rice法进行改进,制作缺氧缺血脑损伤模型。造模成功后分为3组,每组20只:模型组(Ⅰ)、脂肪MSCs条件培养基(ASCCM)联合神经干细胞(NSCs)移植组(Ⅱ)及NSCs移植组(Ⅲ)。建模24 h后,Ⅱ行右侧颈总静脉注射50 μl ASC-CM,Ⅲ注射等体积生理盐水。注射完成后止血,Ⅱ、Ⅲ于左侧海马进行NSCs移植,Ⅰ不采取任何注射和移植。分别于移植后24、48 h,3组脑组织冰冻切片行TUNEL染色观察细胞凋亡情况;提取左侧损伤区脑组织蛋白质,测定活化caspase-3凋亡蛋白的表达。采用t检验和方差分析进行统计学分析。结果移植后48 h,组Ⅱ、Ⅲ的脑组织外源性NSCs凋亡数分别为230.00±8.94、305.00±20.70,两两比较,差异有统计学意义(P< 0.05);但移植后24 h两组之间的脑组织外源性NSCs凋亡数分别为481.25±39.99、512.22±47.11,差异无统计学意义。三组左侧损伤区脑组织的活化caspase-3凋亡蛋白表达,于移植后24 h,其灰度分别为234.08±1.78、234.37±4.59、235.10±2.74,三组间差异无统计学意义;移植后48 h,三组灰度分别为229.85±1.63、211.35±2.83、232.20±1.22,三组间差异有统计学意义(P< 0.05);这表明与其它两组比较,ASC-CM联合NSCs移植可明显降低外源性NSCs的凋亡率,降低活化的Caspase-3表达。结论MSCs条件培养基可以改善新生大鼠缺氧缺血脑损伤模型移植的NSCs存活,减少其凋亡,降低活化caspase-3凋亡蛋白的表达。
间充质干细胞;细胞培养技术;神经干细胞;细胞移植;细胞凋亡
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是引起儿童长期神经系统缺陷的一种常见原因。围产期窒息是本症的主要病因。HIE活婴发病率为2.5/1000[1],HIE窒息患儿在新生儿期死亡,存活患儿中25﹪患有永久性神经系统障碍[2]:如脑瘫、智力障碍、学习困难或癫痫。这些慢性期缺陷不能通过常规治疗修复。近年来,干细胞(前体细胞)移植应用于HIE动物模型的治疗已经被证实有效,如神经干细胞(neuro stem cells,NSCs)(前体细胞)、间充质干细胞(mesenchymal stem cells,MSCs)、骨髓及脐带血细胞等显示有治疗的潜能。
移植的干细胞低存活率影响了其治疗效果的最佳发挥。Bakshi等[3]研究发现急性脑外伤大鼠建模后24 h行病灶深部皮层神经前体细胞移植,移植24 h后仅仅2﹪~ 4.5﹪外源性干细胞存活。Brundin等[4]研究报道动物及临床数据表明,移植的多巴胺神经元仅仅1﹪~20﹪存活。Sortwell等[5]研究报道移植的胚胎中脑多巴胺神经元,在移植后第1~4天90﹪移植的细胞死亡。近年来研究报道:脂肪MSCs分泌一些潜在的、有利的生长因子,如粒细胞-巨噬细胞集落刺激因子、血管内皮生长因子、肝细胞生长因子、碱性纤维生长因子、转化生长因子-β、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)及脑源性神经营养因子等[6-10]。脂肪MSCs条件培养基对于体内移植的外源性细胞是否有保护作用,至今未有报道。本研究目的是通过静脉注射脂肪MSCs条件培养基,改善新生大鼠缺氧缺血脑损伤大脑微环境,减少外源性NSCs移植的凋亡率及降低凋亡蛋白caspase-3的活化表达,增加移植细胞的植入率,从而可能长期改善新生大鼠缺氧缺血脑损伤行为学表现。
材料与方法
一、材料
1.动物与分组:出生7 d的SD乳鼠6窝(军事医学科学院实验动物中心),10~12只/窝,体重14~16 g,雌雄不限。根据随机数字表法随机分为3组,每组20只:模型组(Ⅰ)、因子联合细胞移植组(Ⅱ)及移植组(Ⅲ)。
2.主要试剂及仪器:DMEM/F12无血清专用培养基、B27、N2、bFGF、EGF、L-谷氨酰胺、鸟氨酸(美国Gibco公司),Laminin(美国Invitrogen公 司,23017101),DAPI(瑞 士 Roche公 司,RTD2856),山羊血清封闭液、小鼠抗nestin抗体、小鼠抗β-Ⅲ-tubulin抗体、兔抗GFAP抗体、山羊抗小鼠IgG/FITC、山羊抗兔IgG/Dylight、小鼠抗β-actin抗体、辣根过氧化物酶标山羊抗小鼠IgG、辣根过氧化物酶标山羊抗兔IgG(北京中杉金桥),TACS®TdT-Fluor in Situ Apoptosis Detection Kit(美国Trevigen公司,Catalog # 4812-30-K),兔抗活化caspase-3抗体(美国Cell Signaling Technology,9664)。冰冻切片机(Leica,德国)CO2细胞培养箱(日本Sanyo,MCO-20AIC),倒置显微镜(日本Olympus公司,CKX-41SF),荧光显微镜+照相系统(日本Olympus公司,IX-51),纯水仪(美国Millipore公司,MILLI-Q),超净台(美国Biobase公司,BBS-SDC),电泳仪及转膜仪(美国伯乐)。
二、方法
1.NSCs培养及鉴定:孕14.5 d SD大鼠脱颈处死,于75﹪酒精浸泡10 min,体视镜下分离两侧海马组织。机械吹散成单细胞悬液,200目筛网过滤,收集细胞加入NSCs条件培养基(DMEM/ F12,成纤维细胞生长因子20 ng/ml,表皮生长因子20 ng/ml,B27 2﹪,L-谷氨酰胺2 mmol/L),细胞培养至第2-3代,进行免疫荧光染色鉴定。
将培养至第2-3代的NSCs球进行自身及分化鉴定。鸟氨酸铺板48孔板,室温至少2 h;PBS漂洗3次,Laminin铺板,37℃孵育箱过夜;NSCs球接种于48孔板,NSCs自身鉴定培养基为NSCs条件培养基,NSCs分化鉴定培养基为DMEM/F12 + 1﹪ N2,于37℃、5﹪CO2细胞培养箱中培养。NSCs自身鉴定,培养过夜;NSCs分化鉴定培养6~7 d,3~4.5 d换液;PBS漂洗1次,4﹪多聚甲醛于4℃冰箱固定15~20 min;PBS洗3次,10 min/次;0.3﹪ TritonX-100用于细胞破膜,100 μl/孔,10 min;PBS洗3次,10 min/次;山羊血清封闭液100 μl/孔,室温封闭40 min;PBS洗3次,10 min/次;加一抗小鼠抗nestin抗体(1:200)、小鼠抗β-Ⅲ-tubulin(1:400)、兔抗GFAP(1:200),4℃过夜,用于NSCs自身及分化鉴定。
2.MSCs条件培养基制备:人脂肪MSCs条件培养基由中国人民解放军海军总医院儿科实验室提供。脂肪组织来源于3位20~30岁瘢痕患者,经腹部取出脂肪块,尽快转至超净台中;将切取的脂肪组织放入平皿中,去除血管、包膜等非脂肪组织,用PBS冲洗,剪碎,加入等量0.1﹪Ⅰ型胶原酶,在37℃恒温摇床中消化45 min;将消化成糊状的脂肪组织先用80目筛网过滤,再用200目筛网过滤,过滤液400 ×g离心5 min,PBS洗涤2次,将重悬后的细胞悬液接种于含10﹪胎牛血清的DMEM-LG培养液中,37℃、5﹪CO2饱和湿度的孵育箱中培养。接种密度为1×106/ml。48 h后第1次换液,以后每3 d换液1次,7~10 d后传代;收集培养至第3代的脂肪MSCs培养基,浓缩至50×,分装100 μl/支,-20℃保存备用[25]。
3.模型制作:新生7 d的SD乳鼠根据Rice法进行改进制作缺氧缺血脑损伤模型。将7日龄SD乳鼠麻醉后上、下端结扎左侧颈总动脉,中间剪断。术后恢复3~5 h,将其置于缺氧箱中,并通入8﹪氧气和92﹪氮气的混合气体,速度为1 L/min,持续150~180 min,死亡率为20﹪。缺氧完成后放回母鼠处,继续饲养。
4.建模后治疗:建模后24 h,三组均以1﹪戊巴比妥钠30 mg/kg腹腔注射麻醉。Ⅱ右侧颈总静脉注射50 μl ASC-CM(50×)、Ⅲ(10只)注射50 μl生理盐水。静脉注射完成后,止血,Ⅱ、Ⅲ经左侧海马行NSCs移植术。培养至第2~3代NSCs用DAPI标记2 h用于移植。3组乳鼠俯卧于脑立体定位仪,头皮正中切口约1 cm暴露颅骨,注射点为前囟后2 mm,中线左侧2 mm,皮层向下垂直深度1.5 mm。用1 ml注射针头在移植位点处轻剥离少许颅骨,用5 μl微量注射器吸入5 μl DAPI(50 mg/ml DAPI标记2 h)标记NSCs小球(浓度为5×104/μl)匀速缓慢注入左侧海马,注射时间约5 min,留针5 min后缓慢退针,缝合头皮,用碘伏、酒精先后消毒手术部位,乳鼠待苏醒后送回母鼠处。
5.TUNEL染色检测细胞凋亡情况:移植后24 h、48 h,脱颈处死乳鼠,取脑,先后置于4℃4﹪多聚甲醛固定48~72 h、20﹪蔗糖脱水至沉底,于冰冻切片机切片,海马移植位点处前后2 mm连续冠状切片3张,10 μm/张,间隔10张再连续切片,隔6取1用于TUNEL染色。按TUNEL试剂盒染色:将切片放于45℃温箱2 h烤干切片,依次浸泡切片于100﹪、95﹪、75﹪酒精,各5 min;PBS冲洗5 min;浸泡切片于3.7﹪多聚甲醛10 min;PBS浸泡10 min;用蛋白酶K覆盖样本15~30 min;去离子水洗2次,各2 min;浸泡切片于1×TdT标记缓冲液5 min;用标记反应混合物覆盖切片,37℃湿盒中孵育60 min;浸泡切片于1×TdT终止缓冲液5 min;PBS洗2次,各2 min;用Strep-Fluor溶液覆盖切片,暗室中孵育20 min;PBS洗3次,各2 min;495 nm荧光显微镜下观察。
6.Western blotting检测活化caspase-3凋亡蛋白表达:移植后24 h、48 h,脱颈处死乳鼠,取左侧损伤侧脑组织,称重,按100 mg : 1 ml比例加入细胞裂解液(含PMSF、Leupeptin、Aprotinin、Pepstatin),于匀浆器中进行匀浆,然后置于冰上。间隔重复碾几次使组织尽量碾碎。裂解30 min后,将裂解液移至1.5 ml离心管中,在4℃下400 ×g离心5 min,取上清分装于0.2 ml离心管中并置于-80℃保存。根据BCA蛋白定量试剂盒检测总蛋白浓度,行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,电泳总蛋白上样量为200 μg.湿转至PVDF膜上;封闭液封闭1 h;4℃孵育兔抗活化caspase-3抗体(1:1000)、小鼠抗β-actin(1:1000)过夜;室温下孵育辣根过氧化物酶标记的山羊抗兔IgG、辣根过氧化物酶标山羊抗小鼠IgG 1h;X线胶片曝光30 min,显影、定影。
三、统计学分析方法
采用SPSS16.0统计软件分析,数据以表示,Ⅱ、Ⅲ两组间脑组织外源性NSCs凋亡数比较采用两样本t检验,三组间损伤区脑组织的活化caspase-3凋亡蛋白表达比较采用方差分析,以P< 0.05为差异具有统计学意义。
结 果
一、NSCs培养及鉴定
从新生SD大鼠海马提取的细胞接种于无血清完全培养基上,细胞呈悬浮生长,每3 d半量换液,3 d生长出大小不一的细胞团,即神经球。这些球呈悬浮状,形态规则,可见毛刺状突起长出。7 d进行1∶2传代,培养至第2~3代进行NSCs自身及分化的鉴定。(图1)
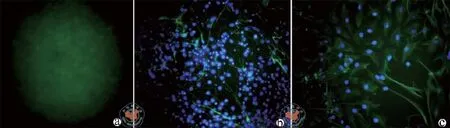
图1 荧光显微下观察NSCs自身及分化鉴定(× 400)
二、新生大鼠缺氧缺血脑损伤模型动物的鉴定
7日龄SD乳鼠麻醉后,颈部正中切口分离左侧颈总动脉,上、下端结扎中间剪断,缝合切口。室温恢复3~5 h待大鼠清醒,生命体征稳定如皮肤红润、腹部自主呼吸匀称、自由爬行等。关闭缺氧箱,箱中温度升至37℃,向缺氧箱中持续通入8﹪氧气 + 92﹪氮气的混合气体,气流量为1 L/min,持续约150~180 min。缺氧过程中死亡率控制为20﹪。图示HIE模型动物建模后24 h行TTC(2,3,5-氯化三苯基四氮唑)染色。白色区域为左侧大脑皮层及海马缺氧缺血脑损伤引起的梗死区域、梗死区域面积约10 mm×5mm(图2)。
三、TUNEL染色检测细胞凋亡
MSCs条件培养基联合NSCs移植治疗新生SD乳鼠缺氧缺血脑损伤模型动物,移植后24 h,Ⅰ(A)示内源性细胞凋亡,Ⅱ(B)、Ⅲ(C)组外源性细胞凋亡数/切片分别为481.25±39.99、512.22±47.11,两两比较无统计学意义(P> 0.05)。移植后48 hⅡ、Ⅲ组外源性NSCs凋亡数/切片分别为230.00±8.94、305.00±20.70,差异有统计学意义(P< 0.05)。(图3、4和表1)
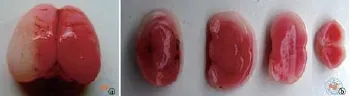
图2 TTC染色鉴定新生SD乳鼠缺氧缺血脑损伤模型的建立
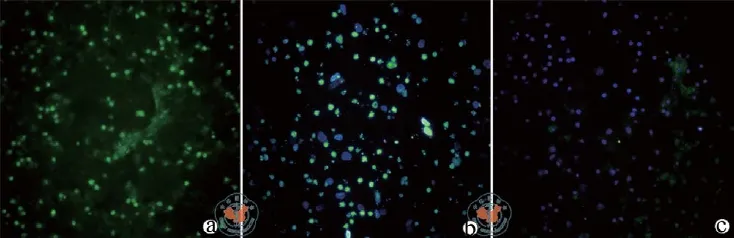
图3 荧光显微镜下观察移植后24 h,TUNEL染色检测Ⅱ、Ⅲ移植的外源性细胞凋亡数(× 400)

图4 荧光显微镜下观察移植后48h,TUNEL染色检测Ⅱ、Ⅲ移植的外源性细胞凋亡数(×4 00)
表1 移植后24 h、48 h外源性细胞凋亡数/切片(± s)
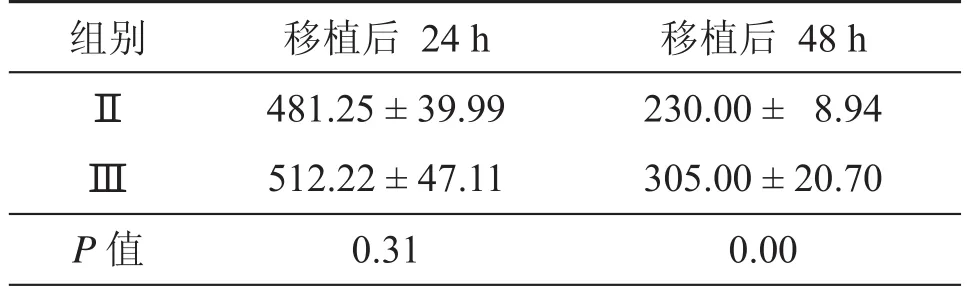
表1 移植后24 h、48 h外源性细胞凋亡数/切片(± s)
组别 移植后 24 h 移植后 48 hⅡ 481.25±39.99 230.00 ± 8.94Ⅲ 512.22±47.11 305.00±20.70P值 0.31 0.00
四、Western blotting检测活化caspase-3凋亡蛋白表达
Western blotting检测结果显示移植后24 h,活化caspase-3凋亡蛋白表达,三组灰度分别为234.08±1.78、234.37±4.59、235.10±2.74,三组间差异无统计学意义(P> 0.05);移植后48 h,三组灰度分别为229.85±1.63、211.35±2.83、232.20±1.22,三组间差异有统计学意义(P< 0.05);另组Ⅱ分别与Ⅰ、Ⅲ比较,P均< 0.05,表明组Ⅱ的活化caspase-3凋亡蛋白表达较其它两组明显降低(图5,6)。

图5 Western blotting检测活化caspase-3凋亡蛋白的表达
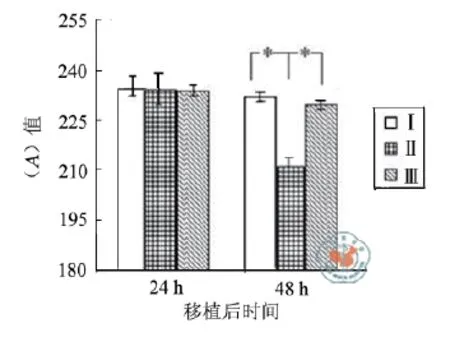
图6 移植后24 h、48 h,三组脑组织caspase-3凋亡蛋白的表达
讨 论
MSCs是属于中胚层的一类多能干细胞,主要存在于结缔组织和器官间质中,以骨髓中含量最丰富。因其具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点而日益受到人们的关注。目前MSCs应用于临床试验有移植物抗宿主病、心血管疾病修复、肝脏疾病。其生物学特点四种性质最重要:静脉注射后在损伤组织炎症部位归巢;分化为不同类型细胞的能力;分泌大量的生物活性因子刺激损伤的细胞恢复及抑制炎症反应;缺乏免疫原性且有能力执行免疫调节作用。
MSCs可从骨髓、脂肪组织、脐带血及真皮组织分离获得。为了确定不同来源的MSCs是否有相似的功能或来源于不同的微环境是否反应不同,已有研究显示比较分析不同来源的MSCs其细胞特点及功能:骨髓来源的MSCs与脂肪来源的MSCs在免疫特性上较为相似,这些细胞表面标记物包括MHC-Ⅰ、MHC-Ⅱ及CD40/CD40L;同时两者显示出相似的免疫调节作用及对于促细胞分裂素产生淋巴细胞增殖反应。但另一方面,骨髓MSCs更趋向于分化为骨及软骨,而脂肪MSCs具有优先分化为脂肪的能力。脂肪来源的MSCs具有以下优势:取材方便,对供者创伤性更小,可以分泌更多的细胞因子[11]。
鉴于神经系统功能异常通常源于神经细胞缺失,利用NSCs的多向分化潜能实现细胞替代疗法已被用于治疗多种神经系统疾病模型,如脑缺血[12]、脑中风[13]、脊髓损伤[14]、亨廷顿病[15]、帕金森病[16]和进行性脊髓病性肌萎缩[17]等。目前NSCs用于治疗的可能机制:患病部位组织损伤后释放各种趋化因子,可以吸引NSCs聚集到损伤部位,并在局部微环境的作用下分化为不同种类的细胞,修复及补充损伤的神经细胞;NSCs可以分泌多种神经营养因子,促进损伤细胞的修复;NSCs可以增强突触之间的联系,建立新的神经环路。移植的NSCs命运很大程度上依赖于宿主微环境、移植时间、移植部位(神经形成部位或非神经形成部位)及宿主中枢神经系统损伤或疾病丢失的细胞类型。免疫反应[18]、移植前NSCs活力及移植过程中细胞损伤也影响了移植的NSCs存活率。大量研究表明在脑缺血损伤区域,绝大多数细胞通过细胞凋亡途径,而非细胞坏死途径导致移植细胞死亡[19-20],同时在移植后适当时机通过药物可以补救移植细胞的凋亡[21-22]。因此改善宿主微环境,应用多种手段,如联合营养因子、药物、其它细胞或基因修饰后移植,提高移植的NSCs存活率成为当今研究热点。
本研究中,NSCs移植后24 h、48 h比较联合应用ASC-CM与否的两组中移植NSCs的凋亡数量,结果显示移植后48 h,联合ASC-CM组的凋亡细胞数量明显少于NSCs移植组,同时其活化caspase-3蛋白表达明显低于NSCs移植组和模型组(空白对照组)。但移植后24 h两组之间比较差异无统计学意义,活化的caspase-3蛋白表达三组间差异无统计学意义。其可能原因是:由于移植的NSCs在HIE模型动物左侧损伤侧水肿、坏死及炎症反应环境下不适合其存活,大多数细胞经历凋亡,短时间内ASC-CM逆转外源性NSCs作用不明显。移植后48 h,可能ASC-CM通过改善HIE模型动物左侧损伤侧微环境,逆转移植的NSCs凋亡,提示静脉注射ASC-CM可以降低移植的NSCs凋亡。Wei等[23]应用ASCCM静脉注射至HIE模型大鼠,注射后1周显示ASC-CM可以保护海马及皮层体积避免丢失。
以往研究证实神经营养因子,如IGF-1和促红细胞生成素可以拯救不同类型的神经元避免缺血、缺氧缺血损伤、神经毒素及兴奋性中毒[24-28]。这些因子可能作用机制是保护神经元避免损伤及促进损伤的细胞修复。2009年,Wei等[23]体外研究显示脂肪间质细胞分泌的神经保护介质可以抗神经元凋亡;Zhao等[29]体外研究显示ASC-CM通过BDNF保护谷氨酰胺诱导的小脑颗粒神经元避免死亡。同年,Wei等[23]应用ASC-CM右侧颈总静脉注射到HIE动物模型,证实ASC-CM对HIE动物模型左侧脑损伤神经元具有保护作用,主要是源于ASC-CM中的IGF-1和脑源性神经营养因子(BDNF)发挥作用。本实验结果提示ASC-CM可以改善新生大鼠缺氧缺血脑损伤移植的NSCs存活,降低凋亡率,与上述报道一致。
尽管目前的研究显示大量不同细胞类型已经应用于新生大鼠缺氧缺血脑损伤动物模型治疗,并且取得一定的效果。但从临床应用来说,尚有若干问题仍亟待解决,如确定最优的细胞类型、给予途径、细胞数量、给予细胞时间等,并且细胞治疗的机制尚待进一步深入研究,为后续的细胞临床治疗应用打下良好基础。
1 Graham EM,KA Ruis,AL Hartman,et al.A systematic review of the role of intrapartum hypoxia-ischemia in the causation of neonatal encephalopathy[J].Am J Obstet Gynecol,2008,199(6):587-595.
2 Pfenninger J,Bachmann D,Wagner BP.Survivors with bad outcome after hypoxic-ischaemic encephalopathy:Full-term neonates compare unfavourably with children[J].Swiss Med Wkly,2001,131(19-20):267-272.
3 Bakshi A,Keck CA,Koshkin VS,et al.Caspase-mediate cell death predominates following engraftment of neural progenitor cells into traumatically injured rat brain[J].Brain Res,2005,1065(1-2):8-19.
4 Brundin P,Karlsson J,Emgard M,et al.Improving the survival of grafted dopaminergic neurons:a review over current approaches[J].Cell Transplant,2000,9(2):179-195.
5 Sortwell CE,Pitzer MR,Collier TJ.Time course of apoptotic cell death within mesencephalic cell suspension grafts: implications for improving grafted dopamine neuron survival[J].Exp Neurol,2000,165(2):268-277.
6 Rehman J,Traktuev D,Li J,et al.Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells[J].Circulation,2004,109(10):1292-1298.
7 Nakagami H,Maeda K,Morishita R,et al.Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adipose tissue-derived stromal cells[J].Arterioscler Thromb Vasc Biol,2005,25(12):2542-2547.
8 Sadat S,Gehmert S,Song YH,et al.The cardioprotective effect of mesenchymal stem cells is mediated by IGF-I and VEGF[J].Biochem Biophys Res Commun,2007,363(3):674-679.
9 Kumral A,Uysal N,Tugyan K,et al.Erythropoietin improves long-term spatial memory deficits and brain injury following neonatal hypoxiaischemia in rats[J].Behav Brain Res,2004,153(1):77-86.
10 Wei L,Han BH,Li Y,et al.Cell death mechanism and protective effect of erythropoietin after focal ischemia in the whisker-barrel cortex of neonatal rats[J].Pharmacol Exp Ther,2006,317(1):109-116.
11 Hsiao ST,Asgari A,Lokmic Z,et al.Comparative analysis of paracrine factor expression in human adult mesenchymal stem cells derived from bone marrow,adipose,and dermal tissue[J].Stem Cells Dev,2012,21(12):2189-2203.
12 Chu K,Kim M,Park KI,et al.Human neural stem cells improve sensorimotor deficits in the adult rat brain with experimental focal ischemia[J].Brain Res,2004,1016(2):145-153.
13 Chu K,Kim M,Jeong SW,et al.Human neural stem cells can migrate,differentiate and integrate after intravenous transplantation in adult rats with transient forbrain ischemia[J].Neurosci Lett,2003,343(2):129-133.
14 Hofstetter CP,Schwarz EJ,Hess D,et al.Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery[J].Proc Natl Acad Sci USA,2002,99(4):2199-2204.
15 McBride JL,Behrstock SP,Chen EY,et al.Human neural stem cell transplants improve motor function in a rat model of Huntington,s disease[J].J Comp Neurol,2004,475(2):211-219.
16 Hagell P,Brundin P.Cell survival and clinical outcomefollowing intrastriatal transplantation in Parkinson disease[J].J Neuropathol Exp Neurol,2001,60(8):741-752.
17 Klein SM,Behrstock S,McHugh J,et al.GDNF delivery using human neural progenitor cells in a rat model of ALS[J].Hum Gene Ther,2005,16(4):509-521.
18 Muraoka K,Shingo T,Yasuhara T,et al.The high integration and differentiation potential of autologous neural stem cell transplantation compared with allogeneic transplantation in adult rat hippocampus[J].Exp Neurol,2006,199(2):311-327.
19 Nakajima W,Ishida A,Lange MS,et al.Apoptosis has a prolonged role in the neurodegeneration after hypoxic ischemia in the newborn rat[J].Neurosci,2000,20(21):7994-8004.
20 Chen JW,Lin J,Madamanchi N,et al.Apoptosis occurs in a new model of thermal brain injury[J].J Biomed Sci,2000,7(6):459-465.
21 Kilicdag H,Daglioglu YK,Erdogan S,et al.Effects of caffeine on neuronal apoptosis in neonatal hypoxic-ischemic brain injury[J].J Matern Fetal Neonatal Med,2014 Feb 11.[Epub ahead of print].
22 Zhang M,Shan H,Chang P,et al.Hydrogen sul fi de offers neuroprotection on traumatic brain injury in parallel with reduced apoptosis and autophagy in mice[J].PLoS One,2014,9(1):e87241.
23 Wei X,Du Z,Feng D,et al.IFATS Collection:The conditioned media of adipose stromal cells protect against hypoxia-ischemia-induced brain damage in neonatal rats[J].Stem cells,2009,27(2):478-488.
24 Iwai M,Cao G,Yin W,et al.Erythropoietin promotes neuronal replacement through revascularization and neurogenesis after neonatal hypoxia/ischemia in rats[J].Stroke,2007,38(10):2795-2803.
25 Escartin C,Boyer F,Bemelmans AP,et al.Insulin growth factor-1 protects against excitotoxicity in the rat striatum[J].Neuroreport,2004,15(14):2251-2254.
26 Almli CR,Levy TJ,Han BH,et al.BDNF protects against spatial memory deficits following neonatal hypoxiaischemia[J].Exp Neurol,2000,166(1):99-114.
27 Schabitz WR,Sommer C,Zoder W,et al.Intravenous brain-derived neurotrophic factor reduces infarct size and counterregulates Bax and Bcl-2 expression after temporary focal cerebral ischemia[J].Stroke,2000,31(9):2212-2217.
28 D'Mello SR,Borodezt K,Soltoff SP.Insulin-like growth factor and potassium depolarization maintain neuronal survival by distinct pathways:Possible involvement of PI 3-kinase in IGF-1 signaling[J].Neurosci,1997,17(5): 1548-1560.
29 Zhao L,Wei X,Ma Z,et al.Adipose stromal cellsconditional medium protected glutamate-induced CGNs neuronal death by BDNF[J].Neurosci Lett,2009,452(3):238-240.
Conditioned media of mesenchymal stem cells alleviate apoptosis of transplantated neural stem cell for hypoxic-ischemic brain injury in a neonatal rat model
Zhang Yansha*,Yang Yinxiang,Luan Zuo,He Zhixu ,Wang Zhaoyan,Zhang Bo.*Department of Pediatrics,Navy General Hospital,Beijing 100048,China
Luan Zuo,Email:luanzuo@aliyun.com; He Zhixu,Email:hzx@gmc.edu.cn
ObjectiveThe study investigated the effects of conditioned media of mesenchymal stem cells from human adipose-derived stem cells on the apoptosis of neural stem cell transplanted for hypoxic-ischemic brain injury in a neonatal rat model.MethodsPregnant Sprague-Dawley rats were sacrificed and hippocampuses of the fetus were removed at gestational day 14.5.The neural stem cells were isolated,cultured to 2-3 passage and labeled by DAPI before transplantation.A total of 60 pups were randomly divided into three groups after hypoxic-ischemia was induced: (Ⅰ) control group,(Ⅱ) ASC-CM plus NSC group and (Ⅲ)NSC group.24 hours after hypoxic-ischemia was induced,pups in group Ⅱ received injections of 50 μl of ASC-CM plus NSCs via the left jugular vein,and pups in group Ⅲ received 50 μl of NS plus NSCs.Pups in the blank control group received no injection and transplantation.Pups were killed 24 hours and 48 hours after transplantation,respectively.Brain tissues were subject to TUNEL staining for observing cell apoptosis.The expression of the cleavage caspase-3 in the left injured brain tissue was evaluated.T test and ANOVA were used for statistical analysis.Results24 hours after transplantation,exogenous neural stem cell apoptosis of the brain was similar between groups Ⅱ (481.25±39.99) and Ⅲ(512.22±47.11).48 hours after transplantation,there was significant differences between groupⅡ(230.00±8.94) and groupⅢ (305.00±20.70).24 hours after transplantation,there was no significant differences in expression of cleavage caspase-3 in the three groups (234.08 ±1.78、234.37±4.59、235.10±2.74,P= 0.88).48 hours after transplantation,there was significant differences in the three groups(229.85±1.63、211.35±2.83、232.20±1.22,P= 0.00).Expression of cleavage caspase-3 was significantly lower in group Ⅱ than the other two groups.ConclusionsOur data suggest that treatment with ASC-CM and neural stem cells transplantation lead to reduced exogenous neural stem cell apoptosis and expression of cleavage caspase-3 protein in neonatal brain after hypoxic-ischemia.
Mesenchymal stem cell;Cell culture techniques;Neuro stem cell;Cell transplantation;Cell apoptosis
2013-12-18)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2014.03.005
国家科技部国际合作研究项目(2012DFA30880)
100048 北京,海军总医院儿科(张艳莎、杨印祥、栾佐、汪兆艳、章波);贵阳医学院儿科(何志旭)
栾佐,Email:luanzuo@aliyun.com;何志旭,Email:hzx@gmc.edu.cn
张艳莎,杨印祥,栾佐,等.间充质干细胞条件培养基对新生大鼠缺氧缺血脑损伤移植神经干细胞凋亡的影响[J/CD].中华细胞与干细胞杂志:电子版,2014,4(3):175-182.
