人体牙髓干细胞的分离与鉴定
2014-05-05张男王伟陈保兴陈超贾昕丁宇欣左鑫邓琴南张彬韩发彬
张男 王伟 陈保兴 陈超 贾昕 丁宇欣 左鑫 邓琴南 张彬 韩发彬
人体牙髓干细胞的分离与鉴定
张男 王伟 陈保兴 陈超 贾昕 丁宇欣 左鑫 邓琴南 张彬 韩发彬
目的探讨牙髓干细胞(DPSC)对牙周病,外伤及肿瘤等造成下颌骨缺损、口腔软组织与神经损伤的修复治疗作用。方法本研究利用组织块培养法分离出人体DPSC,用流式细胞仪进行了鉴定,并进行DPSC成骨、成脂、成神经的分化研究。结果分离出3株DPSC,流式细胞分析表明DPSC表达CD73 和CD90标志物,但不表达生血干细胞标志物CD34。用茜素红染色表明DPSC能分化成骨细胞,油红O染色表明DPSC能分化成脂肪细胞,免疫免疫荧光染色表明DPSC分化的细胞表达神经细胞特异标志物TUJ1。结论组织块培养能够高效快速分离表达CD73和CD90的DPSC,在体外诱导条件下DPSC能分化为成骨细胞、脂肪细胞和神经细胞,此研究为DPSC在治疗和修复骨组织缺损和神经损伤中的临床应用提供了实验依据。
牙髓;干细胞;流式细胞术;免疫荧光技术;细胞分化
人体下颌骨是颅面骨中最大的骨器官,也是口腔颌面部肌肉的附着部位和下颌牙齿生长的骨床。牙周病、创伤、占位性病变、肿瘤切除、骨髓炎、先天性发育不足等都会造成不同程度的下颌骨缺损[1]。由于下颌骨构成了颌面下1/3外观的骨支架,且主导了咀嚼、吞咽及咬合等功能,它的缺损会严重影响患者的生活质量[2]。目前下颌骨修复的主要方法是自体骨移植,然而自体骨移植会造成骨供区不同程度的缺损和畸形。因此利用骨组织工程学方法再造自身新骨成了近年来研究的热点[3-5]。
牙髓干细胞(dental pulp stem cells,DPSC)是间充质干细胞(mesenchymal stem cell,MSC)的一种,2000年由美国科学家Gronthos等[6]最先分离出来。研究发现DPSC较骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)有更强的分裂增殖能力,且DPSC具有成骨、成软骨、成神经、成脂等分化能力[7-9]。近年来,Riccio等[10]发现DPSC在成骨分化的过程中先后表达Run-2、Osx、OPN、OCN等成骨性蛋白,且其表达的时间与成骨细胞分化的时间相一致。Spath等[11]发现取自智齿的DPSC诱导后不仅大量表达ALP、COlⅠ、OPN、和OCN等成骨表型的因子,还表达与成骨细胞分化以及骨骼形态形成有关的转录因子Runx2、JunB。在体外诱导和动物体内实验中,DPSC均具有良好的成骨分化能力。Graziano等[12]和d'Aquino等[13]分别报道,将DPSC植入免疫缺陷小鼠(SCID)能够形成血供良好的板状骨,表明DPSC具有修复骨缺损的应用潜力。
为探讨利用DPSC对牙周病及肿瘤等造成下颌骨缺损及其它疾病的治疗作用,本研究利用组织块培养法分离出3株人体DPSC,并用流式细胞仪免疫荧光化学方法和RT-PCR等分子生物学方法进行了鉴定,从而为研究DPSC在治疗和修复骨、软组织及神经缺损中的临床应用提供了实验依据。
材料与方法
一、健康志愿者样本及实验材料
提供牙髓样本的健康志愿者经医院医学伦理委员会批准及填写患者知情同意书。在无菌条件下,收集22~25岁成人的多生牙或智齿,用牙钻从牙冠打开牙髓腔,用拔髓针拔取牙髓,立即放入DMEM/F12培养基中送达实验室。DMEM/ F12、L-Glutamine、非必需氨基酸(Non-essential Amino Acid,NEAA)、胎牛血清(FBS)、TrypLE和Ⅳ型胶原酶购自Invitrogen公司;6孔培养板及细胞培养皿购自Millipore和Corning公司;其它试剂购自Sigma公司。
二、实验方法
1.DPSC分离培养:新鲜采集的牙髓,在生物安全柜中用PBS洗3遍,置于6 cm培养皿中,加入少量完全DMEM/F12培养基(其中含20﹪FBS、1﹪ L-Glutamine、1﹪ NEAA 及1﹪双抗)浸润牙髓组织,用无菌手术剪将其剪碎,盖玻片将组织块固定在培养皿中,37℃、5﹪ CO2培养。48 h换液,此后每3、4 d更换1次培养基。培养约10~14 d会有细胞从组织块中爬出,细胞达到80﹪~ 90﹪汇合后,用TrypLE 在37℃消化,按1∶3比例传代。
2.DPSC流式细胞鉴定:取对数生长期的细胞制备细胞悬液,PBS离心清洗2次后,调整细胞浓度为1×107个/ml,取100 μl细胞悬液,加入50 μl正常山羊血清封闭15~20 min,对照组和实验组分别加入IgG1-PE和CD34-PE,充分混匀,室温避光孵育20 min,PBS洗涤(1000 r/min,5 min)2次,弃上清,加固定液500 μl。CD90检测对照组加 IgG1-FITC,实验组加CD90-FITC。CD73检测对照组加 IgG1-PE,实验组加CD73-PE。
3.DPSC的成骨诱导分化及茜素红染色:以1×104cells/cm2的密度将细胞种在6孔板中,待细胞的融合率达到70﹪后,在基本培养基中添加100 nmol/L Dexamesone、10 mmol/L β-glycerol phosphate、50μmol/L L-Ascorbic acid 2-phosphate、50nmol/L Vitamin D3,每3、4 d换1次液,培养2~3周,未添加诱导成份培养的细胞作为阴性对照。
观察到有结节形成后,用4﹪PFA(Sigma)固定15 min,ddH2O冲洗3遍,0.1﹪茜素红(PH8.3,Sigma)室温孵育30 min,ddH2O冲洗3~5遍后显微镜观察拍照(Nikon Ti-E)。
4.DPSC的成脂诱导分化及油红O染色:以1×104cells/cm2的密度将细胞种在6孔板中,待细胞的融合率达到70﹪后,在基本培养基中添加1μmol/L dexamethasone、10 μg/ml bovine insulin、60 μmol/L indomethacin、500 μmol/L 3-isobutyl-1-methylxanthine。每3 d换1次液,培养2~3周。
成脂分化的细胞用4﹪PFA固定30 min,PBS清洗2次,在100﹪丙二醇(Sigma)中孵育5 min,0.1﹪的油红O溶液(Sigma,溶于异丙醇中)60℃孵育10 min,85﹪的异丙醇室温孵育10 min,ddH2O水冲洗后相差显微镜观察及拍照。
5.DPSC的成神经诱导分化及免疫荧光检测:参照文献[14-15]介绍方法,DPSC成神经诱导分化分3个阶段,每阶段7 d,共21 d。第一阶段诱导分化培养液包括基础神经分化培养基(DMEM/F12,L-Glutamine,N2,P/S),并 加入2型成纤维细胞生长因子( fi broblast growth factor-2,FGF2)10 ng/ml和表皮细胞生长因子(epidermal growth factor,EGF)10 ng/ml;第二阶段包括诱导分化培养液包括基础神经分化培养基并添加SHH 100 ng/ml、FGF8 10 ng/ml、AAP 200 μmol/L;第三阶段诱导分化培养液包括基础神经分化培养基并添加GDNF 50 ng/ml和AAP 200 μmol/L。
用免疫荧光技术检测神经细胞标志物的表达。将完成3阶段成神经分化的细胞用4﹪多聚甲醛固定15 min,PBS洗3遍;封闭液(1×PBS中添加10﹪羊血清NGS,0.2﹪ TritonX-100)室温封闭1 h;封闭液1:200稀释TUJ1抗体(一抗),37℃孵育2 h,PBS洗3遍;加入荧光标记二抗37℃孵育1 h,PBS洗3遍;Hoechst(1:10 000)染核5 min,NIKON Ti荧光显微镜观察分析。
结 果
一、DPSC分离与培养
将牙髓组织剪碎成小组织块后培养,在2~3周开始有DPSC从组织块中爬出贴壁生长。细胞大多数呈长梭形,成纤维细胞样,体积较小,1~2个突起,少数为多角形、纺锤状或椭圆形。传代细胞2 h开始贴壁,传代后生长良好,约1周达到90﹪汇合。平均5 d 可传代1次。已传20代,细胞生长未见明显减缓(图1)。
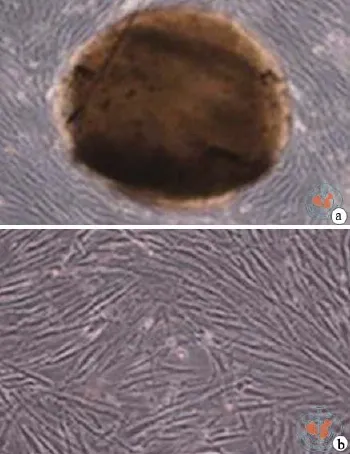
图1 相差显微镜下观察牙髓干细胞形态
二、DPSC流式细胞分析
本研究将分离培养的DPSC培养扩增后,用标记的流式抗体检测DPSC表面标志物的表达。结果发现,本研究分离的DPSC分别表达MSC标志物CD73、CD90,但不表达造血干细胞标志物CD34。并且发现DPSC与其他MSC如BMSC、脐带间充质干细胞表达相似的表面标志物(图2)。
三、DPSC的成骨细胞诱导分化
本研究将分离的DPSC在成骨诱导分化条件下培养2~3周后,经茜素红染色发现部分DPSC转化为成骨细胞,但成骨细胞的转化率仅为20﹪(图3)。
四、DPSC的成脂分化诱导
为了检测分离的DPSC能够分化成脂肪细胞,本研究将DPSC进行了成脂分化的诱导,成脂分化诱导2~3周的DPSC用油红O染色,发现DPSC能够有效地分化成脂肪细胞,大部分细胞内都含有脂滴聚集(图4)。
五、DPSC定向诱导神经分化。
为研究DPSC在体外能否向神经细胞谱系分化,并表达神经标志物包括细胞骨架蛋白(TUJ1),和神经元特异性蛋白(NeuN)等,按照实验室建立三阶段诱导分化方法,将DPSC进行神经元定向诱导分化发现12~14 d细胞形态发生改变,形成聚集的细胞团落并呈放射状分布,经诱导分化21 d后能形成神经元并表达神经细胞标志物TUJ1(图5)。
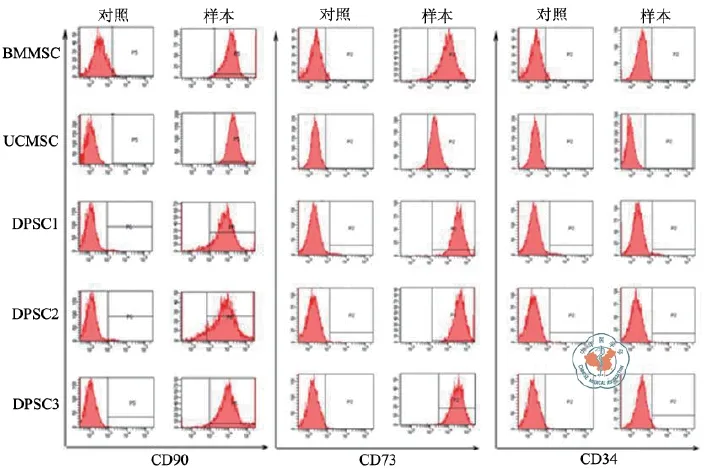
图2 牙髓干细胞流式细胞鉴定
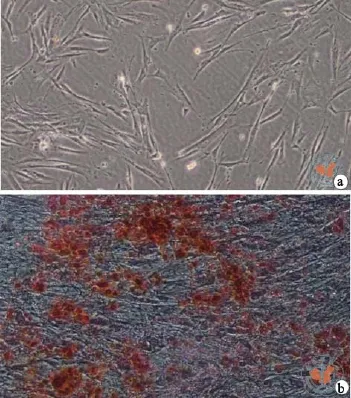
图3 相差显微镜下观察牙髓干细胞成骨分化后情况(茜素红染色×100)

图4 相差显微镜下观察牙髓干细胞成脂分化后油红O染色情况
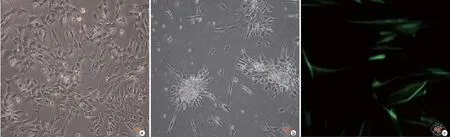
图5 相差及荧光显微镜下观察牙髓干细胞成神经定向分化(× 100)
讨 论
干细胞是具有自我更新和多向分化能力的细胞。DPSC来源于人牙髓组织,最早由Gronthos在2000年从人体牙髓中培养获得[6]。随后的研究发现,在脱落的乳牙(exfoliated human deciduous teeth)、牙根尖乳头(apical papilla)、牙周膜(periodontal ligament)等组织中也获得了能够稳定传代的DPSC[16-18]。DPSC具有MSC形态,能够表达MSC的多种特异标志物STRO-1、CD73、CD90、CD105、OCT4、Nanog等[19-23],且在体外能够诱导分化成骨细胞、神经细胞、血管内皮细胞、脂肪细胞等,表明DPSC具有多向分化能力,可以作为骨组织、软组织及神经缺损修复的干细胞来源[24]。
本研究利用牙髓组织块培养法成功培养出3株DPSC,并进行了生物学鉴定,结果表明3株DPSC与BMSC及脐带间充质干细胞表达相似的表面标志物CD90、CD73,但不表达造血干细胞标志物CD34。分离的3株DPSC表达CD90、CD73的百分率都在90﹪以上,但稍有差异,提示不同DPSC在其分化功能方面可能有所差异。
为进一步鉴定分离的DPSC的多向分化能力,本研究进行了成骨、成脂、成神经分化及鉴定。茜素红染色表明DPSC能够分化成骨细胞,细胞表面有一定的钙沉积。油红O染色可见成脂诱导后的大部分细胞内都有大量脂滴形成。免疫荧光染色表明成神经诱导后的部分细胞表达神经元标记物TUJ1。证实本研究分离到的DPSC具有成骨、成脂和成神经分化能力,可以作为骨、软组织、神经修复的干细胞来源。虽然我们分离的DPSC具有成骨成神经分化能力,但是DPSC是否能分化成不同的特异神经元,以及成骨、成神经分化效率还需要进一步优化,以便用于神经系统疾病帕金森氏病、脊髓损伤的干细胞治疗,和外伤及肿瘤等造成的下颌骨缺损修复等临床研究打下基础。
1 邱蔚六,张震康,张志愿.口腔颌面外科学[M].北京:人民卫生出版社,2008:494-498.
2 张陈平,萨曼.下颌骨重建的基础与临床[M].上海:上海教育出版社,2009:9-27.
3 Morishita T,Honoki K,Ohgushi H,et al.Tissue engineering approach to the treatment of bone tumors: three cases of cultured bone grafts derived from patients' mesenchymal stem cells[J].Artif Organs,2006,30(2):115-118.
4 Healy KE,Guldberg RE.Bone tissue engineering[J].J Musculoskelet Neuronal Interact,2007,7(4):328-330.
5 Meijer GJ,de Bruijn JD,Koole R,et al.Cell-based bone tissue engineering[J].PLoS Med,2007,4(2):e9.
6 Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells (DPSCs) in vitro andin vivo[J].Proc Natl Acad Sci U S A,2000,97(25):13625-13630.
7 Zhang W,Walboomers XF,Van Kuppevelt TH,et al.In vivoevaluation of human dental pulp stem cells differentiated towards multiple lineages[J].J Tissue Eng Regen Med,2008,2(2-3):117-125.
8 Huang GT,Gronthos S,Shi S.Mesenchymal stem cells derived from dental tissues vs.those from other sources:their biology and role in regenerative medicine[J].J Dent Res,2009,88(9):792-806.
9 Koyama N,Okubo Y,Nakao K,et al.Evaluation of pluripotency in human dental pulp cells[J].J Oral Maxillofac Surg,2009,67(3):501-506.
10 Riccio M,Resca E,Maraldi T,et al.Human dental pulp stem cells produce mineralized matrix in 2D and 3D cultures[J].Eur J Histochem,2010,54(4):e46.
11 Spath L,Rotilio V,Alessandrini M,et al.Explant-derived human dental pulp stem cells enhance differentiation and proliferation potentials[J].J Cell Mol Med,2010,14(6B): 1635-1644.
12 Graziano A,d'Aquino R,Laino G,et al.Human CD34+stem cells produce bone nodulesin vivo[J].Cell Prolif,2008,41(1):1-11.
13 d'Aquino R,De Rosa A,Lanza V,et al.Human mandible bone defect repair by the grafting of dental pulp stem/ progenitor cells and collagen sponge biocomplexes[J].Eur Cell Mater,2009,18:75-83.
14 Khoo ML,Tao H,Meedeniya AC,et al.Transplantation of neuronal-primed human bone marrow mesenchymal stem cells in hemiparkinsonian rodents[J].PLoS One,2011,6(5): e19025.
15 Kim HJ,McMillan E,Han F,et al.Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1[J].Stem Cells,2009,27(2):390-398.
16 Handa K,Saito M,Tsunoda A,et al.Progenitor cells from dental follicle are able to form cementum matrix in vivo[J].Connect Tissue Res,2002,43(2-3):406-408.
17 Hasegawa M,Yamato M,Kikuchi A,et al.Human periodontal ligament cell sheets can regenerate periodontal ligament tissue in an athymic rat model[J].Tissue Eng,2005,11(3-4):469-478.
18 Huang GT,Sonoyama W,Liu Y,et al.The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering[J].J Endod,2008,34(6):645-651.
19 Chen S,Santos L,Wu Y,et al.Altered gene expression in human cleidocranial dysplasia dental pulp cells[J].Arch Oral Biol,2005,50(2):227-236.
20 Gronthos S,Brahim J,Li W,et al.Stem cell properties of human dental pulp stem cells[J].J Dent Res,2002,81(8): 531-535.
21 Karaoz E,Demircan PC,Saglam O,et al.Human dental pulp stem cells demonstrate better neural and epithelial stem cell properties than bone marrow-derived mesenchymal stem cells[J].Histochem Cell Biol,2011,136(4):455-473.
22 Pavasant P,Yongchaitrakul T,Pattamapun K,et al.The synergistic effect of TGF-beta and 1,25-dihydroxyvitamin D3 on SPARC synthesis and alkaline phosphatase activity in human pulp fi broblasts[J].Arch Oral Biol,2003,48(10): 717-722.
23 Sakai K,Yamamoto A,Matsubara K,et al.Human dental pulp-derived stem cells promote locomotor recovery after complete transection of the rat spinal cord by multiple neuro-regenerative mechanisms[J].J Clin Invest,2012,122(1):80-90.
24 Hilkens P,Gervois P,Fanton Y,et al.Effect of isolation methodology on stem cell properties and multilineage differentiation potential of human dental pulp stem cells[J].Cell Tissue Res,2013,353(1):65-78.
Isolation and characterization of Human Dental Pulp Stem Cells
Zhang Nan*,Wang Wei,Chen Baoxin,Chen Chao,Jia Xin,Ding Yuxin,Zuo Xin,Deng Qinnan,Zhang Bin,Han Fabin.*Key Laboratory for Stem Cells and Regenerative Medicine,Liaocheng People's Hospital/The Affiliated Liaocheng Hospital,Taishan Medical University,Liaocheng 252000,China
Zhang Bin,Email:zhangbin2005@163.com; Han Fabin,Email: hanfabin2@gmail.com
ObjectiveTo explore the repairing ability of dental pulp stem cell (DPSC)in mandibular bone defects,soft tissue and neural injuries from oral tumors,trauma and periodontal diseases.MethodsDPSC were isolated from dental pulp tissues and induced to differentiate into osteogenic cells,adipose cells or neural cells which were identified by alizarin red staining,oil red O staining,or immunofluorescence respectively.CD antigen of DPSC was detected by flow cytometry.ResultsHuman DPSCs were isolated from the dental pulp tissues.Flow cytometry analysis indicated that DPSCs from three dental pulps expressed CD73 and CD90,but not CD34.Alizarin red,oil red O,or immunofluorescence staining indicated that DPSC were able to differentiate into osteogenic cells,adipose cells,and neural cells respectively.ConclusionDental pulp tissue is rich in DPSCs.DPSCs have the clinical potential to be used as stem cell sources for repairing bone defects and neural injuries.
Dental pulp;Stem cell;Flow Cytometry;Fluorescent antibody technique;Cell differentiation
2013-12-18)
(本文编辑:李少婷)
10.3877/cma.j.issn.2095-1221.2014.03.006
山东省博士后创新基金(201303025)
252000 聊城,泰山医学院聊城临床学院 聊城市人民医院干细胞与再生医学重点实验室(张男、王伟、陈超、张彬、韩发彬),口腔颌面实验室(陈保兴);脑科医院实验室(贾昕、丁宇欣、左鑫);Dr.Samuel QN.Deng Dental Clinic(邓琴南)
张彬,Email:zhangbin2005@163.com;韩发彬,Email :hanfabin2@gmail.com
张男,王伟,陈保兴,等.人体牙髓干细胞的分离与鉴定[J/CD].中华细胞与干细胞杂志:电子版,2014,4(3):183-188.
