静电共纺聚合物聚己内酯-碳酸亚乙酯和血管内皮生长因子共混纳米纤维支架的体外细胞相容性研究
2014-05-05张婉张祥满史振宇虞奋
张婉 张祥满 史振宇 虞奋
静电共纺聚合物聚己内酯-碳酸亚乙酯和血管内皮生长因子共混纳米纤维支架的体外细胞相容性研究
张婉 张祥满 史振宇 虞奋
目的通过静电纺丝技术将聚合物聚己内酯-碳酸亚乙酯[Poly(EC-CL)]和血管内皮生长因子(VEGF)为原料构建具有良好细胞相容性和机械性能的纳米支架。方法将VEGF与Poly(EC-CL)混合,配置成质量比为0 ng/g,10 ng/g,100 ng/g,1 μg/g的溶液,电压15 kV,流速2 ml/h电纺纳米纤维支架。扫描电镜检测电纺膜纳米形态,体外培养人脐静脉内皮细胞,细胞增殖试验及Live/Dead细胞试验检测电纺膜的生物相容性。各组电纺纤维直径比较以及细胞增殖MTS试验的(A)值比较均采用t检验。结果混合VEGF的poly(EC-CL)与纯poly(EC-CL)聚合物膜片相比,纤维形态没有分别,纳米纤维直径在(440±55) nm,本研究增加VEGF含量,纤维直径没有明显变化(P> 0.05)。细胞增殖试验显示到培养第5 天时,细胞增殖加快,组织培养板和VEGF/poly(EC-CL)(100 ng/g、1 μg/g)组明显高于poly(EC-CL)和VEGF/poly(EC-CL)(10 ng/g)(P< 0.05)。Live/Dead细胞试验显示四组膜片上,细胞均呈绿色荧光(活细胞),而且VEGF/ poly(EC-CL)(100 ng/g、1 μg/g)膜片上细胞明显高于poly(EC-CL)和VEGF/ poly(EC-CL)(10 ng/g)两组。结论电纺技术构建的Poly(EC-CL)/VEGF共聚物具有良好的血管内皮细胞相容性,能够作为血管组织工程的基质材料。
内皮细胞;血管内皮生长因子;纳米技术;相容性
目前组织工程支架的构建常见的方法有微包囊法[1-2]、光刻法[3-4]、静电纺丝法、激光消融法[5]、气体发泡发[6],在这些方法中,静电纺丝技术拥有更好的纳米三维结构,可以更好模拟细胞外基质结构,有利于细胞黏附生长。
聚己内酯(polycaprolactone,PEL)是应用于组织工程的人工合成可降解材料的一种,具有良好生物相容性和生物降解性,具有超低的玻璃化温度(- 62℃)和熔点(57℃),更重要的是PCL是为数不多的获得美国FDA批准可植入人体内的材料[7]。但其缺点在于可供修饰的化学官能团较少,因此需要通过表面修饰或者与其他材料共聚来改善再修饰的能力[8]。聚碳酸亚乙酯(poly(ethylene carbonate),PEC)是一种具有良好生物相容性并有特殊降解机理的亲水性高分子。本研究在室温下,通过利用镧系稀土元素作为催化剂[9-13],合成CL和EC的共聚物,从而发挥PCL和聚碳酸酯各自的优点。
血管内皮生长因子(vascular endothelial growth factor,VEGF)在血管新生和修复内皮损伤中起着重要的作用,在刺激内皮细胞增殖和迁移中起着重要的作用[14-15]。本研究旨在通过静电纺技术将VEGF与Poly(EC-CL)聚合物混纺,制备一种具备生物活性的可降解组织工程支架。VEGF在组织工程支架上可以得到缓慢释放,促进内皮细胞生长。
材料和方法
一、材料
主要的实验材料和试剂:碳酸亚乙酯(EC)CP试剂,ε-己内酯(CL)(Across公司),六氟异丙醇(上海誉美化工有限公司),DMEM培养液(Gibco公司),M199培养液(Gibco公司),鼠抗人VWF单克隆抗体(Abcam公司),VEGF(Peprotech公司),MTS试剂盒(Promega Products)(美国Promega公司),LDH试剂盒(Promega Products)(美国Promega公司),M199培养基(Gibco公司),静电纺丝机器(Ktao Tech公司),扫描电镜(Stereoscan360)(Cambridge公司)。
二、方法
(一)聚合物的合成
室温(25℃),将CL和EC置于在氩气保护的安瓿中,在Nd(DBMP)3催化下,加入不同反应单体比例的共聚单体EC和CL([CL]+[EC]= 1.0 mol/L,[Nd(DBMP)3]= 1.0×10-3mol/L),反应时间6 h。终止剂和沉淀剂为含5﹪ HCl的乙醇溶液,过滤聚合物用乙醇洗3次,真空干燥至恒重。
(二)电纺膜片的制备
将VEGF溶解在500 μl M199培养基中。在磨口容量瓶中加入Poly(EC-CL)EC/CL 1∶6及六氟异丙醇(HFIP)配制成浓度为10﹪的Poly(EC-CL)。混合上述两种溶液混合配制成VEGF/ Poly(EC-CL)质量比为0 ng/g、10 ng/g、100 ng/g、1 μg/g。用20 ml医用注射器吸取配制好的聚合物溶液,将注射器放置于电纺机内,注射器末端接上18 G不锈钢平针头作为电纺喷头,电纺电压设定为15 kV,金属圆筒转速为500 rpm/min,电纺流速为2 ml/h,注射器横移速度为10 cm/min。电纺结束后,获得电纺膜并放入干燥器内干燥备用。
(三)电纺膜纤维结构与表征
扫 描 电 镜(scanning electron microscope,SEM)用来观察电纺膜表面形态。随机在电镜照片中取40根纤维测定直径后计算电纺膜中纤维的平均直径。免疫荧光检测电纺膜中的VEGF:将电纺膜放置于96孔板,加入50 μl小鼠抗人VEGF抗体-FITC,4度过夜。第2天荧光显微镜下观察。
(四)人脐静脉内皮细胞的培养
在无菌条件下取健康新生儿脐带,PBS冲洗脐带,置入37℃ 5﹪ CO2培养箱孵育15 min。冲出消化液后收集液体,离心后弃上清,加入新鲜M199培养基(10﹪ FBS)重悬细胞,将细胞悬液以1×105/ml接种于细胞培养瓶内。每3 d换1次培养液,待细胞80﹪融合后,即传代。
(五)膜片准备和细胞试验
将四组Poly(EC-CL)电纺膜片铺至于96孔培养板内,每组至少3复孔。种植内皮细胞,每孔5×103个细胞,37℃,5﹪ CO2培养箱内培养7 d,每3 d换液。
1.细胞增殖MTS试验:分别在1、3、5、7 d加入MTS溶液20 μl孵育3 h。吸取试验孔上清液100 μl至另一空白96孔板,选用波长490 nm酶标仪测定(A)值。阴性对照为组织培养板内正常生长的内皮细胞。
2.Live/Dead 细胞试剂盒检测试验:用Live/Dead 细胞试剂盒检测细胞活力,分别在1、5、7 d,取出膜片,PBS清洗,室温下加入含1 μmol/L calc ein AM和4 μmol/L ethidium-1的溶液中孵育30 min。荧光显微镜下观察实验结果,其中死细胞染红色,活细胞染绿色荧光。
(六)统计学分析方法
应用SPSS19.0统计软件进行统计分析。所有计量数据均以表示,各组电纺纤维直径比较以及细胞增殖MTS试验的(A)值比较均采用t检验,以P< 0.05为差异有统计学意义。
结 果
一、电纺膜表面形态
电纺后,电纺膜片表面平整光滑,呈白色。通过图1是SEM观察电纺膜表面形态图,由图可见,混合VEGF的poly(EC-CL)与纯poly(ECCL)聚合物膜片相比,纤维形态没有分别,纳米纤维直径在(440±55)nm,笔者增加VEGF含量,纤维直径没有明显变化(P> 0.05)。从图2中可见,随着VEGF含量的升高,从0 ng/g~1 μg/g,荧光强度也逐渐增强。因此可以认定,VEGF可以和poly(EC-CL)聚合物结合,构成电纺膜片。

图1 扫描电镜SEM观察VEGF/poly(EC-CL)膜片显微结构(× 5000)

图2 荧光电镜观察VEGF/poly(EC-CL)膜片荧光检测(× 400)
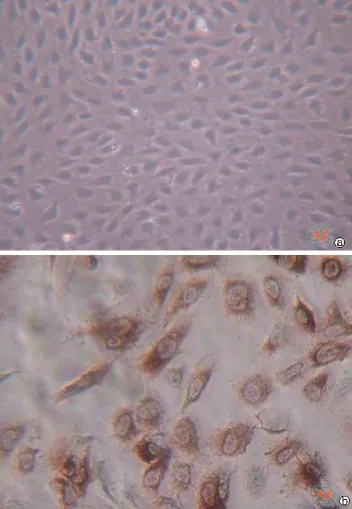
图3 显微镜下观察脐静脉内皮细胞培养鉴定
二、脐静脉内皮细胞的培养和鉴定
HUVECs在接种2 h后,开始贴壁,初始呈圆形,单个或聚成团,培养1 d后,细胞伸展呈长梭形,培养3 d时,出现多个细胞集落,培养10 d后,形成典型的铺路石装排列(图3a)。VWF因子相关抗体免疫组化染色HUVEC后,可见胞浆内有黄棕色颗粒,阳性率在94﹪±1.14﹪(图3b)。
三、MTS细胞增殖试验
WST试剂盒用来检测细胞在电纺膜片上增殖能力,从图4中可见,第3天时,细胞在poly(EC-CL)膜片和poly(EC-CL)/VEGF膜片上增殖变化不明显(P> 0.05),到培养第5天时,细胞增殖加快,组织培养板和VEGF/ poly(EC-CL)(100 ng/g、1 μg/g)组明显高于poly(EC-CL)和VEGF/ poly(EC-CL)(10 ng/g)(P< 0.05)。
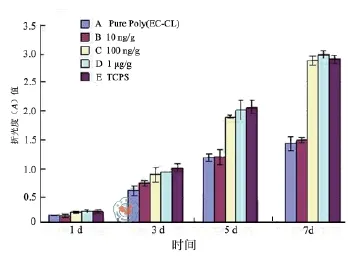
图4 WST-8试剂盒检测电纺支架Poly(EC-CL)/VEGF上HUVEC细胞增殖实验
四、细胞活力试验
图5表示poly(EC-CL)和VEGF/ poly(ECCL)上内皮细胞活力荧光显微镜检测结果。从图中可以看到,在第1天时,VEGF/ poly(EC-CL)(100 ng/g、1 μg/g)膜片上细胞多于poly(EC-CL)和VEGF/ poly(EC-CL)(10 ng/g)两组,到第7天时VEGF/ poly(EC-CL)(100 ng/g、1 μg/g)膜片上细胞明显高于poly(EC-CL)和VEGF/ poly(EC-CL)(10 ng/g)两组,这一结果也与MTS细胞增殖试验结果基本相符合。同时发现,四组膜片上,细胞均呈绿色荧光(活细胞),没有明显的死细胞出现(红色荧光),证明了膜片具备良好的生物相容性,并且加入VEGF后,在浓度大于100 ng/g时,对细胞生长增殖有明显促进作用。
讨 论
当前组织工程研究的重要领域之一是生物可降解材料[16],主要分为天然可降解材料和人工合成可降解材料,两者均具有细胞外基质的功能和作用,是保证组织形成的前提。生物可降解材料有以下性质[17]:良好的生物相容性,良好的生物降解性,具有多孔的三维立体结构,良好的可加工性以及良好的材料-细胞界面。但无论哪种材料都存在一定缺陷,无法同时满足上述要求。因此利用具有不同性质的材料构建复合生物可降解材料引起了人们广泛的研究。
目前为止,VEGF发现有VEGF-A、VEGF-B、VEGF-C、VEGF-D和VEGF-E五个亚型,其中VEGF165-A在刺激血管新生作用中被认为是最重要的[18]。VEGF通过与其酪氨酸激酶相关受体相结合[VEGFR-1(Flt-1,R1)、VEGFR-2(kdr/ Flk-1,R2)、VEGFR-3(Flt-4,R3)]发挥其生物学功能。VEGFR-2受体被认为是在血管新生中最重要的受体,它的激活是内皮细胞增殖和存活的重要原因。无数试验证明VEGF在血管新生中起了重要的作用。Ferrara和Henzel[15]最早发现加入VEGF后,HUVECs的生长速度比对照未加VEGF细胞快3倍。几乎同时,Connolly也发表了几乎同样的数据。1992年,Pepper等[14]发现在胶原上培养的牛内皮细胞,加入VEGF后,会诱导内皮细胞侵入胶原,形成毛细血管状3-D管腔结构。在体内试验中,VEGF可以刺激绒毛膜尿囊膜表面、大鼠和兔角膜血管新生[19]。有研究发现,混合VEGF基质胶中的血管平均密度要超出不含VEGF基质胶中血管密度10倍[20]。VEGF具有特异性促进内皮细胞(endothelial cell,EC)有丝分裂的作用,其受体仅限于EC膜上,作用为促EC有丝分裂;介导PDGF、TGFβ表达和分泌;增加血管通透性,引起血液外渗和细胞迁移;缺血,缺氧可使VEGF mRNA表达上调,促进血管再生。因此VEGF在组织工程血管再生的应用中,得到了越来越高的重视。
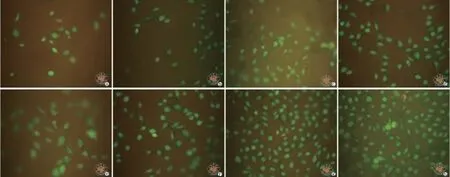
图5 活力荧光染色显微镜下观察VEFG/Poly(EC-CL)电纺膜上内皮细胞活力(× 200)
静电纺丝技术是近年来发展的可以制备与天然ECM相类似的结构和空间构象的新技术,具备高比表面积、高孔隙率和三维网络结构等特殊形貌,有利于细胞的黏附生长和增殖[21-23]。但常规可降解支架缺乏天然细胞外基质内特定的生物信号分子,无法通过特定的细胞通讯与信息传递系统对细胞的黏附,分化等生物学行为进行一步调控。因此,越来越多研究开始运用仿生学原理将生长因子等固定在人工基质材料表面,通过这些特定分子识别信号激发细胞间信号通路,调控细胞的增殖、黏附及分化。近期研究表明,将活性蛋白与聚合物混纺可购建有缓释效果的纳米纤维材料,活性蛋白可以持续释放2~8周时间[24-25]。
在上述思路指导下,通过静电纺丝技术将VEGF与Poly(EC-CL)聚合物相结合,构建了一个载VEGF的电纺生物可降解支架。由于电纺支架具备三维、多孔的纳米结构,且其表面积比较高,使得VEGF载药量高于一般组织工程载药,如表面涂抹,浸渍等方法。克服了常规药物绑定的缺点:药物释放不可控,药物释放不均匀,载药量有限,且药物不能达到长时间缓慢释放。本研究内容中,重点评价了Poly(EC-CL)和Poly(EC-CL)/VEGF的细胞相容性的试验研究。
通过本研究发现:通过分离、培养接种人脐静脉内皮细胞,通过MTS,Live/Dead死活细胞等试验证实Poly(EC-CL)和Poly(EC-CL)/VEGF都具有良好的细胞相容性,尤其当VEGF/ Poly(EC-CL)比值大于100 ng/g时,HUVECs在电纺膜上增殖速度明显加快。
综上所述Poly(EC-CL)与VEGF通过静电纺丝技术可以构建具备良好细胞相容性,良好力学性能的纳米纤维支架。VEGF可以促进内皮细胞在支架上的黏附和增殖,因此笔者认为Poly(EC-CL)/VEGF混合支架在血管组织工程上有着潜在的应用前景。
1 Whitesides GM.The origins and the future of micro fl uidics[J].Nature,2006,442(7101):368-373.
2 Sundararaghavan HG,Monteiro GA,Firestein BL,et al.Neurite growth in 3D collagen gels with gradients of mechanical properties[J].Biotechnol Bioeng,2009,102(2):632-643.
3 Hahn MS,Taite LJ,Moon JJ,et al.Photolithographic patterning of polyethylene glycol hydrogels[J].Biomaterials,2006,27(12):2519-2524.
4 Lee SH,Moon JJ,West JL.Three-dimensional micropatterning of bioactive hydrogels via two-photon laser scanning photolithography for guided 3D cell migration[J].Biomaterials,2008,29(20):2962-2968.
5 Park SH,Kim TG,Kim HC,et al.Development of dual scale scaffolds via direct polymer melt deposition and electrospinning for applications in tissue regeneration[J].Acta Biomater,2008,4(5):1198-1207.
6 Baker BM,Gee AO,Metter RB,et al.The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacri fi cial fi bers[J].Biomaterials,2008,29(15):2348-2358.
7 Rohner D,Hutmacher DW,See P,et al.Individually CAD CAM technique designed,bioresorbable 3-dimensional polycap 2 rolactone framework for experimental reconstruction of craniofacial defects in the pig[J].Mund Kiefer Gesichtschir,2002,6(3):162-167.
8 李峰,冯俊,卓仁禧,等.生物可降解聚碳酸酯研究进展[J].高分子材料科学与工程,2005(21):57-61.
9 Zhu GX,Ling J,Shen ZQ.Isothermal crystallization of random copolymers of-caprolactone with 2,2-dimethyltrimethylene carbonate[J].Polymer,2003,44(19):5827-5832.
10 Ling J,Shen ZQ,Zhu WP.Synthesis,characterization,and mechanism studies on novel rare-earth calixarene complexes initiating ring-opening polymerization of 2,2-dimethyl trimethylene carbonate[J].J Polym Sci Pol Chem,2003,41(9):1390-1399.
11 Ling J,Zhu WP,Shen ZQ.Controlling ring-opening copolymerization of ε-caprolactone with trimethylene carbonate by scan-diumtris(2,6-di-tert-butyl-4-methylphenolate)[J].Macromolecules,2004,37(3):758-763.
12 Zhu WP,Ling J,Xu H,et al.Copolymerization of trimethylene carbonate and 2,2-dimethyltrimethylene carbonate by rare earth calixarene complexes[J].Polymer,2005,46(19):8379-8385.
13 Ishida H,Lee Y.Study of hydrogen bonding and thermal properties of polybenzoxazine and poly(ecaprolactone) blends[J].J Polym Sci Part B Polym Phys,2001(39): 736-749.
14 Pepper MS,Ferrara N,Orci L,et al.Potent synergism betweenvascular endothelial growth factor and basic fibroblast growthfactor in the induction of angiogenesisin vitro[J].Biochem Biophys Res Commun,1992,189(2):824-831.
15 Ferrara N,Henzel WJ.Pituitary follicular cells secrete a novelheparin-binding growth factor specific for vascular endothelialcells[J].Biochem Biophys Res Commun,2012,425(3):540-547.
16 Grande DA,Halberstadt C,Naughton G,et al.Evaluation of matrix scaffolds for tissue engineering of articular cartilage grafts[J].J Biomed Mater Res,1997,34(2):211-220.
17 Simpson DG,Bowlin GL.Tissue-engineering scaffolds: can we re-engineermother nature[J].Expert Rev Med Devices,2006,3(1): 9-15.
18 Zakarija A,Soff G.Update on angiogenesis inhibitors[J].Curr Opin Oncol,2005,17(6):578-583.
19 Woltering EA,Lewis JM,Maxwell PJ 4th,et al.Development of a novel in vitro human tissue-based angiogenesis assay to evaluate the effect of antiangiogenic drugs[J].Ann Surg,2003,237(6):790-798.
20 Leung DW,Cachianes G,Kuang WJ,et al.Vascular endothelial growth factor is a secreted angiogenic mitogen[J].Science,1989,246(4935):1306-1309.
21 Phillips GD,Stone AM,Jones BD,et al.Vascular endothelial growth factor (rhVEGF165) stimulates direct angiogenesis in the rabbit cornea[J].In Vivo,1994,8(6):961-965.
22 Montrucchio G,Lupia E,Battaglia E,et al.Plateletactivating factor enhances vascular endothelial growth factor-induced endothelial cell motility and neoangiogenesis in a murine matrigel model[J].Arterioscler Thromb Vasc Biol,2000(20):80-88.
23 Srouji S,Kizhner T,Suss-Tobi E,et al.3-D Nanofibrouselectrospunmutilayered construct is an alternative ECM mimicking scaffold[J].J Mater Sci Mater Med,2008,19(3):1249-1255.
24 Wang S,Zhang Y,Wang H,et al.Fabrication and properties of the electrospun polylactide/silk fi broin-gelatin composite tubular scaffold[J].Biomacromolecules,2009,10(8):2240-2244.
25 Neal RA,McClugage SG,Link MC,et al.Lamininnano fi ber meshes that mimic morphological properties and bioactivity of basement membranes[J].Tissue Eng Part C Methods,2009,15(1):11-21.
Cellular compatibility of electrospun copolymer nanofibrous scaffolds composed of ethylenecarbonate-ε-caprolactone and vascular endothelial growth factor
Zhang Wan*,Zhang Xiangman,Shi Zhenyu,Yu Fen.*Institute of Vascular Surgery,Huadong Hospital,Fudan University,Shanghai 200040,China
Shi Zhenyu,Email:maxshizhenyu@163.com
ObjectiveTo prepare a novel degradable nanofibrous scaffolds with copolymer ethylenecarbonate-ε-caprolactone (Poly(EC-CL)) and vascular endothelial growth factor by electrospinning,and to test the biological compatibility and mechanical properties of the blended scaffolds.MethodsVascular endothelial growth factor(VEGF)was dissolved in 500 ul of M199 medium,and Poly(EC-CL) was dissolved in 1,1,1,2,2,2,-hexafluoro-2-propanol(HFIP) at a concentration of 10﹪(w/v) for electrospinning.We mixed both solutions at a ratio of 1 μg/g,100 ng/g,10 ng/g,0 ng/g (VEGF/poly(EC-CL),wt﹪/wt﹪) respectively.The electrospinning process was performed at 15kV voltage with 15 cm distance between the needle tip and a rotating mandrel.The flow rate was 2mL/h.Scanning electron microscopy (SEM) was used to measure the fiber diameter distribution.The composition of fibrous membranes was analyzed by immunofluorescence.The cell proliferation and the biological compatibility weretest by Live/Dead cells kit assay.ResultsThe average diameter of these scaffolds was estimated to be (440±55)nm.We increased the percentage of VEGF /poly(EC-CL) from 10 ng/g to 1 μg/ g(w﹪:w﹪).The diameters of the scaffolds were not changed with the increase of VEGF,and there were no significant difference between the pure poly(EC-CL) and blended VEGF/poly(ECCL)(P> 0.05).Analysis of cell proliferation and Live/Dead cells confirmed that Poly (ECCL) / VEGF films possessed excellent cell compatibility.ConclusionPoly (EC-CL) / VEGF copolymer has good cell compatibility with the endothelial cells.It can be used as scaffold for vascular engineering.
Endothelial;Vascular endothelial growth factor;Nanotechnology;Compatibility
2013-12-18)
(本文编辑:蔡晓珍)
10.3877/cma.j.issn.2095-1221.2014.03.003
国家自然科学基金面上项目(81370424)
复旦大学附属华东医院血管外科(张婉);复旦大学附属中山医院血管外科(张祥满、史振宇、虞奋)
史振宇,Email:maxshizhenyu@163.com
张婉,张祥满,史振宇,等.静电共纺聚合物聚己内酯-碳酸亚乙酯和血管内皮生长因子共混纳米纤维支架的体外细胞相容性研究[J/CD].中华细胞与干细胞杂志:电子版,2014,4(3):158-164.
