甘蔗醋高产菌株的筛选及鉴定
2014-03-22,,,,
, ,,,
(1.广东轻工职业技术学院,广州 510300;2.五华县溢群酒业有限公司,梅州 514400;3.广州甘蔗糖业研究所,广州 510316)
近年来,食醋酿造朝着原料多样化、产品功能化及多元化的趋势发展[1]。果醋具有特殊风味以及保健功效[2-3],逐渐占有食醋市场的重要份额。酿醋菌种是酿醋工业的关键因素,直接影响到生产成本和产品品质,国内外研究者在酿醋菌种选育方面已积累了丰富成果,例如,沪酿1.01和中科AS1.41是我国食醋工业应用已久的主要菌种[4-7]。然而,由于果醋原料繁多,果醋风味和酿造工艺等方面可能对酿醋菌种有更高的要求,促使了一些研究者对果醋菌种开展选育工作[8-10]。
与其它果醋酿造原料相比,甘蔗具有资源丰富、风味独特、富含糖分及其它营养成分等优点,是酿醋的良好原料。国内研究人员已开展了一些关于甘蔗醋发酵工艺的研究,但仍没有甘蔗醋酿造菌种筛选的报道。本实验以自然发酵的甘蔗渣为筛选材料,对酿醋的高产菌株进行筛选与鉴定,为甘蔗醋酿造提供优良的菌种资源。
1 材料与方法
1.1 材料与仪器
自然发酵的甘蔗渣和甘蔗汁 五华县酒业有限公司;酿酒酵母(Saccharomycescerevisiae)CICC31143 中国工业微生物菌种保藏管理中心;DNA提取试剂盒、16S rDNA的扩增引物以及PCR扩增试剂等 深圳华大基因科技服务公司;其它试剂 均为市售;富集培养基[11]葡萄糖10g/L,酵母膏10g/L,KH2PO42g/L,MgSO40.5g/L,调节pH5.0,121℃灭菌20min,冷却至70℃加入3%无水乙醇;分离平板培养基[12]在富集培养基的组成基础上,另加入琼脂20g/L和CaCO320g/L;CaCO3需预先进行干热灭菌(160℃、30min),与无水乙醇同时添加,尽量使之在培养基中均匀分布;斜面保藏培养基[12]组成同分离平板培养基。
SHZ-82A型恒温水浴振荡器 江苏省太仓医疗器械厂;KDC-210HR高速冷冻离心机 安徽中科中佳科学仪器有限公司;LC-10AD高效液相色谱仪 日本岛津公司;A200基因扩增仪 杭州朗基科学仪器有限公司;RDY-SP1Z核酸电泳仪 北京荣阳经典科技有限公司;GI-1凝胶成像系统 通宝达成科技(北京)有限公司;S-3000N扫描电镜 日本日立公司。
1.2 菌株富集培养及分离纯化
将10g自然发酵的甘蔗渣加入100mL富集培养基中,置于30℃、150r/min的条件下进行振荡培养24h;然后,吸取10mL培养液转接入90mL新鲜的富集培养基,于相同条件下培养。如此转接2次后,将培养液稀释涂布在分离平板培养基上,于30℃培养48h,用竹签挑取周围具有较大的、透明圈清晰的菌落,接入斜面保藏培养基,经培养24h,置于4℃保藏,备用。
1.3 产酸发酵筛选
参照文献提供的方法[13],配制产酸发酵培养基。用蔗糖调节甘蔗汁糖度至160g/L,接入酿酒酵母CICC31143,置于30℃发酵至酒精度不再上升(残留还原糖2.0g/L以下),用无菌水调节酒精度至6%(v/v),加入无菌的酵母膏5g/L,并用无菌的NaOH溶液调节pH5.0,即得产酸发酵培养基。
将从分离平板挑取所得菌株的斜面菌种接入富集培养基,置于30℃、150r/min的条件下振荡培养24h,作为种子液。按10%的接种量,将种子液接入产酸发酵培养基,于30℃、150r/min下进行发酵,至醋酸浓度不上升时结束。检测发酵液的醋酸含量,根据产酸量筛选优良菌株。
1.4 耐酒精特性筛选
采用无水乙醇或无菌水调节产酸发酵培养基的酒精至不同浓度,分别接入10%的种子液,于30℃、150r/min下进行发酵,至醋酸浓度不上升时结束。检测发酵液的醋酸含量,计算酒精转化率,根据酒精转化率筛选优良菌株。酒精转化率的计算如下式:
酒精转化率(%)=发酵液中醋酸含量(g/L)/发酵液中初始酒精含量(g/L)×100
1.5 传代稳定性筛选
将上述筛选所得优良菌株的斜面菌种转接至新鲜斜面,置于30℃培养24h,再置于4℃保藏2周,然后进行第二次转接及保藏,如此转接10次。同时,每次转接的斜面菌种都用于产酸试验。检测发酵液的醋酸含量,比较各菌株的传代稳定性,从而优选菌株。
1.6 优选菌株的鉴定
参照文献的革兰氏染色显微镜观察法和扫描电镜观察法[14],鉴定菌种形态特征;参照文献提供的方法[15-16],鉴定菌种的生理生化特征;参照文献提供的16S rDNA鉴定方法[17],鉴定菌种的同源性。
在16S rDNA鉴定中,引物1和引物2分别采用5′-AGAGTTTGATCCTGGCTCAG-3′和5′-AGAAAGGAGGTGATCCAGCC-3′;反应体系(50μL)为:10×Taq buffer 5.0μL,dNTP 1.0μL,模板 1.0μL,引物1和引物2各1.0μL,Taq酶0.5μL,ddH2O 39.5μL;PCR反应条件为:95℃预变性3min;95℃变性30s,55℃退火60s,72℃延伸60s,30个循环;72℃延伸5min,4℃保存。PCR产物经琼脂凝胶电泳后,送至深圳华大基因科技服务公司测序,将获得的序列在GenBank中进行同源性检索,并采用MEGA5.1软件以Neighbor-joining法构建系统发育树。
1.7 测定方法
采用Lane-Eynon法[18],测定还原糖含量;按国家标准GB/T10345-2007,采用蒸馏法和酒精计法的结合方法[19],测定乙醇含量;采用高效液相色谱法[20-21],测定发酵液中的醋酸含量,其测定条件为:日本岛津高效液相色谱仪LC-10AD,色谱柱Hypersil C18(4.6mm×150mm,5μm),移动相为0.002mol/L的硫酸溶液,流速为1.0mL/min,进样10μL,检测波长210nm。
在样品检测前,预先精密配制0.05、0.10、0.15、0.20、0.30、0.40、0.50g/L的乙酸标准溶液,经0.22μm滤膜过滤,按上述条件进行测定,采用外标法,以标准溶液的乙酸含量(x)和峰面积(y)绘制标准曲线,发酵液经10000r/min离心20min,取清液,经适当稀释以及0.22μm滤膜过滤,按上述条件进行测定,再根据标准曲线方程计算醋酸含量。
2 结果与分析
2.1 产酸发酵筛选
本实验高效液相色谱法所用标准曲线方程:y=32784.12x+648.36(相关系数R2=0.9996),其中x为标准溶液的乙酸含量,y为峰面积。从分离平板上挑取到116株菌株,经过产酸发酵试验,其中产酸量居前列的10株菌的发酵结果如图1所示。由图1看出,10株菌产酸量分布在32.8~41.8g/L的范围内,产酸量的排序为:C22>C63>C34>C08>C75>C20>C16>C78>C03>C41。其中,菌株C22、C63、C34和C08的产酸量均超过40g/L,其中菌株C22的醋酸产量达41.8g/L,故以上菌株均优选为进一步筛选的对象。
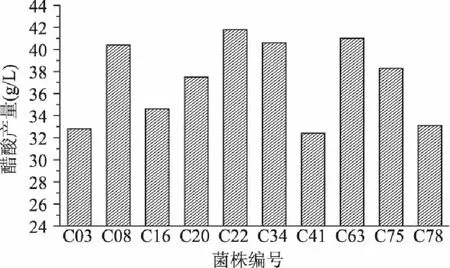
图1 10株菌的产酸发酵结果 Fig.1 Acetic acid production of 10 strains
2.2 耐酒精性筛选
在不同起始酒精度的培养基中,菌株C22、C63、C34和C08的酒精转化率如图2所示。由图2看出,起始酒精度对醋酸菌的发酵作用有一定的影响,随起始酒精度的增加,4株菌的酒精转化率均呈下降趋势。各个酒精度下的酒精转化率可以反映出菌株的耐酒精特性,尤其在较高酒精度的条件下,各菌株的酒精转化率表现出较明显的差距。结果表明,4株菌耐酒精性的排序为:C22>C34>C63>C08。其中,菌株C22在起始酒精度12%(v/v)下仍具有较强的发酵作用,其醋酸产量为62.2g/L,转化率达65.7%。

图2 不同酒精度下的酒精转化率 Fig.2 Result of alcohol conversion rate on different ethanol degree
2.3 传代稳定性筛选
经过10次传代,4株菌在起始酒精度6%(v/v)的培养基中的发酵结果如图3所示。菌株C22、C63、C34和C08产酸的波动范围分别为:40.6~42.4g/L、39.5~41.2g/L、39.4~41.0g/L和39.2~40.8g/L,10次传代的产酸水平差距不大,表明各菌株具有良好的传代稳定性。同时,在各次传代过程中,菌株C22产酸能力居于首位,故被确认为最终优选的菌株。
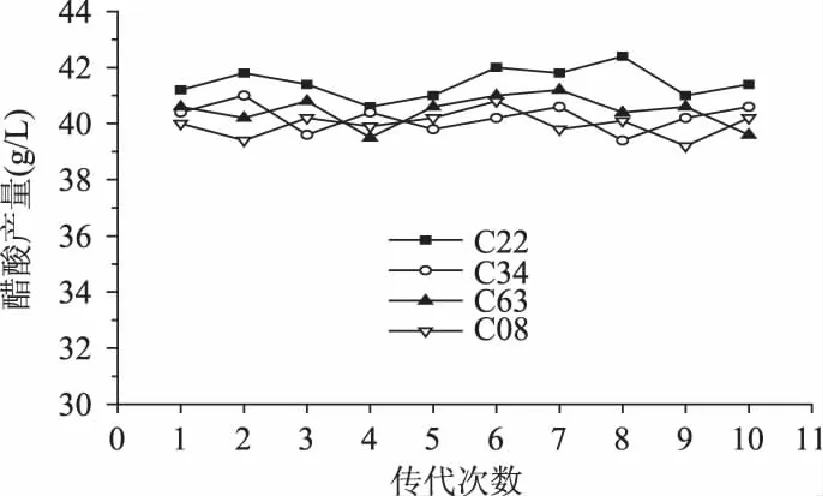
图3 不同传代次数的醋酸产量 Fig.3 Acetic acid production of different passage times
2.4 优选菌株的鉴定
菌株C22的普通显微镜照片(16×100倍)和扫描电镜照片(×12000倍)分别如图4和图5所示。菌体经革兰氏染色呈阴性反应,形态呈短杆状、单个或成对排列,菌体大小为(0.6~0.8)μm ×(1.6~2.0)μm。菌株C22的生理生化特征试验结果见表1,根据《伯杰细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》的描述,初步鉴定菌株C22为醋酸杆菌属菌种。

图4 菌株C22在普通显微镜下的菌体形态 Fig.4 Cell morphology of strain C22 under ordinary microscope
菌株C22的16S rDNA的PCR扩增产物大小为1395bp,将此序列在GenBank数据库中检索以及进行BLAST比对,发现该序列与许多巴氏醋酸杆菌(Acetobacterpasteurium)的16S rDNA序列的同源性达到100%,采用Neighbor-joining法构建系统发育树,如图6所示,其中菌株C22与巴氏醋酸杆菌(登录号:AB753861)的亲缘关系最接近。将菌株C22的形态、生理生化等特征与16S rDNA鉴定结果结合起来,可最终确定菌株C22为巴氏醋酸杆菌(Acetobacterpasteurium)。
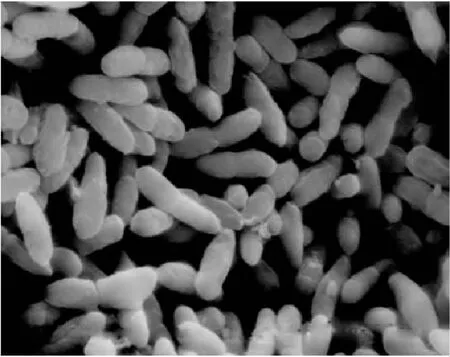
图5 菌株C22在扫描电镜下的菌体形态 Fig.5 Cell morphology of strain C22 under scanning electron microscope
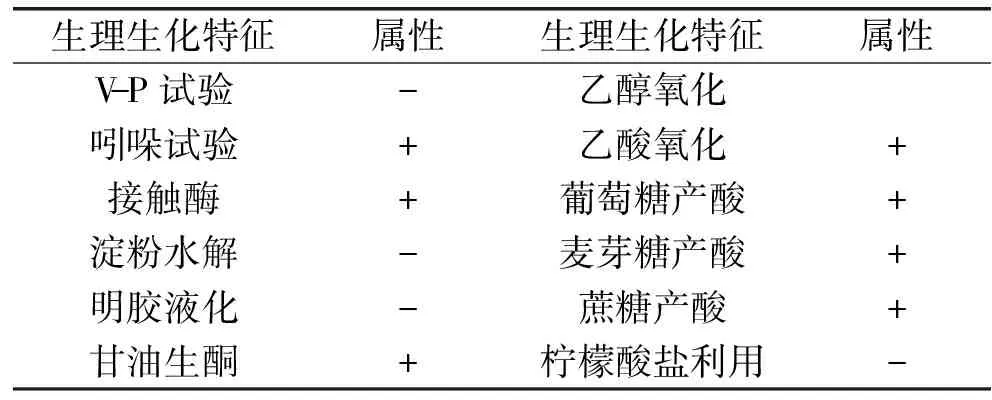
表1 生理生化试验结果Table 1 Physiological and biochemical characteristics of strain C22
3 结论
以自然发酵的甘蔗渣为筛选材料,采用分离平板、产酸试验、耐酒精性试验以及传代稳定性试验等方法,筛选获得具有产酸高、耐酒精性强、遗传稳定的菌株C22。菌株C22在12%(v/v)的酒精度下仍能够表现出较强的发酵作用,在起始酒精度为6%(v/v)和12%(v/v)的培养基中,菌株C22的醋酸产量分别为41.8g/L和62.2g/L。经过形态特征、生理生化特征以及16S rDNA等方面的分析,鉴定菌株C22为巴氏醋酸杆菌。为了使菌株C22在甘蔗醋或其它果醋的酿造领域得到应用,其发酵特性仍需进一步研究。

图6 菌株C22序列系统发育分析 Fig.6 Phylogenetic tree based on 16S rDNA sequences of strain C22
[1] 吴晓明,曹岚. 我国食醋行业发展现状及趋势[J]. 中国调味品,2012,37(9):19-21.
[2] 凌圣宝,向进乐,李志西,等. 拐枣醋饮加工工艺及其抗氧化活性分析[J]. 食品工业科技,2012,33(15):254-258.
[3] 王亚东,陈树俊,姜慧,等. 果醋的最新研究进展[J]. 农产品加工,2012,(7):67-71.
[4] 罗威,罗立新. 荔枝保健果醋酿造工艺研究[J]. 食品工业科技,2010,31(4):176-178.
[5] 邓红梅,周天,马超,等. 香蕉醋醋酸发酵工艺及其澄清效果的研究[J]. 食品工业科技,2012,33(22):316-319.
[6] 徐麟,李文慧,张大海,等. 杏皮渣酿制杏果醋工艺[J]. 食
品研究与开发,2010,31(11):79-81.
[7] 王毅,刘学文,伍学明. 柠檬果醋醋酸发酵工艺的研究[J].食品研究与开发,2011,32(1):75-78.
[8] 鲁海波,姚跃飞,伍伟青,等. 柑桔醋醋酸菌的筛选研究[J]. 中国酿造,2004,23(6):10-12.
[9] 曾利平,王芳. 优良果醋醋酸菌的选育[J]. 食品与发酵科技,2010,(4):61-62.
[10] 陈伟,陈义伦,马明,等. 选育优质醋酸菌酿造苹果醋[J].中国调味品,2003,28(3):13-16.
[11] 孙万里. 醋酸菌的分离纯化及初步鉴定[J]. 中国调味品,2011,36(12):72-75.
[12] 姜晓芝,李志西,杨甲平,等. 产酸菌株的分离及初步鉴定[J]. 中国酿造,2008,27(23):53-55.
[13] 方俊鹏,李静,邓毛程,等. 甘蔗汁风味醋醋酸摇瓶发酵条件的研究[J]. 广东轻工职业技术学院学报,2010,19(3):14-17.
[14] 诸葛健. 工业微生物实验与研究技术[M]. 北京:科学出版社,2007.
[15] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[16] R.E布坎南,N.E.吉本斯,等,中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组. 伯杰细菌鉴定手册(第八版)[S]. 北京:科学出版社,1984.
[17] 魏长庆,王海庆,张凌,等. 葡萄果醋发酵用醋酸菌的分离及鉴定[J]. 中国酿造,2010,29(4):42-44.
[18] 罗建成. 生物工业分析[M]. 北京:化学工业出版社,2009.
[19] 曹新志,刘芳,朱茜. 梨果酒酵母的筛选及发酵条件的研究[J]. 中国酿造,2010,29(5):102-105.
[20] 周萍,罗梁华,胡福良. 高效液相色谱法测定食醋及醋粉中的醋酸和乳酸[J]. 中国调味品,2008,33(7):84-86.
[21] 康春莉,王洋,于宏兵,等. 高效液相色谱法快速测定糠醛废水中的乙酸含量[J]. 吉林大学学报:自然科学版,2004,42(3):467-470.
