花椒麻味素剂量 对SD雌性大鼠肠道健康的影响
2014-03-22,,,
, ,,
(西南大学食品科学学院,重庆 400715)
花椒别名为川椒、红椒、蜀椒、大红袍。它具有温中散寒、杀虫、祛湿、止痛等功能。花椒中的主要化学成分有挥发油、生物碱、酰氨、木脂素、香豆素、黄酮类物质、脂肪酸[1-2]等,其它成分还有二萜、甾醇、烃类和黄酮甙类[3]等。花椒麻味素是花椒中重要的活性成分,是花椒呈麻味的主要成分,花椒麻味素在花椒中大多以链状不饱和脂肪酸酰胺的形式存在,在其他物质中则以带芳环的酰胺形式存在[4],所以又称花椒酰胺。花椒的麻味成分不仅具有麻醉、兴奋、抑菌、祛风除湿、杀虫和镇痛等功效,同时还具有抗血小板凝集、松弛胃体的环形肌和回肠纵向肌等有益健康的功能[5]。
肠道健康与人体健康关系密切,肠道健康又与肠道微生物紧密联系。正常人体大肠中含有约1013~1014个微生物,它们对维持肠道正常的生理功能具有重要作用。肠道微生物每天消耗约60~80g进入大肠的多糖、低聚糖、蛋白质、肽和糖蛋白等未消化残渣。糖类底物在肠道中发酵会产生短链脂肪酸(SCFAs)和气体(CO2,CH4,H2),SCFAs主要是乙酸、丙酸、丁酸,其次还有异丁酸[6]。含氮底物化合物发酵则产生游离氨、苯酚等有害产物。
目前国内外对花椒麻味素的研究集中于花椒的麻醉效果,而花椒麻味素对肠道健康的研究较少。本实验室前期研究了花椒精对肠道健康的影响,结果表明花椒精能促进肠道发酵,有益肠道健康。因为花椒精中含有32.18%的花椒麻味素,所以本实验进一步研究了花椒麻味素对肠道健康的影响情况。预测在食品,医药等方面会被广泛应用。
1 材料与方法
1.1 材料与仪器
SD雌性大鼠 动物许可证号:SCXK(渝)20070008,体重90~110g,40只,百森生物技术公司;花椒麻味素 实验室提取,纯度为95.7%;基础饲料 百森生物技术公司;巴豆酸(色谱级) 日本东京天成工业株式会社;氢氧化钠、苯酚、次氯酸钠、钨酸钠、硫酸 分析纯,成都市科龙化工试剂厂;乙酸(色谱级) 英国Johnson Matthey公司;丙酸(色谱级)、丁酸(色谱级)、异丁酸(色谱级) 梯希爱(上海)化成工业发展有限公司;亚硝基铁氰化钠(分析纯) 天津市光复精细化工研究所。
GC-2010高效气相色谱仪 日本岛津公司;pH计H18424 意大利HANNA公司;Spectrumlab 22可见光分光光度计 上海棱光技术有限公司;千分之一天平HZT-300-A 福州华志科学仪器公司。
1.2 动物饲养与样品采集
将购买的4周龄SD雌性大鼠40只放入不锈钢鼠笼中,每笼饲养1只大鼠,室温保持在(25±1)℃,12h明暗轮换(9:00~21:00)。喂食基础饲料(表1)一周使大鼠适应喂养环境后,按大鼠体重随机将大鼠分为空白组(LOD)、高脂组即高脂空白组(HF-LOD)、高脂并灌胃4mg/kg(HF-CD)、高脂并灌胃8mg/kg(HF-MD)、高脂并灌胃12mg/kg(HF-HD)花椒麻味素的大豆油溶液等共5组各8只。高脂组每天喂食高脂饲料并且每天15:00对高脂组灌喂花椒麻味素,花椒麻味素需溶于大豆油中配成溶液。灌胃剂量均为每100g体重0.1mL。所有实验大鼠实验期间自由摄食和饮水,每3d称量一次大鼠体重,同时需调整灌喂量,每天记录大鼠采食量。喂养4周后解剖,测定各批盲肠内容物重量、盲肠壁面积、游离氨、pH和短链脂肪酸(short-chain fatty acid,SCFAS)和微生物。
1.3 检测指标与方法
1.3.1 SCFAS测定 将预处理的盲肠内容物样品在4000r/min转速下离心15min,吸取上清液转移至预处理10mL离心管中,10000r/min转速下继续离心15min,1mL一次性注射器吸取上清液1mL,0.25μm滤膜过滤至2mL进样小瓶中待测[7]。

表1 基础饲料配方Table 1 Composition of the basic diet
气相色谱条件:进样量1μL;进样口温度220℃;柱流量0.95mL/min,柱温90℃、平衡时间0.5min,5℃/min升温至150℃,保留时间7min;检测器温度230℃;氢气流量40mL/min,空气流量400mL/min,尾吹流量40mL/min[8]。
1.3.2 pH测定 电位法。
称取一定质量的新鲜粪便/盲肠内容物于10mL去离子水预处理离心管中,加入10倍(V∶m)去离子水,旋涡混合仪上混匀后静置,测上清液pH。
1.3.3 盲肠内容物及肠壁重量 称重法。
1.3.4 游离氨含量测定 比色法。
无氨水制备[9]:在1000mL蒸馏水中加入0.10mL硫酸(ρ=1.84g/mL),并在全玻璃蒸馏器中重蒸馏,弃去前50mL蒸出液,然后将蒸出液收集在带有玻璃塞的玻璃瓶中。
将预处理的盲肠内容物样品4000r/min下离心5min,吸取上清液1mL,依次加入1mL含有0.001mol/L亚硝基铁氰化钠的0.5mol/L苯酚溶液和1mL含有0.03mol/L次氯酸钠的0.625mol/L氢氧化钠溶液,60℃保温5min,625nm波长下测吸光度[10]。
1.3.5 盲肠壁面积测定 首先用冰冷生理盐水洗净盲肠,充分展开后固定在A4纸上,勾出其轮廓,待纸干燥后将盲肠壁轮廓复写在厚的打印纸上,然后将纸上的盲肠轮廓图剪下。用精密度为0.0001g的电子秤准确称量轮廓图纸质量(m2)和1cm2的打印纸质量(m1),然后按以下公式计算盲肠表面积(cm2)。

1.3.6 盲肠内容物菌群测定 取新鲜的盲肠内容物0.2g左右,加入10倍(V/m)无菌生理盐水,旋涡混合仪振荡混匀,制得10-1稀释度盲肠内容物。依次10倍稀释至10-8稀释度,选择10-1、10-2、10-3三个稀释度,用于大肠杆菌和肠球菌的培养计数;选择10-4、10-5、10-6三个稀释度,用于双歧杆菌和乳酸杆菌的培养计数,选择10-2、10-3、10-4三个稀释度,用于厌氧菌的培养计数,接种量为200μL。
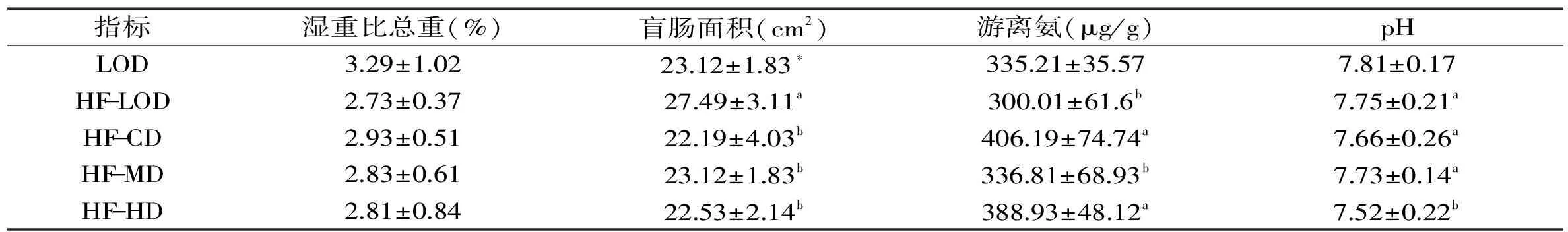
表3 花椒麻味素对SD雌性大鼠盲肠壁湿重与盲肠总重之比、盲肠面积、游离氨和pH的影响Table 3 Effects of dietary sanshool on wall wet weight Wet weight and total weight of the wall,wall area,free ammonia and pH in female Sprague-Dawley rats

表4 花椒麻味素对SD雌性大鼠盲肠内容物中短链脂肪酸的影响Table 4 Effects of dietary sanshool on SCFAS in female Sprague-Dawley rats
双歧杆菌于BLL培养基37℃、48h厌氧培养。乳杆菌于MRS培养基37℃、48h培养。肠杆菌于伊红美蓝培养基37℃、24h培养。肠球菌于叠氮钠-结晶紫-七味苷培养基37℃、48h培养。厌氧菌于靛基质培养基37℃、48h培养。结果均以lg(CFU/g)表示。
1.4 统计分析
实验结果以mean ± SD表示,各组间显著性差异采用SPSS分析,p<0.05被认为有显著差异。
2 结果与分析
2.1 花椒麻味素对SD雌性大鼠采食量、体重增加量及饲料效率的影响
由表2可以看出,高脂空白组与空白组相比,体重增加量增加了,采食量却显著降低(p<0.05),饲料效率显著增加(p<0.05)。说明高脂膳食能促进SD大鼠体重增加,同时能明显降低食欲从而减少饲料的摄入及能够提高饲料效率;而高脂空白组与剂量组相比,体重增加量和饲料效率都显著性增加,说明饲料中的脂肪能降低SD大鼠的食欲,进而减小了饲料的摄入。

表2 花椒麻味素对SD雌性大鼠采食量、 体重增加量及饲料效率的影响Table 2 Effects of dietary sanshool on body weight gain,food intake and feed efficiency in female Sprague-Dawley rats
2.2 花椒麻味素对SD雌性大鼠盲肠壁湿重与盲肠总重之比、盲肠面积、游离氨和pH的影响
由表3可知,高脂空白组与空白组相比,SD大鼠的盲肠面积显著增加。说明饲料中的脂肪能抑制盲肠组织的纵向生长,促进盲肠的横向生长;高脂空白组与剂量组相比,盲肠面积显著增加,低、高剂量组的游离氨含量显著增加,高剂量组的pH显著降低。说明花椒麻味素能抑制由脂肪引起的盲肠组织的横向生长,低、高剂量的花椒麻味素能促进细菌分泌脲酶,进而分解尿总碱产生游离氨,中剂量的花椒麻味素则能促进大肠中能够利用游离氨合成蛋白质的细菌的合成作用。盲肠内pH的降低会促进肠道细菌分泌的脲酶的活性,进而促进了尿总碱的分解产生游离氨。
2.3 花椒麻味素对SD雌性大鼠盲肠内容物中短链脂肪酸的影响
由表4得知,高脂空白组与空白组相比,盲肠内容物中各种短链脂肪酸的变化不大,说明饲料中的脂肪对盲肠内饲料的发酵影响不大;高脂空白组与剂量组相比,中剂量组的丙酸、异丁酸和总的短链脂肪酸都显著性增加,说明中剂量的花椒麻味素能促进饲料在盲肠中的发酵进而产生较多的短链脂肪酸。
2.4 花椒麻味素对SD雌性大鼠盲肠内容物中微生物的影响
由表5可以看出,高脂空白组与空白组相比,盲肠中双歧杆菌的数量显著降低,说明高脂膳食能抑制肠道有益菌的生长;高脂空白组与剂量组相比,中剂量组的肠球菌显著降低、乳酸菌显著增加及厌氧菌的数量显著增加,中、高剂量组的大肠杆菌显著降低了,各剂量组的双歧杆菌显著增加,说明花椒麻味素能促进肠道有益菌的生长,抑制肠道有害菌的生长,尤其是中剂量组的作用效果最明显。
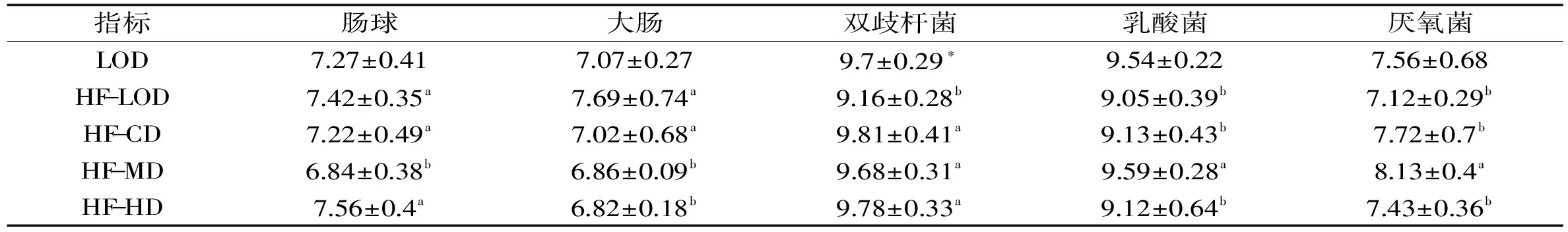
表5 花椒麻味素对SD雌性大鼠盲肠内容物中微生物的影响Table 5 Effects of dietary sanshool on microorganism in female Sprague-Dawley rats
3 结论与讨论
大鼠体重增加量间接反映饲料在胃肠道内消化吸收的利用情况,在机体运动量与基本代谢量一致的情况下,灌喂花椒麻味素大鼠的体重增加量增加,说明花椒麻味素能够促进饲料的消化利用率,使饲料充分转化为能被机体消化吸收的营养物质。从采食量来看,高脂空白组及剂量组的饲料摄入量明显降低,说明脂肪和花椒麻味素都能够抑制食欲,减少摄食量。
高脂空白组与空白组相比,盲肠壁湿重占总重比值降低,盲肠面积却显著增加。说明脂肪抑制盲肠组织的纵向生长,促进盲肠组织的横向生长。高脂空白组和剂量组相比,盲肠面积显著减小,说明花椒麻味素能抑制盲肠组织就脂肪引起的横向生长。
游离氨主要是小肠中谷氨酰胺代谢产生[11],大肠微生物代谢也可以产生[12-14]。肠道内游离氨主要是由细菌分泌的脲酶分解尿总碱产生的,一部分游离氨在大肠中被用于细菌蛋白质的合成[15]。有研究表明,肠道菌群严重失调(双歧杆菌下降,大肠杆菌、梭菌大量繁殖),尿总碱合成受阻,会产生更多的氨[16]。高脂空白组与剂量组相比,低、高剂量组的游离氨含量显著增加,高剂量组的pH显著降低,说明低、高剂量的花椒麻味素能促进细菌分泌脲酶,进而分解尿总碱产生游离氨,中剂量的花椒麻味素则能促进大肠中能够利用游离氨合成蛋白质的细菌的合成作用。盲肠内pH的降低会促进肠道细菌分泌的脲酶的活性,进而促进了尿总碱的分解产生游离氨。
饲料中的抗消化淀粉在肠道经厌氧菌发酵能产生短链脂肪酸,主要是乙酸、丙酸、丁酸,其次还有异丁酸[17-18]。SCFAs是大肠通常的生理功能性物质,具有调节肠肌活力、刺激电解液和流体的增加、增加血流及修复DNA损伤等[19-22]。SCFAs不仅为结肠粘膜提供了主要的能量供应,而且还可以维护肠道上皮细胞的完整性和杯状细胞的分泌功能。对粘膜免疫细胞有维护作用,还可以减少促炎因子的生成,有利于粘膜炎症的修复。乙酸有增强结肠血供给和氧摄取的作用,丙酸对葡萄糖的异生有一定作用[23],丁酸是肠壁细胞首选的氧化底物,也能抑制肠癌细胞增生和增强脱噬作用[24-25]。SCFAS还可以降低盲肠中pH,进而促进肠健康[26]。高脂空白组与剂量组相比,中剂量组的丙酸、异丁酸和总的短链脂肪酸都显著性增加,说明中剂量的花椒麻味素能促进饲料在盲肠中的发酵进而产生较多的短链脂肪酸。
作为肠道中重要的生理菌群,双歧杆菌能大量合成动物所需的营养物质和维生总碱,对多种肠道病原微生物产生拮抗,调节肠道菌群,增强机体免疫力,还能抗肿瘤,抗衰老,抗感染,以及提高人体对放射线的耐受力。低剂量的花椒麻味素就能够促进盲肠中双歧杆菌的生长,说明食用花椒麻味素能促进肠道健康。高脂空白组与空白组相比,盲肠中双歧杆菌的数量显著降低,说明高脂膳食能抑制肠道有益菌的生长;高脂空白组与剂量组相比,中剂量组的肠球菌显著降低、乳酸菌显著增加及厌氧菌的数量显著增加,中、高剂量组的大肠杆菌显著降低了,各剂量组的双歧杆菌显著增加,说明花椒麻味素能促进肠道有益菌的生长,抑制肠道有害菌的生长。
通过本次实验结果可以知道,短期食用花椒麻味素对机体肠道健康是有益的。但因本实验时间有限,未能深入研究长期食用花椒麻味素对肠道健康的影响及影响肠道健康的机理,还需进一步研究。
[1]肖崇厚,杨松松,洪玉坤,等.中药化学[M].上海科学技术出版社,1999.
[2]Sun X W,Duan Z X. Pepper medicinal plant research[J]. Pharmaceutical Journal,1996,31(3):384.
[3]Xiong Q B,Shi U W,Mizuno m. Flavonol glucodies in pericarps of Zanthoxylum bungeanum[J].Phytochemistry,1995,39:723-725.
[4]孟一娟.花椒麻味物质标准品的制备技术及其替代品的筛选与应用[D].重庆:西南农业大学,2010.
[5]张灿奎,郑庆安,糜留西,等. 刺壳椒化学成分研究[J].武汉植物学研究,2000,18(5):441-442.
[6]Kishida T,Nakai Y,Ebihara K. Hydroxypropyl-distarch phosphate from tapioca starch reduces zinc and iron absorption,but not calcium and magnesium absorption in rats[J]. J Nutr,2001,131:294-300.
[7]Cummings J H,Macfarlane G T. The control and consequences of bacterial fermentation in the human colon[J]. J Appl Bacteriol,1991:70:443-459.
[8]苏昕峰,向晨茜,文红丽,等. 辣椒总碱灌喂剂量对大鼠肠道发酵产物的影响[J]. 食品安全重庆高峰坛,2011:136-140.
[9]中华人民共和国国家标准. GB 11894-89 水质 总氮的测定[S]. 国家环境保护局,中国国家标准管理委员会,2003.
[10]Chaney A L,Marbach E P. Modified reagents for determination of urea and ammonia[J]. Clinical Chemistry,1962,8:130-132.
[11]Windmueller H G. Glutamine utilization by the small intestine[J]. Advances In Enzymology(Meistera Ed),1982,53:201-238.
[12]Vincea D A,Dawson A M,Park N,etal. Ammonia production by intestinal bacteria[J]. Gut,1973,14:171-177.
[13]Masonvc. Metabolism of nitrogenous compounds in the large gut[J]. Proc Nutr Soc,1984,43:45-53.
[14]Wrongom V. Urea and ammonia metabolism in the human large intestine[J]. Proc Nutr Soc,1984,43:77-86.
[15]Remesyc d. Specific effects of fermentable carbohydrates on blood urea flux and ammonia absorption in the rat cecum[J]. Nutr,1989,119,560-565.
[16]小桥恭一. 从消化道微生态学说起[J]. 中国微生态学杂志,1995,7:36-42.
[17]Macfarlanegt,Englysthn. Starch utilization by the human large intestinal microflora[J].J Appl Bacteriol,1986,60:195-201.
[18]Weaver G A,Krause J A,Miller T L,etal. Cornstarch fermentation by the colonic microbial community yields more butyrate than does cabbage fiber fermentation;cornstarch fermentation rates correlate negatively with methanogenesis[J]. Am J Clin Nutr,1992,55:70-77.
[19]Topping D L,Cufron p m. Short chain fatty acids and human colonic function:roles of resistant starch and non-starch polysaccharides[J]. Physiol Rev,2001,8:103l-1064.
[20]Bergman E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiol Rev,1990,70:567-590.
[21]Ramakrishna B S,Venkataramans s,etal. Amylase-resistant starch plus oral rehydration solution for cholera[J]. N Englj Med,2000,342:308-313.
[22]Mclntyrea G P,Young G P. Butyrate production from dietary fiber and protection against large bowel cancer in a rat model[J]. Gut,1993,34:386-391.
[23]Fajardoo N H,Lacey S W. The polymorphic expression of lactase in adults is regulated at the messenger rna level[J]. Gastroenterology,1994,106(5):1233-1241.
[24]Richard K L,Ian L B,Ying H,etal. Effect of resistant starch on genotoxin-induced apoptosis,colonic epithelium,and lumenal contents in rats[J]. Carcinogenesis,2003,24(8):1347-1352.
[25]Medina V,Edmonds B,Young G P,etal. Induction of caspase-3 protease activity and apoptosis by butyrate and trichostatin a(inhibitors of histone deacetylase):dependence on protein synthesis and synergy with a mitochondrial/cytochrome c-dependent pathway[J]. Cancer Res,1997,57:3697-3707.
[26]Summerton J,Goeting N,Trotter G A,etal. Effect of deoxycholic acid on the tumour incidence,distribution,and receptor status of colorectal cancer in the rat model[J]. Digestion,1985,31:77-81.
