C6胶质瘤微环境中大鼠BMSCs恶性转变与NF-κB高表达的相关性
2014-03-16张春敏崔建邦杨春梅
燕 莎,朱 静*,田 杰,2,张春敏,谭 彬,崔建邦,杨春梅
(重庆医科大学附属儿童医院1.儿童发育与疾病研究教育部重点实验室儿科学重庆市重点实验室;2.心血管内科,重庆400014)
恶性肿瘤的治疗一直是医学研究的热点,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)因具有极好的迁移能力和肿瘤趋向性,而被作为是靶向治疗肿瘤的最佳载体细胞,然而干细胞在特定的微环境中会有恶性转变的风险,有文献报道BMSCs 在异常的微环境中受到多种与肿瘤发生相关的信号通路的调控与影响[1-2]。本研究前期数据已经证实将BMSCs 置于C6 胶质瘤细胞的微环境中会发生恶性转变[3-5]。NF-κB(nuclear factor-κB,核转录因子κB)和STAT3(signal transducers and activators of transcription3,信号传导与转录活化因子3)的高表达及激活与多种肿瘤的发生发展密切相关[6-7]。本实验将从NF-κB 和STAT3 信号通路的角度出发来探讨BMSCs 在C6 微环境中发生恶性转变的相关机制,为BMSCs 的安全应用提供实验基础。
1 材料与方法
1.1 材料
SPF 级SD 大鼠(3~4 周龄、体质量40 ±10 g),SPF 级SD 24 h 新生鼠均由重庆医科大学动物中心提供[合格证书SCXY(渝)20120001])。DMEM/F12 培养基及胎牛血清(Gibico 公司),胰蛋白酶(Sigma 公司)。0.45 μm 1 次性无菌过滤器(Millipore 公司)。荧光定量PCR 试剂盒(大连宝生物公司)。NF-κB P65、STAT3 和c-Myc 引物(上海英俊生物公司)。大鼠IL-6 ELISA 检测试剂盒(Westang公司)。抗体:NF-κB P65、STAT3、P-STAT3、c-Myc和CD90(Abcam 公司);CD105(Origene 公司);CD45(Biolegend 公司)。ECL 化学发光试剂盒(南京凯基生物)。
1.2 方法
1.2.1 BMSCs 细胞培养及分组:取大鼠胫骨和股骨骨髓,贴壁法筛选、分离、培养和扩增BMSCs,用含10%胎牛血清DMEM/F12 培养,待细胞增殖至80%~90%汇合以1∶2 传代培养;取24 h 新生鼠的大脑皮质,差速贴壁法体外分离、培养及扩增星型胶质细胞;C6 胶质瘤细胞系用含10% 胎牛血清DMEM/F12 培养基常规培养。
实验共分4 组:空白组,10%胎牛血清DMEM/F12 新鲜培养基培养第3 代BMSCs;阴性对照组,星形胶质细胞二次培养液与10%胎牛血清DMEM/F12 新鲜培养基1∶1 比例培养第3 代BMSCs,间接共培养7 d;阳性对照组,10%胎牛血清DMEM/F12培养基培养C6 胶质瘤细胞;实验组,C6 胶质瘤细胞2 次培养液与含10%胎牛血清DMEM/F12 新鲜培养基以1∶1 比例培养第3 代BMSCs(骨髓间充质干细胞),间接共培养7 d。
1.2.2 细胞形态学观察:尼康倒置相差显微镜观察细胞生长状态,拍照记录。
1.2.3 流式细胞术(FCM)鉴定BMSCs 表面抗原:第3 代BMSCs 细胞培养至80%~90%汇合后终止培养,胰蛋白酶消化后,10%胎牛血清DMEM/F12培养基终止消化,离心弃上清,PBS 洗两次后用1 mL PBS 重悬制成单细胞悬液,细胞数量106个,加入单克隆抗体CD45、CD90 和CD29,同时设立同型阴性对照,流式细胞仪检测细胞表面标志物CD45、CD90 和CD29 的表达。
1.2.4 ELISA 检测各组细胞上清液中IL-6 表达水平:4 组细胞均增殖至70%~80% 后,弃培养基,PBS 洗两遍,加入无血清DMEM/F12 新鲜培养基,培养24 h 后取各组细胞上清液,离心取上清后,按照大鼠IL-6 ELISA 检测试剂盒说明书操作,450 nm处测吸光度值,3 次独立实验。
1.2.5 RT-QPCR 检测NF-κB P65、STAT3 和c-Myc mRNA 的表达情況:根据RNA 提取试剂盒说明书提取各组细胞RNA,并进行反转录,反转产物cDNA进行扩增,反应条件:预变性95 ℃30 s,95 ℃5 s、60 ℃30 s 共39 个循环,每次反应均设空白空,各组样品设3 个复孔,以β-actin 为内参,将空白对照组的mRNA 表达量设为1,根据据2-ΔΔct计算各组mRNA 的相对表达量,2 次独立实验。优化反应条件使目的基因扩增效率达到95%~105%。目的基因的引物序列如下,以β-actin 为内参(表1)。
1.2.6 Western blot 检测NF-κB P65、STAT3、P-STAT3和c-Myc 蛋白表达水平:取各组细胞107 个,PBS清洗3 次,按蛋白提取说明书分别提取总蛋白及核蛋白,BCA 法测定蛋白浓度,分装-80 ℃保存。配制8% SDS-PAGE 胶,按每孔蛋白总量50 μg 依次上样,电泳后将蛋白湿转至PVDF 膜上,5%脱脂牛奶封闭2 h,加入一抗(NF-κB P65 1 ∶1 000、STAT3 1∶1 000、P-STAT3 1∶2 000、c-Myc 1∶2 000、PTEN 1∶2 000、β-actin 1∶4 000),4 ℃摇床孵育14~16 h,PBST 漂洗3 次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000)二抗,室温孵育2 h,PBST 漂洗3 次,避光条件下加入ECL 显色剂于凝胶成像系统发光,测定蛋白表达的相对含量。
1.2.7 免疫荧光检测NF-κB P65、P-STAT3 蛋白的表达:取各组细胞1 ×104个接种于24 孔板中进行细胞爬片,待细胞增殖至50%左右,进行细胞免疫荧光操作。4%多聚甲醛固定15 min,0.5% Triton-X-100 作用10 min,5%牛血清白蛋白(BSA)封闭30 min,分别加入NF-κB P65(1 ∶400)、P-STAT3(1∶200)、c-Myc(1∶100)一抗,PBS 代替一抗设立阴性对照,4 ℃湿盒14~16 h;室温平衡30 min,PBS洗去一抗,分别加入山羊抗兔荧光二抗(1∶200 稀释)37 ℃避光孵育1 h,PBS 洗去二抗,DAPI(1∶20)核染室温15 min,PBS 清洗后,封片,荧光显微镜下观察细胞NF-κB P65、P-STAT3的表达,并拍照记录,观察10 个视野,细胞阳性表达率为阳性细胞数/细胞总数。
1.3 统计学分析
采用SPSS17.0 对所得数据进行统计分析,计量资料以均数±标准差(±s)表示,两个样本间的比较采用独立样本t 检验。
2 结果
2.1 BMSCs 表面抗原的鉴定及细胞形态
第三代BMSCs 贴壁生长,长梭型,集落生长折光性差,集落成漩涡状(图1A)。CD90 表达率达100%,CD29 表达率占92.5%,CD45 表达率1.4%(图1B)。
2.2 各组细胞形态学特征
空白组及阴性对照组BMSCs 细胞扁平,呈成纤维样细胞生长,分布均匀,排列有序(图2A、B)。实验组BMSCs 共培养7 天后形态发生显著改变,细胞变细变长,核质比增大,细胞间粘附性减小。(图2C)。C6 细胞贴壁性稍差,形态细长,排列紊乱,核质比大(图2D)。

表1 RT-QPCR 引物序列Table 1 RT-PCR primer sequence of target gene

图1 BMSCs 表面标志物表达及BMSCs 细胞形态Fig 1 Surface marker expression and morphology of BMSCs(×40)

图2 各组细胞形态图Fig 2 Morphology of cells detected by invertedmicroscope(×100)
2.3 ELISA 检测各组细胞上清液中SIL-6 表达水平
实验组细胞上清液IL-6 水平(16.7 ±2.9)ng/L高于阴性组(12.6 ±3.1)ng/L 及空白组(12.3 ±3.2)ng/L(P<0.05)(图3)。
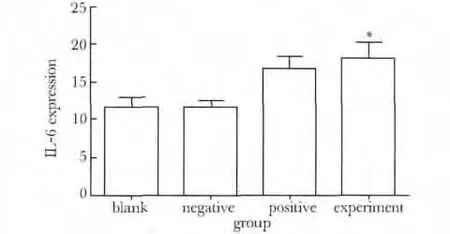
图3 各组细胞上清液中SIL-6 水平Fig 3 Expression of IL-6 in each group(ng/L)
2.4 RT-QPCR 检测NF-κB P65、STAT3 和c-Myc mRNA 的表达量
实验组细胞间接共培养7 天后其NF-κB P65、STAT3 和c-Myc mRNA 表达量显著高于阴性组及空白组(P<0.05)(图4)。
2.5 Western blot 检测蛋白表达水平
实验组细胞培养7 d 后其NF-κB P65、P-STAT3和c-Myc 蛋白表达量显著高于阴性对照组及空白组(P<0.05)(图5)。
2.6 免疫荧光检测NF-κB P65、P-STAT3 蛋白的表达
NF-κB P65 表达定位于核内,实验组细胞NF-κB P65 核内阳性表达率为94%高于阴性组3%及空白组0%(P<0.01)(图6);实验组细胞P-STAT3 高表达于核内阳性率达97%,阴性组及空白组细胞核内没有表达P-STAT3(图7)。

图4 各组细胞NF-κB P65、STAT3 和c-MycmRNA 表达Fig 4 Expression of NF-κB P65,STAT3 and c-Myc mRNA in various group by RT-QPCR
3 讨论
BMSCs 因具有低免疫原性、肿瘤趋向性、易于基因转染等优点而被作为靶向治疗肿瘤的种子细胞之一,其细胞移植及抗肿瘤治疗等相关研究成为干细胞应用的研究热点[8]。但BMSCs 临床应用的安全性存在争议,将干细胞作为载体靶向治疗肿瘤过程中,复杂的肿瘤微环境可能会导致BMSCs 的恶性转变,引发干细胞安全应用的风险[9]。本实验前期数据表明,BMSCs 在体外与C6 胶质瘤细胞共培养后注射到裸鼠皮下3 个月后形成肿块,BMSCs 相关癌基因表达增高,例如突变型P53、Cyclin D1、Bclxl 等,这说明与C6 共培养后的BMSCs 发生了恶性转变[3-5]。为进一步探讨BMSCs 恶性转变机制,本实验通过富含高水平细胞因子例如IL-6、HGF 等[5]的C6胶质瘤细胞2 次培养液培养BMSCs,模拟异常微环境,探讨处于该异常微环境中的BMSCs 是否存在NF-κB 和STAT3 的激活及高表达。
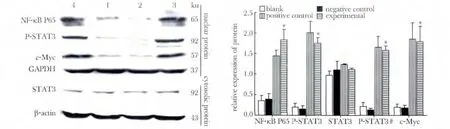
图5 NF-κB P65,STAT3,P-STAT3,c-Myc 蛋白相对表达量(P-STAT3#为STAT3 磷酸化率)Fig 5 Expression of NF-κB P65,STAT3,P-STAT3 and c-Myc protein in various group

图6 免疫荧光检测NF-κB P65 蛋白的表达Fig 6 Expression of NF-κB P65 protein(×200)

图7 免疫荧光检测P-STAT3 蛋白的表达Fig 7 Expression of P-STAT3 protein(×200)
NF-κB 和STAT3 相关信号通路是研究肿瘤发生发展的热点之一,相关文献证实NF-κB 作为细胞生存和凋亡的重要调控因子,NF-κB 的激活及高表达与许多恶性肿瘤的发生发展密切相关[9]。高水平的IL-6、TNF-α 等可激活NF-κB,同时活化的NF-κB P50/P65 与靶基因结合后引发细胞因子(IL-6、IL-8、TNF-α 等)及癌基因(c-Myc 等)的高表达[11]。且高水平IL-6 可引发STAT3 的磷酸化[5,12],持续活化的P-STAT3 与多种肿瘤的发生发展密切相关[13-14]。
本实验结果表明,恶性转变的BMSCs 上清液中IL-6 水平显著高于阴性组及空白组,并且共培养的BMSCs 存在NF-κB、STAT3 的激活及c-Myc 的高表达,这与上述文献报道中肿瘤发生发展的相关过程一致。因此本实验认为BMSCs 受到C6 胶质瘤细胞分泌的细胞因子持续刺激,引发NF-κB 和STAT3 的活化并与靶基因结合,启动下游肿瘤相关基因表达,从而引发C6 胶质瘤微环境下的BMSCs 发生恶性转变,推测高表达的NF-κB 和STAT3 可能是导致BMSCs恶性转变的重要因素之一,为后续进一步探讨BMSCs 恶性转变的机制打下基础,也为BMSCs临床应用的安全性提供科学依据。
[1]Mishra P J,Glod J W,Banerjee D,et al.Mesenchymal stem cells:flip side of the coin[J].Cancer Res,2009,69:1255-1258.
[2]Spaeth E,Klopp A,Dembinski J,et al.Inflammation and tumor microenvironments:defining the migratory itinerary of mesenchymal stem cells[J].Gene Ther,2008,15:730-738.
[3]Xiangrong Cui,Jianping Liu,Lu Bai,et al.Interleukin-6 induces malignant transformation of rat mesenchymal stem cells in association with enhanced signaling of signal transducer and activator of transcription 3[J].Cancer Sci,2014,105:64-71
[4]刘建平,朱静,田杰,等.体外模拟肿瘤微环境中致大鼠MSCs 瘤化因子分析[J].基础医学与临床,2012,32:375-380.
[5]崔向荣,朱静,田杰,等.C6 胶质瘤微环境中SIL-6R/GP130 与MSCs 瘤向转化的相关性[J].基础医学与临床,2013,33:525-530.
[6]Dimitrios Iliopoulos,Heather A.Hirsch,and Kevin Struhl.An epigenetic switch involving NF-kB,Lin28,Let-7 MicroRNA,and IL6 links inflammation to cell transformation[J].Cell,2009,139:693-706.
[7]Dimitrios Iliopoulos,Savina A.Jaeger,Heather A.Hirsch,et al.STAT3 Activation of miR-21 and miR-181b-1 via PTEN and CYLD Are Part of the Epigenetic Switch Linking Inflammation to Cancer[J].Mol Cell,2010,39:493-506.
[8]ZHANG Li,PENG Li-pan,WU Nan,et,al.Development of bone marrow mesenchymal stem cell culture in vitro[J].Chin Med J,2012,125:1650-1655.
[9]Nakamizo A,Marini F,Amano T,et al.Human bone marrow derived mesenchymal stem cells in the treatment of gliomas[J].Cancer Res,2005,65:3307-3318.
[10]Hayden MS,Ghosh S.NF-kappaB,the first quarter-century:remarkable progress and outstanding questions[J].Genes Dev,2012,26:203-234.
[11]Ko HS,Lee HJ,Kim SH,et al.Piceatannol suppresses breast cancer cell invasion through the inhibition of MMP-9:involvement of PI3K/AKT and NF-κB pathways[J].Agric Food Chem,2012,60:4083-4089.
[12]Kesanakurti D,Chetty C,Rajasekhar Maddirela D,et al.Essential role of cooperative NF-kappaB and Stat3 recruitment to ICAM-1 intronic consensus elements in the regulation of radiation-induced invasion and migration in glioma[J].Oncogene,2013,32:5144-5155.
[13]Rajbhandari R,Twitty GB Jr,Gray GK,et al.NF-kB-induced IL-6 ensures STAT3 activation and tumor aggressiveness in glioblastoma[J].PLoS ONE,2013,8:e78728.
[14]Yoon S,Woo SU,Kang JH,et al.NF-κB and STAT3 cooperatively induce IL6 in starved cancer cells[J].Oncogene,2012,31:3467-3481.
