卵巢癌特异性MR分子探针的制备
2014-03-16文曦琳葛晓东李妹玲李少林
文曦琳,李 易,葛晓东,李妹玲,文 明,李少林
(重庆医科大学附属第一医院放射科,重庆400016)
卵巢癌是一种严重威胁女性生命的恶性肿瘤,病死率居妇科恶性肿瘤之首[1],因其深居盆腔,早期诊断极为困难,大部分患者在发现时已达病程晚期,目前虽然采用以外科手术及化学治疗为主的综合治疗,但其5年生存率仍低于40%[2],因此迫切需要寻求新的治疗策略。
新兴的分子影像学是一项从分子或细胞水平对机体病理和生理变化进行成像的技术,它在疾病的早期诊断、精确定位及进行疗效监测等方面,有着巨大的开发及应用前景[3]。以RNAi(RNA 干扰)技术为基础的基因治疗,因特有的高效性、特异性和无创性,受到越来越多的关注,成为治疗恶性肿瘤的新方向[4]。本研究将两种技术结合,以多聚赖氨酸修饰的超顺磁性葡聚糖四氧化三铁纳米粒子(SPIO-PLL)作为MR 阴性对比剂及载体,连接靶向卵巢癌表皮生长因子受体(epidermal growth factor receptor,EGFR)基因的质粒pGenesil1-shRNA,构建集诊断和治疗于一体的特异性双功能分子探针(即SPIO-PLL-pshRNA 探针,以下简称探针),并初步评价其体外转染卵巢癌SKOV3细胞的可行性。
1 材料与方法
1.1 主要材料与试剂
SPIO-PLL 由本研究组自制(方法另文报道),重组质粒pGenesil1-shRNA(含增强型绿色荧光蛋白EGFP报告基因,上海生物工程公司合成),卵巢癌SKOV3 细胞系(中科院上海细胞库),RPMI1640 培养基、胎牛血清(Hyclone 公司),琼脂糖(Hydragene公司),Cell counting kit-8(CCK-8)试剂盒(碧云天生物技术有限公司)。
1.2 方法
1.2.1 探针的最佳质量比确定(已申请国家专利):在中性条件下,将SPIO-PLL 与质粒分别按不同质量比(0.1∶1、0.5∶1、1∶1、2∶1、4∶1、6∶1、8∶1 和10∶1)混合,上下吹打混匀,室温下放置30 min。琼脂糖凝胶阻滞实验:配制1%琼脂糖凝胶溶液,待冷却至60 ℃左右,加入核酸染料,混匀、灌胶。分别取10 μL 各组样品及2 μL loading buffer 混匀后加入各孔道,并设置SPIO/pshRNA 复合物(根据预实验,设置两者质量比为6∶1)及质粒作为阴性及空白对照。将胶板置于1 × TAE 缓冲液中,100 V 电压泳动50 min,取出胶板于紫外透射仪下观察并照相,观察不同质量比的复合物结合情况,选取最佳质量比(确定为实验探针)用于后续实验。
1.2.2 细胞培养:卵巢癌SKOV3 置于含10%胎牛血清的RPMI1640 培养基,37 ℃、5% CO2孵箱中常规培养,待细胞长至对数增殖期时,用0.25%胰蛋白酶消化并加入适量培养基,制成细胞悬液,用于随后的实验。
1.2.3 荧光显微镜观察细胞转染情况:细胞接种于6 孔板,置于孵箱中培养,至次日细胞贴壁率达70%~80%,吸弃原培养基,将探针及单纯质粒分别用无血清培养基稀释后加入各培养孔(每孔质粒约4 μg),5 h 后加入含15%胎牛血清的完全培养基,继续培养24 h 后荧光显微镜下观察结果。
1.2.4 透射电镜观察转染后的细胞:取上述探针转染的SKOV3 细胞,用胰蛋白酶消化制成细胞悬液,800 r/min 离心5 min,吸弃上清液,新鲜培养基重悬,12 000 r/min 离心10 min,收集细胞沉淀,2.5%戊二醛固定,丙酮梯度脱水,环氧树脂包埋,修块,切片,透射电镜下观察。
1.2.5 细胞毒性检测:将细胞按200 μL/孔种于96孔板,常规培养24 h,加入不同浓度探针(设置各实验组探针中铁的终浓度分别为10、25、50、100 和200 mg/L),并设未加探针的细胞组为对照组(即含铁浓度为0 mg/L),每组各设3 个复孔。继续培养24 h 后取出,于每孔中加入20 μL CCK-8 试剂,再培养2 h,在490 nm 波长的酶标仪上(参比波长570 nm,无细胞的培养基调零)检测每孔吸光度值。计算各组吸光度A 值(±s),细胞存活率% =(实验组A490nm值/ 对照组A490nm值)×100。
1.2.6 转染后细胞MR 成像:将探针转染的SKOV3 细胞组作为实验组(根据预实验,设置探针中铁浓度为25 mg/L),收集于1.5 mL 微量离心管中,加入1%琼脂糖凝胶迅速吹打混匀,置于4 ℃冰箱冷却凝固备用。另设置单纯质粒转染的SKOV3 细胞、未转染的SKOV3 细胞,琼脂糖为对照组。各组设3 个平行管,插入自制的小圆形泡沫板上,置于腕关节线圈行MR 横断位扫描。扫描参数:GRE T2*WI,TR 240 ms,TE 8.2 ms,FOV 8 cm,层厚3 mm,矩阵320 ×224,激励次数4,翻转角20°。扫描图像传至GE ADW 4.0 工作站,测量各管信号强度(即T2*值)。
1.3 统计学分析
应用SPSS17.0 统计软件进行数据分析,计量数据采用均值±标准差(±s)表示,组间均数比较采用单因素方差分析,多重比较采用LSD 法。
2 结果
2.1 探针的最佳质量比
琼脂糖凝胶电泳结果(图1)显示了不同比例SPIO-PLL 纳米粒与质粒pGenesil1-shRNA 的结合情况,对照组1 孔(质粒组)和2 孔(SPIO/pshRNA 组)以及实验组3~7 孔均可见到白色亮条带泳出,其中肉眼可见6~7 孔泳出的DNA 条带逐渐减弱滞后,相应孔中的DNA 亮带开始出现,而从8 孔(6∶1)开始,未见明显DNA 条带泳出,点样孔中可见白色的DNA 条带滞留。确定探针的最佳质量比为PLLSPIO∶质粒=6∶1。

图1 不同比例SPIO-PLL-pshRNA 复合物琼脂糖凝胶电泳图Fig 1 Agarose gel electrophoresis pattern of SPIO-PLLpshRNA complexes at different weight ratios
2.2 荧光显微镜观察细胞转染结果
探针转染的SKOV3 细胞组,视野内散在分布点状或条片状绿色荧光(图2),而单纯质粒转染组视野内未见到绿色荧光。

图2 探针转染SKOV3 细胞荧光显微镜观察结果Fig 2 SKOV3 cells transfected with probes,observed by fluorescence microscope(×100)
2.3 透射电镜观察结果
探针转染后的SKOV3 细胞胞质内存在多个散在或成团分布的高密度黑色铁颗粒,细胞核内未见铁颗粒(图3)。

图3 探针转染的SKOV3 细胞电镜图Fig 3 TEM images of SKOV3 cells transfected with probes(×12 000)
2.4 细胞毒性检测结果
探针对细胞毒性具有浓度依赖性,随着浓度增加,毒性也随之增加。在探针铁浓度小于50 mg/L,细胞存活率大于80%;当浓度高于50 mg/L,细胞存活率明显降低(表1)。
2.5 MR 成像结果
实验组信号强度T2*值为(287 ±12),而单纯质粒转染的SKOV3 细胞组、未转染的SKOV3 细胞组、琼脂糖组T2*值分别为(525 ±18)、(548 ±21)、(647 ±14)。实验组较各对照组T2*值明显降低(P<0.01)(图4)。
表1 不同浓度探针的细胞毒性检测结果Table 1 Cytotoxicity test results of probes at different concentration(±s,n=3)
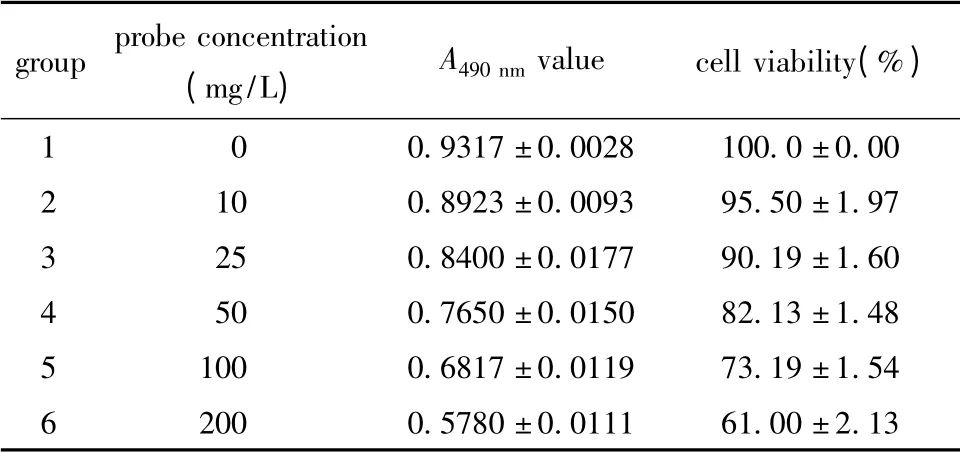
表1 不同浓度探针的细胞毒性检测结果Table 1 Cytotoxicity test results of probes at different concentration(±s,n=3)
groupprobe concentration(mg/L)A490 nm valuecell viability(%)1 0 0.9317 ±0.0028100.0 ±0.00 2 100.8923 ±0.009395.50 ±1.97 3 250.8400 ±0.017790.19 ±1.60 4 500.7650 ±0.015082.13 ±1.48 51000.6817 ±0.011973.19 ±1.54 62000.5780 ±0.011161.00 ±2.13

图4 探针转染SKOV3 细胞后MR 成像结果Fig 4 MR imaging results of SKOV3 cells transfected with probes
3 讨论
在分子影像学研究中,分子探针的构建至关重要。分子探针的主要结构包括亲和组件、信号组件和二者之间的连接物[5]。EGFR 是原癌基因c-erbB-1的表达产物,它在卵巢癌中过度表达,其表达水平与肿瘤的发生、转移和浸润程度等密切相关[6],是卵巢癌诊断和治疗的理想靶点。因此,本研究针对EFGR 构建干扰质粒pGenesil1-shRNA 作为探针的亲和组件,进入卵巢癌细胞后转录出的shRNA 可通过RNAi 沉默EGFR 基因,从而抑制目的蛋白的表达。信号组件为MR 负性对比剂SPIO,它具有粒径小,细胞穿透力强,有很好的磁响应性及生物可降解性等优点[5]。中间连接物为带正电的PLL,它是最早用于基因转染的阳离子聚合物[7],经其修饰的SPIO 可通过静电吸附结合带负电的质粒[8]。
琼脂糖凝胶阻滞实验可检测不同质量比SPIOPLL 和质粒的结合情况,由于二者结合后比重增大及表面电荷的改变,其随电流的迁移较游离DNA 会受到明显的阻碍,因此DNA 亮带的位置会产生相应变化,而SPIO 因带负电不能与直接与质粒结合。实验结果示SPIO-PLL 与质粒的结合率随着其比例增大而增加,当两者比例达6∶1 时,即可有效结合,确定该比例为制备探针的最佳质量比。
探针能否顺利进入肿瘤细胞是进行后续研究的基础。探针中的质粒载体pGenesil-1 含EGFP 报告基因,它进入细胞且成功表达后可于荧光显微镜下看见绿色荧光。实验结果表明探针可顺利进入卵巢癌细胞,并检测到探针中的SPIO 颗粒分布于细胞胞质内。探针对细胞是否存在毒性会对目的基因的表达产生影响,本实验制备的探针中SPIO 主要成分为铁,PLL 是一种含赖氨酸残基的多肽聚合物,两者均具有生物可降解性及低细胞毒性,且研究显示两者结合后毒性还可进一步降低[9-10],实验结果证实探针的细胞毒性小,且在低于50 mg/L 的铁浓度范围内,对细胞活力没有明显影响。探针中SPIO作为MR 负性对比剂,能缩短T1 和(或)T2 弛豫时间,引起MR 信号降低,其中T2*WI 序列对检测细胞内SPIO 更敏感[11],实验结果说明探针在较低浓度下转染卵巢癌细胞后,即可被MR 敏感检测。综上,本研究已成功制备针对卵巢癌的SPIO-PLLpshRNA 探针,为随后的应用研究奠定了基础。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics[J].Cancer J Clin,2012,62:10-29.
[2]Starmans LW,Burdinski D,Haex NP,et al.Iron oxide nanoparticle-micelles (ION-micelles)for sensitive (molecular)magnetic particle imaging and magnetic resonance imaging[J].PLoS One,2013,8:e57335.doi:10.1371/journal.pone.0057335.
[3]Rosenblum LT,Kosaka N,Mitsunaga M,et al.In vivo molecular imaging using nanomaterials:general in vivo characteristics of nano-sized reagents and applications for cancer diagnosis[J].Mol Membr Biol,2010,27:274-285.
[4]Uchino K,Ochiya T,Takeshita F.RNAi therapeutics and applications of microRNAs in cancer treatment[J].Jpn J Clin Oncol,2013,43:596-607.
[5]Chakravarty R,Goel S,Cai W.Nanobody:the“magic bullet”for molecular imaging?[J].Theranostics,2014,4:386-398.
[6]Lafky JM,Wilken JA,Baron AT,et al.Clinical implications of the ErbB/epidermal growth factor (EGF)receptor family and its ligands in ovarian cancer[J].Biochim Biophys Acta,2008,1785:232-265.
[7]Ward CM,Read ML,Seymour LW.Systemic circulation of poly(L-lysine)/DNA vectors is influenced by polycation molecular weight and type of DNA:differential circulation in mice and rats and the implications for human gene therapy[J].Blood,2001,97:2221-2229.
[8]Minigo G,Scholzen A,Tang CK,et al.Poly-L-lysine-coated nanoparticles:a potent delivery system to enhance DNA vaccine efficacy[J].Vaccine,2007,25:1316-1327.
[9]Tassa C,Shaw SY,Weissleder R.Dextran-coated iron oxide nanoparticles:a versatile platform for targeted molecular imaging,molecular diagnostics and therapy[J].Acc Chem Res,2011,44:842-852.
[10]Arbab AS,Yocum GT,Wilson LB,et al.Comparison of transfection agents in forming complexes with ferumoxides,cell labeling efficiency,and cellular viability[J].Mol Imaging,2004,3:24-32.
[11]Tanimoto A,Oshio K,Suematsu M,et al.Relaxation effects of clustered particles[J].J Magn Reson Imaging,2001,14:72-77.
