Ano2是钙激活氯离子通道的分子基础
2014-03-16藏雨轩朱杭飞向国艳张雲乔李瑷彤
藏雨轩,方 芳,朱杭飞,向国艳,张雲乔,李瑷彤,郝 峰*
(吉林医药学院1.生物化学检验教研室;2.免疫学教研室,吉林吉林132013)
钙激活氯离子通道(calcium-activated chloride channels,CaCCs)是一类在内皮细胞、平滑肌细胞和神经元等细胞广泛表达的阴离子通道,在跨上皮液体转运、嗅觉信号传导和平滑肌收缩等多种生理过程中扮演重要角色[1-2],同时CaCCs 也是治疗高血压、腹泻和某些特定肿瘤等疾病潜在的药物靶点[3]。跨膜蛋白16家族(transmembrane protein 16)共有10 个成员,目前已证实Ano1(anoctamin 1)是CaCCs 的分子基础[4-5],但对其他成员的作用还不十分清楚。本实验探讨Ano2(anoctamin 2)是否是CaCCs 的分子基础。
1 材料与方法
1.1 材料
限制性内切酶、T4 连接酶和Taq 酶(Takara 公司);引物合成和测序(上海生工公司);RT-PCR 试剂盒和Trizol(Invitrogen 公司);DNA 凝胶回收试剂盒(Qiagen 公司);FRT 细胞(大连医科大学麻彤辉教授馈赠);兔源增强型绿色荧光蛋白(EGFP)抗体和羊抗兔二抗(中杉金桥公司);F-12 基本培养基、4-羟乙基哌嗪乙磺酸(HEPES)、氯化铯(CsCl)、N-甲基-D 葡萄糖胺(NMDG)和尼氟灭酸(niflumic acid,NFA)(Sigma 公司);胎牛血清(四季青公司)。
1.2 方法
1.2.1 引物设计与合成:NCBI 查询小鼠Ano2 基因(NM_153589)序列,设计位于开放读码框架两端的引物,去除下游引物终止密码子后加入保护碱基和相应酶切位点EcoR Ⅰ(GAATTC)和Kpn Ⅰ(GGT ACC)。上游引物:5'-CGAATTCCGTCTGAGCCGCA TGCACTTT-3';下游引物:5'-GCGGTACCTACATTGG TGTGCTGGGACC-3'。
1.2.2 RT-PCR 扩增Ano2 基因:提取小鼠视网膜总RNA,仅转录为cDNA,以此为模板进行PCR 反应,94 ℃预变性5 min;94 ℃30 s,55 ℃30 s,72 ℃3.5 min,30 个循环;72 ℃,10 min,PCR 产物琼脂糖凝胶电泳后,切胶回收阳性片段。
1.2.3 pEGFP-Ano2 的构建、转化与鉴定:EcoRⅠ和KpnⅠ双酶切Ano2 与pEGFP-N3 后,16 ℃连接过夜。将重组质粒转化入感受态DH5α,次日挑取阳性克隆,摇菌扩增,12 h 后提取质粒,酶切正确后测序。
1.2.4 稳定表达pEGFP-Ano2 细胞系的建立:将长势良好的FRT 细胞铺6 孔板,置于37 ℃、5% CO2培养箱培养。待第2 天细胞汇合度达80%~90%,将0.5 μg 质粒分別与1、1.5、2 和2.5 μL 脂质体Lipofectamine 2000,混合进行转染,倒置荧光显微镜观察转染pEGFP-Ano2 在Fisher 大鼠甲状腺滤泡上皮细胞(Fisher rat thyroid,FRT)中Ano2 的表达情况,选取转染效率高的质粒和脂质体比例进行后续实验。36 h 后将转染的FRT 细胞消化,按照1∶5∶10的比例传代到3 个10 cm 培养板中,并加入含有1 000 ng/mL的G418 的完全培养液培养,挑取纯度和表达量均较高的克隆到96 孔板继续培养,待细胞汇合度达60%后扩大培养。
1.2.5 Western blot 检测pEGFP-Ano2 的表达:转染后36 h,消化收集细胞并超声裂解,将定量的蛋白样品上样进行SDS-PAGE 凝胶电泳,180 mA 2 h 电转移至NC 膜,脱脂奶室温封闭2 h,然后加EGFP 抗体、内参β-actin 抗体和羊抗兔二抗摇晃孵育,TBST洗膜3 次,ECL(A 和B 显色液等体积混合)化学发光试剂显影,放入凝胶成像系统中拍照,用Quality one 软件分析灰度值。实验数据以均值± 标准差(±s)表示,应用SPSS 13.0 软件进行统计分析,组间比较采用t 检验。
1.2.6 全细胞膜片钳技术记录Ano2 的电流:将转染pEGFP-Ano2 的FRT 细胞消化置于倒置荧光显微镜载物台,电极给予负压吸引并击破细胞膜,维持GΩ高阻抗封接,形成whole-cell patch。初始钳制电压为0 mV,施加从-100 mV 跃阶到+100 mV 电压(每20 mV一个step),各记录750 ms 电流变化,750 ms 后电压变为-60 mV,继续记录200 ms,CaCCs 的抑制剂NFA 作为对照。配制600 nmol/L Ca2+溶液和0 nmol/L Ca2+溶液,配方详见参考文献[6]。
2 结果
2.1 重组pEGFP-Ano2 真核表达载体双酶切鉴定
琼脂糖凝胶电泳结果约在4 700、2 700、7 400、7 400和4 000 bp 处有5 条清晰带,与预期结果一致(图1)。
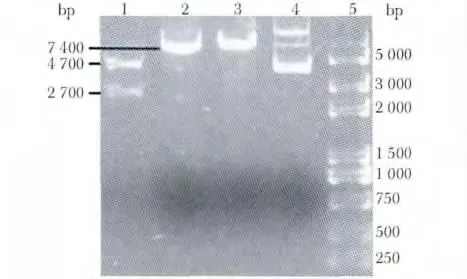
图1 重组质粒电泳图Fig 1 Electrophoregram of recombinant plasmid
2.2 重组pEGFP-Ano2 真核表达载体测序结果
结果表明所构建重组质粒上连有目的基因Ano2,经分析上游及下游酶切位点分别为EcoR Ⅰ和Kpn Ⅰ,证实成功构建重组pEGFP-Ano2 真核表达载体(图2)。
2.3 瞬时转染条件的优化结果
0.5 μg 质粒分别与1、1.5、2 和2.5 μL 脂质体,混合进行瞬时转染,0.5 μg 质粒与2.5 μL 脂质体转染效率最高(图3)。
2.4 稳定表达Ano2 的FRT 细胞
稳定转染pEGFP-Ano2 的FRT 细胞膜呈现绿色,提示FRT 细胞成功表达pEGFP-Ano2(图4)。
2.5 Western blot 检测FRT 细胞中Ano2 的表达
转染pEGFP-Ano2 的FRT 细胞出现EGFP-Ano2和β-actin 两条带,片段大小正确,吸光度:EFGPAno2/β-actin=0.26 ±0.03,对照组的FRT 细胞只出现β-actin 一条带,吸光度:EFGP-Ano2/β-actin =0.13 ±0.02,明显高于对照组(p<0.05)(图5)。
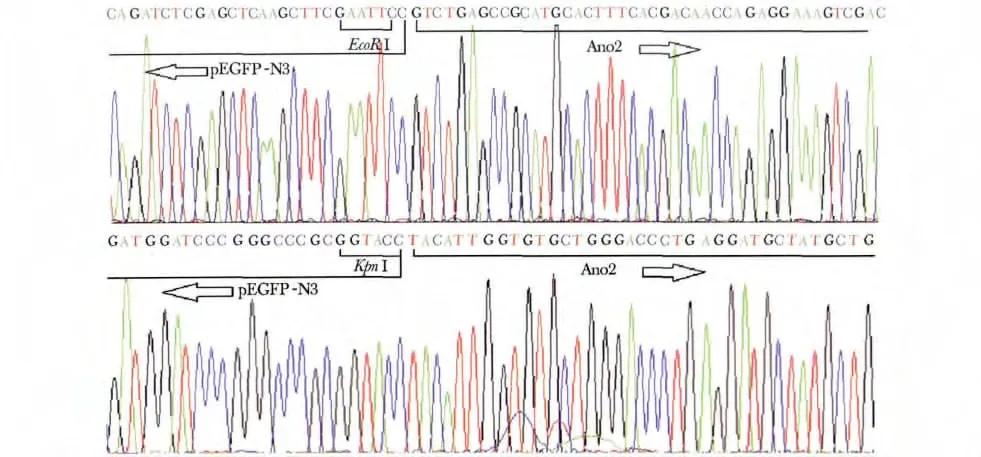
图2 重组质粒测序图Fig 2 The sequencing results of recombinant plasmid
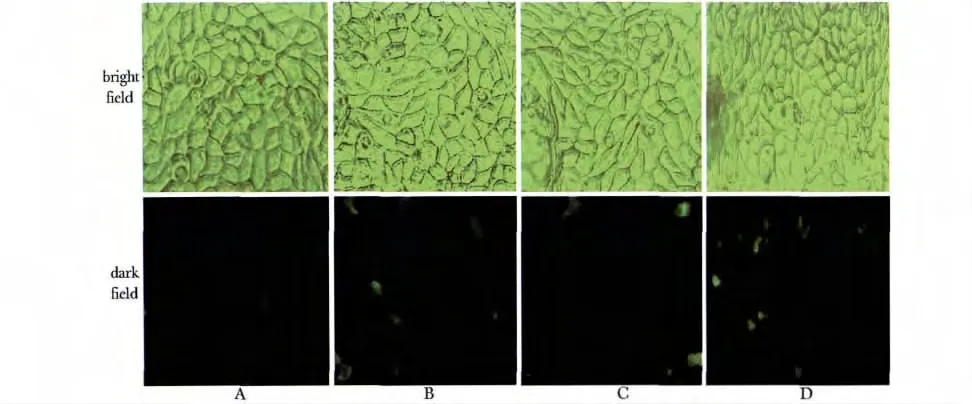
图3 不同比例的质粒与脂质体瞬时转染至FRT 细胞Fig 3 The different ratios of plasmid and lipofectamine in FRT cells (×200)
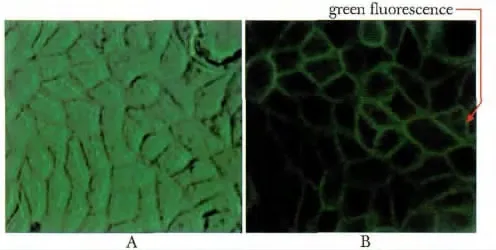
图4 稳定表达pEGFP-Ano2 的FRT 细胞Fig 4 FRT cells stably expressing pEGFP-Ano2(×400)
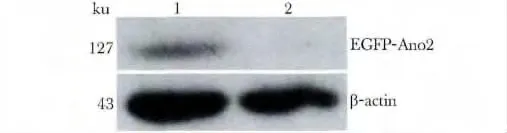
图5 Ano2 在FRT 细胞中的表达Fig 5 The expression of Ano2 in FRT cells
2.6 全细胞膜片钳技术结果
在600 nmol/L Ca2+存在的情况下,电流随电压和时间的增加而增大,并记录到尾电流(图6A)。此时在稳定表达Ano2 的FRT 细胞上施加不同电压,加入CaCCs 的抑制剂NFA,Ano2 被NFA 抑制,电流明显减小(图6B)。对A 和B 进行分析表明电流和电压关系呈外向整流特性(图6C)。0 nmol/L Ca2+存在的情况下,未记录到电流变化。未转染Ano2的FRT 细胞未记录到电流变化(图6D)。
3 讨论
CaCCs 是一类表达在哺乳动物细胞膜上的阴离子通道,因其被胞质中的Ca2+激活,同时转运细胞中最多的Cl-而得名为CaCCs[1],早在上世纪80年代初于非洲爪蟾卵母细胞上首次记录到经典的CaCCs 电流,相继证实平滑肌、心肌细胞、神经细胞、上皮细胞和内皮细胞均有 CaCCs 表达[2-3]。TMEM16 其家族共有10 个成员,从A~K[4],这个家族拓扑结构相似,目前已证实Ano1 是CaCCs 的分子基础[5]。
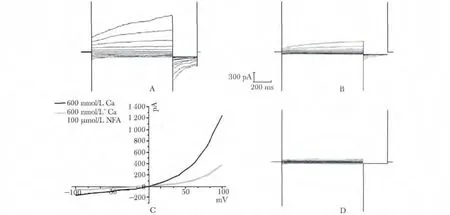
图6 电压变化引起的钙激活氯离子通道电流Fig 6 Calcium-activated chloride currents induced by voltage change
本实验以Ano2 为研究对象,从小鼠视网膜提取Ano2,并建立稳定表达pEGFP-Ano2 的FRT 细胞模型。FRT 细胞具有生长速度较快及贴壁能力强的优点[3],常常作为高通量筛选模型的工具细胞。EGFP 是优化的绿色荧光蛋白的突变型蛋白,作为报告基因敏感度高,荧光显微镜下可实时观察目的基因在活细胞内的动态表达[7],构建C 末端融合有EGFP 的Ano2 真核表达载体,EGFP 示踪显示Ano2在FRT 细胞中的表达与定位。EGFP 表达于FRT 细胞的胞质,而将pEGFP-Ano2 稳定转染至FRT 细胞,细胞膜呈绿色荧光,证实Ano2 表达于细胞膜上。膜片钳技术可以直接观察和分辨离子通道电流并且反映离子通道的电生理特性[8]。FRT 细胞膜上的Ano2 在600 nmol/L Ca2+存在时,电流呈Ca2+、时间和电压依赖性,得到的I/V 曲线呈外向整流,与经典的CaCCs 电流一致,且被CaCCs 的抑制剂NFA 抑制,证实Ano2 是CaCCs 的分子基础。
总之,本实验证实Ano2 是CaCCs 的分子基础。本实验所构建的pEGFP-Ano2 真核表达载体和稳定表达pEGFP-Ano2 的FRT 细胞系为深入研究Ano2在细胞增殖、迁移和凋亡等生理功能中的作用,寻找Ano2 参与离子转运的关键氨基酸及研究不同浓度和不同类型二价阳离子对CaCCs 的影响等奠定良好基础。
[1]Huang F,Wong X,Jan LY.International Union of Basic and Clinical Pharmacology.LXXXV:calcium-activated chloride channels[J].Pharmacol Rev,2012,64:1-15.
[2]Hartzell C,Putzier I,Arreola J.Calcium-activated chloride channels[J].Annu Rev Physiol,2005,67:719-758.
[3]Verkman AS,Galietta LJ.Chloride channels as drug targets[J].Nat Rev Drug Discov,2009,8:153-171.
[4]Hartzell HC,Yu K,Xiao Q,et al.Anoctamin /TMEM16 family members are Ca2+-activated Cl-channels[J].Physiol,2009,587:2127-2139.
[5]Schroeder BC,Cheng T,Jan YN,et al.Expression cloning of TMEM16A as a calcium-activated chloride channel subunit[J].Cell,2008,134:1019-1029.
[6]Hao Feng,Hou Yiju,Zhao Chen,et al.Expression clone of TMEM16A as a calcium-activated chloride channels in CHO cells[J].Advanced Materials Research,2013,709:832-835.
[7]Sample V,Newman RH,Zhang J.The structure and function of fluorescent proteins[J].Chem Soc Rev,2009,38:2852-2864.
[8]Kornreich BG.The patch clamp technique:principles and technical considerations[J].J Vet Cardiol,2007,9:25-37.
