维甲酸定向诱导小鼠核移植胚胎干细胞向雄性生殖细胞分化
2014-03-16李慕军莫曾南
覃 敏,黄 林,李慕军,莫曾南*
(广西医科大学第一附属医院1.人类精子库;2.生殖医学研究中心,广西南宁530021)
男性不育症总发病率逐年升高,其中精子形态异常引起的不育或生殖力低下的占男方因素的30%~40%[1]。目前,能有效治疗男性不育症的方法是辅助生殖技术,但对于内源性生殖细胞缺如无精子症或精子畸形综合征患者,ART 或药物治疗无效[2]。胚胎干细胞(embryonic stem cells,ESCs)可诱导分化为成体器官不同胚层的所有细胞,因此诱导ESCs 在体外分化为雄性生殖细胞,可以为生殖发生提供一个理想的平台[3]。而结合胚胎干细胞技术和体细胞核移植技术,可在体外培育出与患者遗传特征完全相同的核移植胚胎干细胞(nuclear transfer embryonic stem cells,NT-ESCs),为男性不育提供种子细胞的新来源。
NT-ESCs 理论上可分化为各个组织,但男性生殖细胞分化的研究尚少[4-5]。本研究旨在探讨雄性生殖细胞定向诱导分化条件及分子生物学基础。
1 材料与方法
1.1 材料
雌性C57BL/6 小鼠25 g,雌性BALB/c 小鼠25 g[上海斯莱克动物有限公司,许可证号:SCXK(沪)2003-000]。RA、LIF、H-DMEM、bFGF、L-谷氨酰胺、2-巯基乙醇、丝裂霉素C 等(Sigma 公司)。cleavage medium、blastocyst medium(Sage BioPharma公司)。
1.2 NT-ESCs 的培养和鉴定
构建核移植胚胎并检测其DNA 来源[6]。重构胚常规培养,挑取形态典型,未分化的NT-ESCs 集落传代。经形态学、碱性磷酸酶(AKP)染色、核型分析、类胚体实验、体内分化方法鉴定。
1.3 NT-EBs 细胞诱导分化
培养3~4 d 后的NT-EBs 接种于铺有0.1%明胶的24 孔板。加入含2 μmol /L RA、1 000 U/mL LIF、20 ng/ mL 成纤维细胞生长因子、30 ng/mL 干细胞生长因子、0.1 mmol/L 非必需氨基酸、0.1 mmol/L β 巯基乙醇,2 mmol/ L 谷氨酰胺的高糖DMEM 培养液,诱导其向雄性生殖细胞分化,观察NT-EBs 生长和形态变化。设4 组对照组:1)未分化的NT-ESCs;2)分化培养前的NT-EBs;3)无共培养、自主分化的NT-EBs;4)小鼠胚胎成纤维细胞。
1.4 RT-PCR 法检测诱导后雄性生殖细胞发育相关基因的表达
收集培养的NT-EBs 提取总RNA 反转录为cDNA。引物序列及退火温度见表1。PCR 参数:95 ℃预变性4 min,94 ℃45 s,55 ℃~67 ℃45 s,72 ℃1 min,35 个循环,72 ℃10 min。产物电泳,结果以目的基因/β-actin 条带密度比值表示(n=6)。
1.5 间接免疫荧光染色法检测VASA、Scp3 蛋白的表达
共培养12 d 后按间接免疫荧光法,检测分化组和对照组NT-EBs 的VASA、Scp3 蛋白表达,显微镜下观察并照相。判断标准:(-)无荧光;(±)极弱的可疑荧光;(+)荧光较弱,但清楚可见;(+ +)荧光明亮;(+ + +~+ + + +)荧光闪亮。

表1 引物序列和退火条件Table 1 Primer sequences and annealing temperature
1.6 统计学分析
2 结果
2.1 NT-ESCs 的鉴定
NT-ESCs 呈椭圆形或鸟巢状细胞集落,边缘清晰(图1);AKP 染色呈强阳性,集落呈深蓝色(图2A);细胞具有20 对染色体核型的结构(图2B);NT-ESCs悬浮培养能形成简单的NT-EBs,较为致密,形态规则(图2C);体内注射NT-ESCs 可形成畸胎瘤,肿瘤包含源自3 个胚层分化的衍生物(图2,D,E,F)。
2.2 NT-EBs 体外诱导的生长观察
NT-EBs 呈圆球状悬浮于ESCs 培养液,细胞透亮活性好,大小比较均一,内部细胞致密,边缘规则(图3A)。分化培养第4 天部分细胞由梭形或杆状变为圆锥形,培养7 和12 d 的细胞增殖能力强,大而圆形细胞增多(图3C,D)。
2.3 RT-PCR 检测雄性生殖细胞标志物的表达
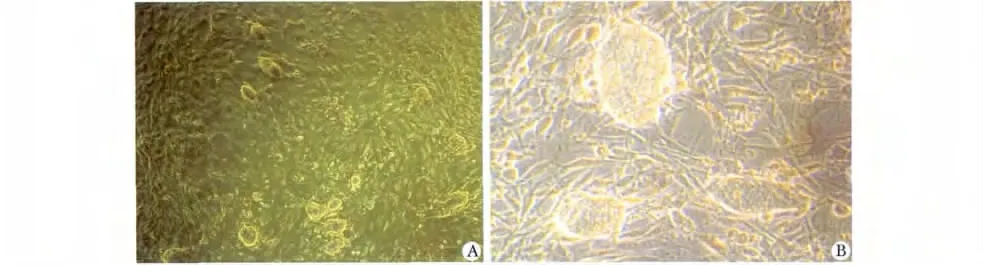
图1 NT-ESCs 形态学特征Fig 1 The morphology of NT-ESCs
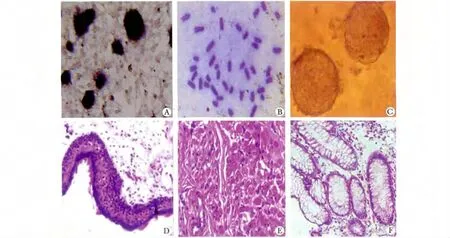
图2 NT-ESCs 的鉴定Fig 2 Identification of NT-ESCs
诱导12 d 后的NT-EBs 能够表达雄性生殖细胞相关的特征基因(VASA、Scp3、Sry、Tex14)。与未分化NT-ESCs(0.68 ± 0.03)相比,诱导后Oct4 的mRNA相对表达量为0.31 ±0.06,呈下调趋势;Vasa,Scp3 和Sry mRNA 相对表达量为:1.03 ±0.08、0.95 ±0.07、1.03 ±0.06,明显上调(P<0.05)。在诱导前和自然分化的NT-EBs 中几乎未能检测到Texl4 的表达。小鼠胚胎成纤维细胞均不表达上述相关基因(图4)。
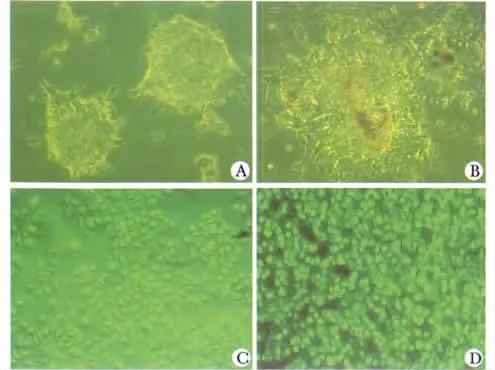
图3 NT-EBs 体外诱导的生长观察Fig 3 Morphology of NT-EBs cultured in vitro

图4 RT-PCR 检测雄性生殖细胞标志物的表达Fig 4 mRNA expression of the genes involved in male germ cells development in NT-ESCs(RT-PCR)
2.4 NT-EBs 细胞VASA 和Scp3 蛋白的表达
诱导后第12 天即可见NT-EBs 细胞表达VASA(+)和Scp3 (+),细胞成簇分布,部分细胞呈现一字形排列;在自然分化对照组NT-EBs 中,未见Scp3 阳性细胞,微弱表达VASA (±)(图5)。
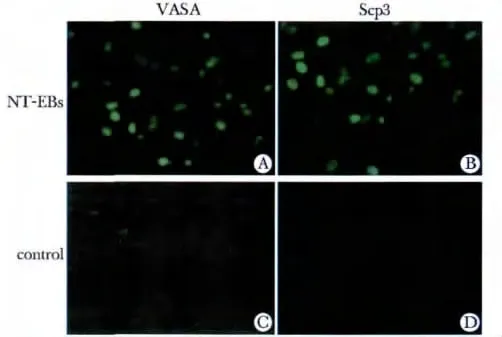
图5 NT-EBs 细胞VASA 和Scp3 的表达Fig 5 VASA and Scp3 positive cells in NT-EBs(×200)
3 讨论
多项研究提示,由ESCs 获得精子的技术是可行的[5,7],基于体细胞核移植技术与胚胎干细胞技术NT-ESCs 向男性生殖细胞分化有可能同时解决移植物来源和免疫排斥这两大难题。本实验构建成功的小鼠NT-ESCs 符合小鼠胚胎干细胞的一系列特性并具有多能性,这为进一步研究组织修复及再生提供了技术平台。
虽然ESCs 已证实可诱导分化为雄性生殖细胞,但分化的效率非常低[8]。既往研究大多采用微环境对ESCs 进行体外诱导,能使细胞在三维空间结构中进行移动并且与微环境相互作用。例如,用骨形态发生蛋白4BMP4、RA 诱导[9-10],或将ESCs体外诱导为原始生殖细胞样细胞进而分化成雄性生殖细胞[11]。目前使用最多的方法是采用EB 的形式,其含有3 个胚层的细胞类型,提供了三胚层细胞间的相互接触模型。目前体外形成EB 的微环境能够支持生殖细胞的发育,并能消除生殖细胞发育早期亲缘印迹[12]。在本实验中我们模拟体内微环境,并经RA 诱导增殖,研究了胚胎干细胞的诱导分化情况。
本实验检测了4 种NT-ESCs 和雄性生殖细胞发育相关基因,Oct4 为NT-ESCs 特异性基因;VASA、Scp3、Sry 和Tex14 这4 个基因为生殖系统特异性表达基因,特别在精子发生中起着重要作用。经诱导后,NT-ESCs 的Oct4 表达减弱,VASA、Scp3、Sry 和Tex14 基因逐渐开始表达,说明RA 可促进NT-ESCs 表达雄性生殖细胞发育相关基因。同时,诱导后的NT-ESCs 表达雄性生殖细胞标志蛋白VASA和Scp3,与报道类似[13]。以上结果提示RA可诱导NT-ESCs 向雄性生殖细胞分化,NT-ESCs 具备向中胚层细胞分化的潜能。但是,本研究分化后的细胞虽表现出雄性生殖细胞的相关蛋白,仅仅是一种前祖细胞,而非一种特定的生殖细胞。
目前,NT-ESCs 技术仍具有优势,核移植技术已可生成人类胚胎干细胞,这一成果具有里程碑意义[14]。因此,进一步精确、规范、增殖和鉴定分化中所涉及到的重要蛋白质的生化性质,筛选出影响诱导分化的关键因素,对NT-ESCs 的定向诱导分化不仅在理论上且在实践中均具有重要的现实意义。
[1]Moskovtsev SI,Mullen JB,Lecker I,et al.Frequency and severity of sperm DNA damage in patients with confirmed cases of male infertility of different aetiologies[J].Reprod Biomed Online,2010,20:759-763.
[2]Larson KL,de Jonge CJ,BarnesAM,et al.Sperm chromatin structure assay parameters as of failed pregnancy following assisted reproductive techniques[J].Hum R eprod,2000,15:1717-1722.
[3]Fadel HE.Developments in stem cell research and therapeutic cloning:Islamic ethical positions,a review[J].Bioethics,2012,26:128-135.
[4]Jung EM,Son HY,Jeung MK,et al.Epigenetic signatures of somatic cell nuclear transfer-derived embryonic stem cells[J].nt J Mol Med,2011,28:697-704.
[5]Nayernia K,J Nolte,HW Michelmann,et al.1n vitro differentiated embryonic stem cells give rise to male gametes that can generate offspring mice[J].Dev Cell,2006,11:125-132.
[6]覃敏,何敏,宣强,等.近交系小鼠体细胞核移植囊胚的微卫星DNA 鉴定[J].基础医学与临床,2009,29:924-928.
[7]Yu Z,Ji P,Cao J,et al.Dazl promotes germ cell differentiation from embryonic stem cells[J].J Mol Cell Biol,2009,1:93-103.
[8]Yamano N,Kimura T,Watanabe-Kushima S,et al.Metastable primordial germ cell-like state induced from mouse embryonic stem cells by AKT activation[J].Biochem Biophys Res Commun,2010,392:311-316.
[9]Toyooka Y,Tsunekawa N,Akasu R,et al.Embryonic stem cells can form germ cells in vitro[J].Proc Natl Acad Sci,2003,100:11457-11462.
[10]Chen W,Jia W,Wang K,et al.Retinoic acid regulates germ cell differentiation in mouse embryonic stem cells through a Smad-dependent pathway[J].Biochem Biophys Res Commun,2012,418:571-577.
[11]Greber B,Wu U,Bememann C,et al.Conserved and divergent roles of FUF signaling in mouse epiblast stem cells and human embryonic stem cells[J].Cell Stem Ce11,2010,8:215-226.
[12]Geijsen N,Horoschak M,Kim K,et al.Derivation of embryonic germ cells and male gametes from embryonic stem cells[J].Nature,2004,427:106-107.
[13]Celso Silva,Jennifer R.Wood,et al.Expression Profile of Male Germ Cell-Associated Genes in Mouse Embryonic Stem Cell Cultures Treated with All-Trans Retinoic Acid and Testosterone[J].Mol Reprod Dev,2009,76:11-21.
[14]Tachibana M,Amato P,Sparman M,et al.Human embryonic stem cells derived by somatic cell nuclear transfer[J].Cell,2013,153:1228-1238.
