经皮三叉神经慢性电刺激对癫痫大鼠的癫痫行为和海马炎性反应抑制作用
2014-03-11王倩倩贺慧艳何龙泉
王倩倩,贺慧艳,左 健,何龙泉,王 玉
癫痫是一种常见的神经系统疾病,其中约有30%~40% 的癫痫为药物难以控制的顽固性癫痫[2],大多数患者因各种原因而不能通过手术治疗,因此,探寻新的有效治疗方法一直是癫痫研究的方向之一。癫痫和偏头痛在发病机制上有着密切的关系,二者在某种程度上均系皮质兴奋性增高性疾病[3,4],而三叉神经刺激在偏头痛预防治疗上已得到有效应用[5,6]。因此,三叉神经电刺激可能对癫痫也同样有预防治疗作用,这在少数临床研究中已得到验证[7]。本研究小组的前期研究证实了在实验性癫痫诱发前予以经皮三叉神经电刺激预处理可能通过增高谷氨酸脱羧酶(GAD)而起到抗癫痫作用[8]。本研究将探讨实验性癫痫引发后予以经皮三叉神经电刺激,以期了解其在慢性癫痫形成中的干预治疗作用,同时通过观察其对炎性因子和小胶质细胞的影响探讨其可能的炎性免疫机制。
1 材料与方法
1.1 实验动物 选用8~12 周龄200~250 g清洁健康雄性SD 大鼠120 只,普通级,由安徽医科大学实验动物中心提供。置于动物实验中心饲养1 w,以适应环境,保持室温26±2 ℃,昼夜12/12 h交替,自由出入获取食物和水。
1.2 试剂与仪器 经皮电刺激仪(KD-2A 型)购自北京博洋生物器械有限公司;匹罗卡品(pilocarpine)购自美国Sigma 公司;IbaⅠ标志物的小胶质细胞抗体购自日本公司;鼠IL-1β 和TNF-α 预包被ELISA 试剂盒均购自美国Invitrogen 公司,免疫组化二抗试剂盒购于北京博奥森生物技术公司;免疫组化二抗试剂盒以及DAB 显色剂购自北京中杉生物技术有限公司。
1.3 实验设计 120 只大鼠适应性饲养1 w后,随机分成正常对照组30 只和实验组90 只。给予实验组大鼠匹罗卡品腹腔注射(380 mg/kg,sigma)诱发癫痫发作至持续状态(SE),致痫前30 min皮下注射甲基-东莨菪碱(1 mg/kg,sigma)以拮抗匹罗卡品胆碱能反应。大鼠行为学观察根据我们修改自Racine5 级评价标准[9]:Ⅰ级:出现面部抽搐、鼻毛抽动、前爪抓耳及咀嚼动作;Ⅱ级:出现点头运动,一侧前肢阵挛;Ⅲ级:出现肢阵挛和轻微的身体抽搐;Ⅳ级:肢体阵挛、甩尾、牙关紧闭、全身抽搐;Ⅴ级:全身阵挛,失去平衡跌倒并全身僵直。III 级或III 级以上行为重复出现者界定为SE 发作。SE 后30 min,腹腔注射地西泮(10 mg/kg)终止发作。死亡率被统计于癫痫持续状态后6 h,共12 只大鼠死于SE,死亡率约13.3%。将SE 中存活的78 只大鼠随机分成单纯匹罗卡品模型组(pilo 组,n=40 只)和经皮三叉神经电刺激组(TNS 组,n=38 只)。
模型建立后2 d 给予实验组动物经皮三叉神经电刺激处理(TNS 组)。操作时动作轻柔,大鼠先腹腔注射10%水合氯醛(350 mg/kg)麻醉动物。TNS组大鼠俯卧固定,将两个模式电极对称外置于眼眶上方约1 cm 中内1/3 处的三叉神经眼支分布区域,固定后外接经皮神经电刺激仪。刺激参数[8]:频率140 Hz、电流10 mA、脉宽0.5 ms、正向脉冲刺激1 min间歇4 min,每天连续刺激60 min。正常对照组和pilo 组实验动物固定后,外接电刺激仪,刺激参数均设置为0,持续60 min。各组操作均在8:00~12:00间进行。
为观察三叉神经电刺激对癫痫大鼠癫痫行为和脑内炎性反应的影响,我们采用本小组以往的再次药物诱发癫痫的方法[10],即实验组各亚组动物进行4 w 的电刺激或假刺激后,再次给予匹罗卡品腹腔注射(320 mg/kg,sigma)致痫,匹罗卡品注射前30 min给予甲基-东莨菪碱(1 mg/kg,sigma)以拮抗匹罗卡品的胆碱能效应。按照前述的癫痫发作分级评价标准进行大鼠行为学观察,比较Pilot 组和TNS组在发作强度、持续时间及6 h 死亡率。
1.4 取材与组织处理 将各组实验大鼠分别在第二次诱发癫痫发作后的24 h、48 h、72 h、7 d、14 d、28 d 以10%水合氯醛(3.5 ml/kg,腹腔注射)麻醉,迅速断头取脑,冰盘内将脑组织沿矢状缝对切成两半,右边脑组织迅速离断,取出海马组织、称重后存入-80 ℃冰箱中,以备Elisa 定量检测细胞因子;左边脑组织放入4%多聚甲醛溶液中固定72 h后,进行组织脱水,石蜡包埋制成石蜡切片。
1.5 Elisa 定量检测细胞因子 待标本采集完毕,将标本从-80 ℃冰箱中取出,按照固定倍数加入生理盐水匀浆,匀浆充分后移入离心管,在4 ℃以3000 r/min 离心20 min,离心后取上清液按待检样品分装后,仍放入-80 ℃冰箱保存,全部操作均在低温条件下完成。Elisa 法检测样本中的IL-1β、TNF-α 的含量,具体方法按照说明书进行,配置标准品、设空白孔、加样、洗板、加检测抗体、洗板、加酶、洗板、显色、终止反应,反应终止10 min 读OD450值,通过Curve Expert 1.3 分析软件绘制标准曲线:由标准方程求出各组样品中IL-1β、TNF-α 的含量。
1.6 免疫组化反应 切片常规脱蜡至水,抗原修复待自然冷却后,依次加入3% H2O2、10% BSA封闭,之后加入小胶质细胞抗体(Iba Ⅰ抗体1∶1000),4 ℃冰箱过夜后滴加二抗工作液及辣根酶,DAB 显色、苏木精复染清洗后冲洗干净,烤干后中性树胶封片。阴性对照用PBS 代替一抗。图像采集在日本Olympus 公司提供的共聚焦显微镜下完成,采用同一曝光度分别对每张切片的海马CA1、CA3、DG 区进行拍照。
2 结果
2.1 TNS 组和pilo 组大鼠痫性发作程度比较经过4 w 的三叉神经电刺激后,再次匹罗卡品致痫,pilo 组5 只大鼠(标准死亡率=1.39>1)、TNS组2 只大鼠(标准死亡率=0.59<1)在发作中死亡,差异有统计学意义。再次匹罗卡品致痫后TNS组大鼠较pilo 组发作程度较轻,持续时间较短(TNS 组平均分为1.8±0.4 分,持续时间13.2±5.2 min,pilo 平均分为3.5±0.9 分,持续时间26.4±5.8 min),差异有统计学意义(P<0.05,P<0.01)(见表1)。

表1 两组大鼠痫性发作程度比较
2.2 海马IL-1β 和TNF-α 蛋白含量比较 正常对照组大鼠海马IL-1β、TNF-α 蛋白含量甚微,癫痫发作后24 h 即可检测出海马IL-1β 和TNF-α 含量显著升高,至72 h 达高峰,至癫痫发作后28 d 仍可检测出较正常对照组显著增高(P<0.05,P<0.01)。TNS 组的IL-1β 和TNF-α 含量变化与Pilo 组基本一致,在癫痫发作后的24 h、48 h、72 h、7 d、14 d、28 d等各时间点TNS 组大鼠海马IL-1β 和TNF-α 含量较正常对照组仍显著增高但较pilo 组均显著减少,差异有统计学意义(P<0.05,P<0.01)(见图1、图2)。

图1 各时间点IL-1β 的平均浓度
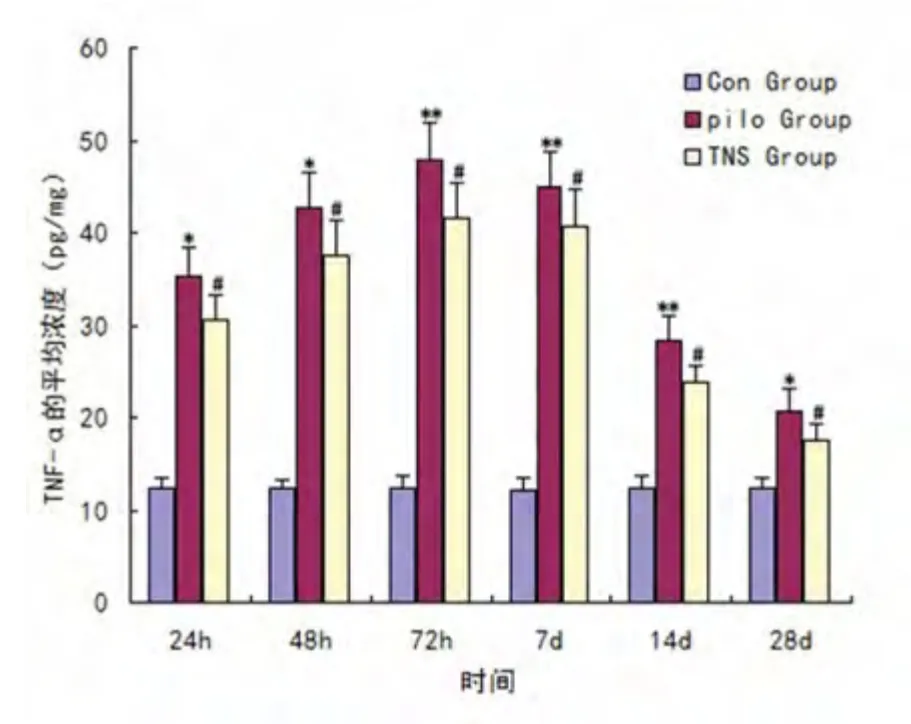
图2 各时间点TNF-α 的平均浓度
2.3 小胶质细胞活化情况比较 对照组大鼠海马Iba1 阳性细胞表达较少,胞体呈圆形或椭圆形,突起较少。Pilo 组和TNS 组阳性细胞着色较深,部分细胞胞体演变成狭长状及梭状,突起增多、增粗,以致痫后7 d 最为明显(见图3、图4)。Pilo 组随癫痫发作后各时间点的延长,呈快速增加趋势(P<0.01),TNS 组的变化趋势与Pilo 组相一致(P<0.05,P<0.01)。TNS 组与Pilo 组比较,TNS 组活化的小胶质细胞的较pilo 组在各时间点均明显减少(P<0.05,P<0.01)(见表2)。

表2 CA1区小胶质细胞活化数量
3 讨论
一次癫痫持续状态(SE)后脑内发生一系列的可塑性改变而致脑兴奋性增高,最终均可发展成为具有自发性反复发作特点的慢性癫痫[11]。而在一次SE 后予以尽早的干预有可能改变这一发展过程从而起到减少癫痫发作的作用。本实验中大鼠致SE 后予以经皮三叉神经电刺激处理4 w,此段时间正是慢性癫痫的形成过程。我们发现与未经三叉神经电刺激的癫痫大鼠相比再次诱发癫痫发作的强度较轻,持续时间较短,死亡率降低。提示慢性三叉神经电刺激对癫痫形成过程中脑兴奋性易感性的形成有干预作用,提高了癫痫发作阈值,即降低了脑兴奋性易感性。有研究表明三叉神经刺激可激活躯体感觉皮质和岛叶皮质的广泛区域[12],因此我们推测三叉神经电刺激所致的长期慢性皮质激活可能使皮质产生一系列兴奋性适应性改变,从而提高了皮质兴奋性阈值。这与培养脑片予以NMDA 受体阻断剂慢性阻断神经元电活动后反而更易记录到癫痫样放电的结果相一致[13,14]。
越来越多的证据表明中枢神经系统的炎性反应参与了慢性癫痫的形成过程[15]。其中促炎因子IL-1β 和TNF-α 在癫痫形成中的作用有较多的研究。SE 或癫痫发作后脑内IL-1β 和TNF-α 含量迅速升高且维持较长时间[16],顽固性癫痫患者脑皮质中IL-1β 含量显著增高[1]。而以药物减少IL-1β 合成或者阻断与其受体结合后能够抑制急性癫痫发作甚至减少慢性癫痫反复发作[17],新近研究更发现这种以药物减少IL-1β 合成还可以干扰慢性癫痫的形成[18]。外源性促炎因子TNF-α 同样有促进癫痫放电的作用[19],而阻断内源性TNF-α 与其受体的结合则抑制癫痫敏感性和相应的病理改变[20]。本实验发现癫痫大鼠经匹罗卡品再次诱发癫痫发作后脑内IL-1β 和TNF-α 含量较正常大鼠显著增高且维持近4 w 的较长时间增高,而三叉神经电刺激干预处理后则各时间点IL-1β 和TNF-α 含量均较未干预组显著下降。提示三叉神经电刺激的抗癫痫作用可能与其降低炎性因子IL-1β 和TNF-α 的表达有关。脑内炎性因子主要产生于小胶质细胞和星形胶质细胞,我们进一步观察了三叉神经电刺激慢性干预后癫痫大鼠再次诱导癫痫发作所引起的海马小胶质细胞反应情况。结果发现三叉神经电刺激处理后癫痫发作活化的小胶质细胞数较未经三叉神经电刺激处理的活化的小胶质细胞数显著减少。提示三叉神经电刺激的抗癫痫作用可能与其降低小胶质细胞活化有关。活化的小胶质细胞可通过产生的促炎细胞因子介导神经元的兴奋性改变参与癫痫的形成过程[21]。结合三叉神经电刺激大鼠促炎因子IL-1β 和TNF-α的表达减少,我们推测三叉神经电刺激可能通过抑制小胶质细胞的激活进而减少IL-1β 和TNF-α 的表达而起到抑制癫痫发作的作用[22]。当然,经由小胶质细胞的其它机制也可能参与了三叉神经电刺激的抗癫痫作用,如激活的小胶质细胞通过释放对慢性癫痫形成有重要影响的脑源性神经生长因子(BDNF)参与癫痫脑兴奋性的改变[23]。本研究主要集中于炎性机制的探讨,三叉神经在脑内的解剖联系远较单纯的感觉传导要复杂的多。三叉神经有分支纤维到达兰斑核,而刺激兰斑核则有显著的抑制惊厥发作的作用[24],毁损兰斑核则可促进慢性癫痫的形成[25]或加重癫痫的自发性反复发作[26],因此本研究的三叉神经电刺激治疗抗癫痫作用也不能排除与经由兰斑核的信号传导有关。
综上,大鼠一次SE 后的慢性癫痫形成过程中,予以经皮三叉神经慢性电刺激处理提高了大鼠再次癫痫发作的阈值,其机制可能与其减轻海马炎性反应有关。关于三叉神经慢性电刺激对SE 后的长期自发性癫痫反复发作的效应尚在进一步观察中。

图3 24 h 和48 h 海马CA1区小胶质细胞活化情况(A2-D2 系A1-D1 的相应放大图像)

图4 72 h 和7 d 海马CA1区小胶质细胞活化情况(A2-D2 系A1-D1 的相应放大图像)
[1]Choi J,Nordli DR,Alden TD,et al.Cellular injury and neuroinflammation in children with chronic intractable epilepsy[J].J Neuroinflammation,2009,6:38.
[2]Kwan P,Brodie MJ.Early identification of refractory epilepsy[J].N Engl J Med,2000,342(5):314-319.
[3]黄 琳,王 玉.偏头痛与癫痫关系的最新进展[J].中华临床医师杂志,2011,5(16):123-126.
[4]李 娜,何龙泉,王 玉.非先兆性偏头痛与慢性偏头痛发作间期皮层兴奋性改变的视觉诱发电位研究[J].中华临床医师杂志,2013,7(2):649-652.
[5]Simopoulos T,Bajwa Z,Lantz G,et al.Implanted auriculotemporal nerve stimulator for the treatment of refractory chronic migraine[J].Headache,2010,50(6):1064-1069.
[6]Reed KL,Black SB,Banta CJ,et al.Combined occipital and supraorbital neurostimulation for the treatment of chronic migraine headaches:initial experience[J].Cephalalgia,2010,30(3):260-271.
[7]DeGiorgio CM,Murray D,Markovic D,et al.Trigeminal nerve stimulation for epilepsy:long-term feasibility and efficacy[J].Neurology,2009,72(10):936-938.
[8]张慧敏,李良勇,李家林,等.经皮三叉神经电刺激预处理对戊四氮致痫大鼠海马谷氨酸脱羧酶表达的影响[J].安徽医科大学学报,2011,46(8):732-736.
[9]Li LY,Li JL,Zhang HM,et al.Treatment reduces hippocampal damage,spontaneous recurrent seizures,and learning memory deficits in pilocarpine-treated rats[J].J Mol Neurosci,2012,50(1):109-123.
[10]Wang Y,Liu PP,Li LY,et al.Hypothermia reduces brain edema,spontaneous recurrent seizure attack,and learning memory deficits in the kainic acid treated rats[J].CNS neuroscience & therapeutics,2011,17(5):271-280.
[11]Navarro Mora G,Bramanti P,Osculati F,et al.Does pilocarpine-induced epilepsy in adult rats require status epilepticus[J]?PloS one,2009,4(6):e5759.
[12]Lotsch J,Walter C,Felden L,et al.The human operculo-insular cortex is pain-preferentially but not pain-exclusively activated by trigeminal and olfactory stimuli[J].PloS one,2012,7(4):e34798.
[13]Wang XM,Bausch SB.Effects of distinct classes of N-methyl-D-aspartate receptor antagonists on seizures,axonal sprouting and neuronal loss in vitro:suppression by NR2B-selective antagonists[J].Neuropharmacology,2004,47(7):1008-1020.
[14]He S,Shao LR,Wang Y,et al.Synaptic and extrasynaptic plasticity in glutamatergic circuits involving dentate granule cells following chronic N-methyl-D-aspartate receptor inhibition[J].Journal of Neurophysiology,2013,109(6):1535-1547.
[15]D’Ambrosio R,Eastman CL,Fattore C,et al.ovel frontiers in epilepsy treatments:preventing epileptogenesis by targeting inflammation[J].Expert Review of Neurotherapeutics,2013,13(6):615-625.
[16]Pernot F,Heinrich C,Barbier L,et al.Inflammatory changes during epileptogenesis and spontaneous seizures in a mouse model of mesiotemporal lobe epilepsy[J].Epilepsia,2012,52(12):2315-2325.
[17]Maroso M,Balosso S,Ravizza T,et al.Interleukin-1beta biosynthesis inhibition reduces acute seizures and drug resistant chronic epileptic activity in mice[J].Neurotherapeutics,2011,8(2):304-315.
[18]Ravizza T,Noe F,Zardoni D,et al.Interleukin Converting Enzyme inhibition impairs kindling epileptogenesis in rats by blocking astrocytic IL-1beta production[J].Neurobiology of dDisease,2008,31(3):327-333.
[19]Shandra AA,Godlevsky LS,Vastyanov RS,et al.The role of TNFalpha in amygdala kindled rats[J].Neurosci Res,2002,42(2):147-153.
[20]Weinberg MS,Blake BL,McCown TJ.Opposing actions of hippocampus TNFalpha receptors on limbic seizure susceptibility[J].Experimental Neurology,2013,247:429-437.
[21]Devinsky O,Vezzani A,Najjar S,et al.Glia and epilepsy:excitability and inflammation[J].Trends Neurosci,2013,36(3):174-184.
[22]Zheng H,Zhu W,Zhao H,et al.Kainic acid-activated microglia mediate increased excitability of rat hippocampal neurons in vitro and in vivo:crucial role of interleukin-1beta[J].Neuroimmunomodulation,2010,17(1):31-38.
[23]Ferrini F,De Koninck Y.Microglia Control Neuronal Network Excitability via BDNF Signalling[J].Neural plasticity,2013,2013:429815.
[24]Jimenez-Rivera C,Voltura A,Weiss GK.Effect of locus ceruleus stimulation on the development of kindled seizures[J].Experimental neurology,1987,95(1):13-20.
[25]Corcoran ME,Mason ST.Role of forebrain catecholamines in amygdaloid kindling[J].Brain research,1980,190(2):473-484.
[26]Giorgi FS,Ferrucci M,Lazzeri G,et al.A damage to locus coeruleus neurons converts sporadic seizures into self-sustaining limbic status epilepticus[J].The European Journal of Neuroscience,2003,17(12):2593-2601.
