G-CSF 对脑出血大鼠血肿周围血管新生的作用机制研究
2014-03-11何晓英刘永刚李小刚
何晓英,付 华,刘永刚,李小刚
随着我国老龄化进程加剧,脑出血(Intracerebral Hemorrhage,ICH)发病率正呈现弓背式抬高,然而ICH 病理机制复杂,基础性研究较脑梗死薄弱,目前除采取内科脱水降低颅内压减轻脑水肿、外科手术清除血肿等外,尚缺乏有效干预措施改善临床终点事件。近年来,应用三维成像技术在缺血性脑血管病的研究中发现大鼠患侧新生脑血管计数大于健侧,且患侧脑组织微血管的密度增高与预后成正相关[1],在实验性ICH 模型中也发现血肿周围同样存在新生血管生成,且血肿周围血管新生、微循环系统的重建在脑组织修复、神经元抗损伤的过程中扮演着重要角色[2]。粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)是体内一种多肽链细胞生长因子,能刺激造血祖细胞增殖、分化,在临床广泛用于化疗引起的中性粒细胞减少等。越来越多的研究表明,G-CSF 作为一种新型神经保护因子,可透过血脑屏障,通过抑制细胞调亡、动员骨髓干细胞、减轻炎症反应等机制,在中枢神经系统发挥重要的非造血功能[3,4]。因此,本研以ICH 后微血管新生为切入点,探讨G-CSF 对ICH 新生血管的影响及作用机制。
1 材料和方法
1.1 材料
1.1.1 主要实验试剂及仪器 重组人粒细胞集落刺激因子注射液(rhG-CSF,深圳新鹏公司);CD34 抗体、VEGF 抗体、二抗、SABC 试剂盒、DAB 显色试剂盒、PBS 缓冲液(武汉博士德公司)。WDT-V型鼠脑立体定向仪(西安西北光电仪器厂);50 μl 微量进样器(上海激光医学仪器厂)。
1.1.2 实验动物及处理 63 只体重为250~320g 的健康SD 大鼠由泸州医学院实验动物中心提供,随机分成假手术组(n=21)、ICH 组(n=21)、治疗组(n=21),每组又分为6 h、24 h、48 h、72 h、7 d、14 d、21 d 7 个亚组(n=3)。治疗组于造模1 h 后腹腔注射rhG-CSF 60 μg/kg,假手术组、ICH 组仅经腹腔注入相同容积的等渗盐水。
1.2 方法
1.2.1 大鼠ICH 模型制作 SD 大鼠术前禁食12 h,2%戊巴比妥钠(50 mg/kg)腹腔注射后,将其俯卧位固定在立体定位仪上,无菌操作暴露前囟,用小型牙科钻钻透颅骨至硬脑膜处,定位于前囟前0.2 mm、中线右侧旁开3 mm、深6 mm 为注血点,将非肝素抗凝断尾获取的动脉血50 μl,先注入10 μl,停针2 min,后缓慢注入40 μl,整个注血时间约5 min,注血完毕后留针15 min,再缓慢退针。术后青霉素粉末涂抹局部,缝合皮肤。所用手术器械均经高压灭菌消毒,整个手术过程无菌操作。假手术组:参照上述方法,经注入点注入等量无菌生理盐水。
1.2.2 ICH 大鼠各时间点神经功能障碍评分
各组大鼠分别于术后6 h、24 h、48 h、72 h、7 d、14 d、21 d 处死前按Garcia 的方法进行神经功能评分,最高分18 分,最低分3 分,分数越低,神经功能障碍越重。
1.2.3 CD34、VEGF 免疫组化检测 实验动物于术后6 h、24 h、48 h、72 h、7 d、14 d、21 d 麻醉,经主动脉灌注4%多聚甲醛内固定后断头取脑,外固定石蜡包埋,自动切片机按片厚5 μm 进行连续切片。按照免疫组织化学试剂盒说明进行染色。
各组于相应时间点每只大鼠每个指标选取一张脑切片,在400 倍光镜下进行观察。(1)CD34 主要定位于较早的血管内皮细胞,代表新生血管,任何染成棕黄色或棕褐色的内皮或内皮细胞簇均为1 个血管计数,每张切片计数5 个不同视野下CD34+血管数;(2)胞浆内出现棕黄色颗粒视为VEGF 阳性细胞,每张切片计数5 个不同视野下阳性细胞数。
1.3 统计学处理
2 结果
2.1 神经功能障碍评分
ICH 后出现不同程度的神经功能缺损,各时间点神经功能障碍评分均低于假手术组(P<0.05),48 h~72 h 症状达高峰。治疗组6 h 神经功能障碍评分与ICH 组比较无显著差异,6 h 后各时间点神经功能障碍评分明显高于ICH 组(P<0.05)(见表1)。
2.2 G-CSF 对ICH 大鼠CD34+血管数的影响
CD34 阳性反应主要在幼稚的新生血管内皮细胞表达,内皮细胞胞膜中出现棕黄色颗粒为阳性染色。假手术组仅见少许CD34+血管表达;ICH 组CD34+血管数从6 h 开始增多,14 d 达高峰,各时间点均较假手术组显著增加(P<0.05);治疗组CD34+血管数高峰提前至7 d,14 d 时仍维持在较高水平,各时点较ICH 组明显增多(P<0.05)(见表2)。
2.3 G-CSF 对ICH 大鼠VEGF 表达的影响
VEGF 蛋白主要分布于神经元、内皮细胞、胶质细胞的胞浆中,胞浆成棕黄色为VEGF 阳性细胞。假手术组仅见少量VEGF 阳性细胞表达;ICH 组VEGF 阳性细胞数从6 h 开始增多,7~14 d 达高峰,21 d 明显减少,各时间点与假手术组比较明显增多,具有统计学差异(P<0.05);治疗组各时间点VEGF阳性细胞数较ICH 组明显增多(P<0.05),高峰提前至72 h~7 d,14 d 仍持续较高水平表达(见表3)。
表1 各组不同时间点神经功能障碍评分(±s)

表1 各组不同时间点神经功能障碍评分(±s)
与假手术组比较△P<0.05;与ICH 组内其他时间点比较#P<0.05;与ICH 组比较▽P<0.05
表2 术后各组不同时间点CD34+血管数比较(±s 个数/视野)
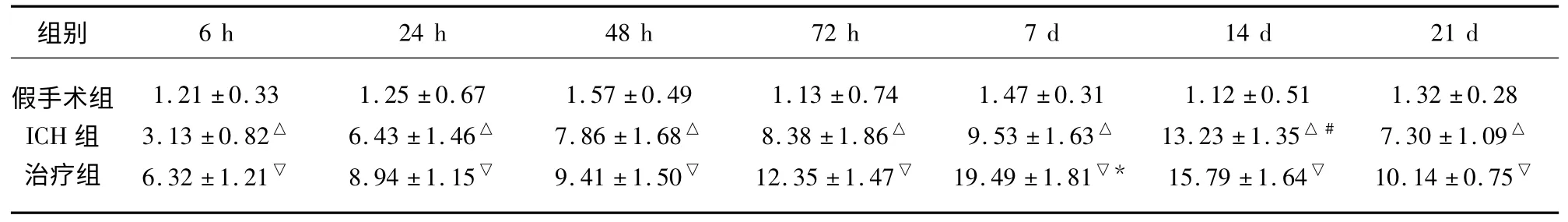
表2 术后各组不同时间点CD34+血管数比较(±s 个数/视野)
与假手术组比较△P<0.05;与ICH 组内其他时间点比较#P<0.05;与ICH 组比较▽P<0.05;与治疗组内其他时间点比较* P<0.05
表3 各组不同时间点VEGF 阳性细胞计数(±s,个数/视野)

表3 各组不同时间点VEGF 阳性细胞计数(±s,个数/视野)
与假手术组比较△P<0.05;与ICH 组内其他时间点比较#P<0.05;与ICH 组比较▽P<0.05;与治疗组内其他时间点比较* P<0.05
3 讨论
G-CSF 属造血生长因子家族的一员,已在临床长期广泛应用,对人体安全性已无需置疑,其生物学特性除影响粒细胞系统外,还可发挥神经营养及神经保护作用。Laske 等实验中发现早期阿尔茨海默病患者血浆中G-CSF 明显降低,提出了外源性GCSF 有望成为治疗阿尔茨海默病的新策略[5]。Pitzer等观察到脊髓损伤后G-CSF 可以抑制其细胞凋亡和促进神经再生[6]。Sevimli 等从基因水平证实G-CSF治疗的脑梗死大鼠,梗死灶显著缩小,神经功能恢复良好[7]。本实验前期研究也证实G-CSF 通过抑制MMP-9 表达减轻ICH 大鼠血肿周围水肿程度、抑制星型胶质细胞过度活化发挥神经保护作用[8]。最近Sugiyama 等还在实验中观察到G-CSF 通过促进脑梗死后血管新生、改善脑血流灌注、从而减轻脑损伤[9],而G-CSF 对ICH 后血管新生的影响尚未见报道。
ICH 后血肿水肿对血管床压迫、血管活性物质引起血管痉挛、凝血衍生因子释放、血脑屏障破坏、神经元和内皮细胞凋亡等,诸多因素的主要损伤靶点除神经元外,也包括微血管系统,造成脑血流障碍,最终导致血流高度依赖的脑组织受损表现出一系列神经功能缺损症状[10]。因此,ICH 后促进微血管新生、改善脑血流状况具有重要意义。实验已证实大鼠ICH 后7 d 在血肿周围可见壁薄、扩张的新生血管,14 d 新生血管开始伸入血肿内,并且血管新生的时程特点与ICH 大鼠的运动功能恢复过程一致,提示ICH 后机体发挥自我修复功能,神经功能恢复可能部分是血管新生的结果[11]。Xi 等进一步验证了血管新生的程度与ICH 的存活及阻止损伤引起的神经变性呈正相关,血管密度可作为判定ICH 预后和预测神经功能恢复的指标[12]。
血管新生是微循环重建的主要途径,指在各种病损诱导下,在已存在的血管基础上内皮细胞通过出芽、修剪、内填、套迭等方式重建新的血管网络[13]。新生的微血管主要由内皮细胞构成,所以可以利用内皮细胞标志性抗原的变化来了解微血管的生成情况,标志性抗原越多,新生血管也越多。CD34抗原是一种高度糖基化的I 型跨膜糖蛋白,在生理情况下CD34 抗原可在血管内皮细胞中表达,黏附、加速血管前内皮细胞聚集,在一定的条件下分化成内皮细胞参与血管生成;在病理损害或体外细胞因子的刺激下,CD34 抗原被动员出骨髓,并定向迁移到损伤部位参与并增强局部血管重建。研究发现大多数CD34 细胞是毛细血管内皮细胞的祖细胞,在两相邻的内皮细胞未完全发育形成紧密连接时表达CD34,即在内皮细胞的增生、运动和迁移阶段表达CD34,而成熟后则为CD34 阴性血管[14]。因此,CD34 抗原在新生血管内皮中表达远远大于非新生血管内皮,是最敏感的新生血管内皮标记物,CD34阳性表达是检测早期新生血管的良好方法。本实验检测了ICH 后的血管新生情况,结果显示ICH 组血肿周围CD34+血管数从6 h 开始增多,并逐渐增加,到14 d 达高峰,各时间点均高于假手术组,提示ICH后在一系列病理改变介导下机体发挥自我修复功能,新生血管明显增多,为出血后神经发生、突触重建和损伤神经元修复创造良好的微环境,为损伤区域神经功能康复奠定基础[15]。而经G-CSF 干预后,治疗组各时间点CD34+血管数表达较ICH 组明显增多,高峰提前至7 d,14 d 时仍维持在较高水平,提示G-CSF 作用下ICH 中CD34 新生血管阳性表达高峰提前,高水平表达时间延长,说明G-CSF 能够明显增加ICH 后血肿周围新生血管数量,从而改善脑血流状况,充足的脑血流一方面有助于神经元获取能量、利于神经再生,另一方面也有助于药物到达病灶充分发挥药物效能,促进功能恢复。
血管新生过程的调控和信号传导复杂而严格,除单核细胞、细胞粘附分子-1 外,血管生长因子、细胞外基质大分子、细胞活素类等多种刺激和抑制因子也参与了调控,其中血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)是迄今为止唯一被证明对血管形成起关键作用且具有特异性的生长调节因子[16],对血管新生的突出作用是作为内皮细胞促有丝分裂原促进内皮细胞增殖、加速新生血管形成。正常机体内VEGF 呈持续低水平表达,以维持原有血管密度及维持血管对运输营养物质所需通透性的作用,而在缺血缺氧、外伤、炎症、肿瘤等脑损伤的病理过程中VEGF 表达明显上调,通过VEGFR-1 和VEGFR-2 两个受体结合促进血管新生,从而重建损伤组织的代谢和营养系统[17]。动物实验证明脑梗死2 h 后VEGFmRNA 即明显表达,14 d 达高峰,28 d 后仍维持在较高水平,VEGF 表达极度上调后,微血管密度增加明显,从而可有效改善缺血半暗带的血供[18]。Lei 等在胶原酶诱导的ICH 模型中发现,术后血肿周围VEGF 即开始上升,并且持续到7~14 d,促进神经功能恢复[19]。VEGF 表达明显上调有利于新生血管的生成,在早期促进血管内皮细胞的增殖和迁移,在后期能促进新生血管的成熟与稳定,同时可以改善组织缺血缺氧、减轻脑水肿及促进神经干细胞增殖而发挥神经保护作用[20]。本研究观察到ICH 后血肿周围VEGF 从6 h 开始逐渐增多,7 d~14 d 达高峰,21 d 时表达减少,与Lei 等的报道基本一致,提示ICH 后发生的一系列病理改变诱导机体启动自我保护和恢复机制,上调VEGF 表达,可促进微血管新生、有利于改善微循环状态。经G-CSF 干预后,各时间点血肿周围VEGF 表达明显高于ICH 组,且VEGF 高峰提前出现并维持在较高水平,与CD34 微血管阳性表达趋势基本一致,提示G-CSF 可上调ICH 后VEGF 的表达,诱导ICH 损伤区新生血管形成。从实验中我们也观察到经G-CSF治疗后,与未进行干预的ICH 大鼠比较其神经功能恢复状况明显好转。
ICH 后G-CSF 干预可促进新生血管生成,利于神经功能恢复,作用机制推测是上调了VEGF 表达,但确切调控及信号传导机制有待进一步研究。
[1]Morris DC,Yeich T,Khalighi MM,et al.Microvascular structure after embolic focal cerebral ischemia in the rat[J].Brain Res,2003,972(1-2):31-37.
[2]Zhou HJ,Zhang HN,Tang T,et al.Alteration of thrombospondin-1 and-2 in rat brains following experimental intracerebral hemorrhage.Laboratory investigation[J].J Neurosurg,2010,113(4):820-825.
[3]Solaroglu I,Cahill J,Tsubokawa T,et al.Granulocyte colony-stimulating factor protects the brain against experimental stroke via inhibition of apoptosis and inflammation[J].Neurol Res,2009,31(2):167-172.
[4]Yu SC,Kuo CL,Huang CS,et al.Endogenous granulocyte colonystimulating factor:a biomarker in acute ischemic stroke[J].Biomarkers,2012,17(4):319-324.
[5]Laske C,Stellos K,Stransky E,et al.Decreased Plasma Levels of Granulocyte-Colony Stimulating Factor(G-CSF)in Patients with Early Alzheimer’s Disease[J].J Alzheimers Dis,2009,17(1):115-123.
[6]Pitzer C,Klussmann S,Krüger C,et al.The hematopoietic factor granulocyte-colony stimulating factor improves outcome in experimental spinal cord injury[J].J Neurochem,2010,113(4):930-942.
[7]Sevimli S,Diederich K,Strecker JK,et al.Endogenous brain protection by granuloeyte-colony stimulating factor after ischemic stroke[J].Exp Neurol,2009,217(2):328-335.
[8]何晓英,付 华,袁 平,等.粒细胞集落刺激因子对脑出血大鼠脑水肿及星型胶质细胞的影响[J].中风与神经疾病杂志,2013,30(5),404-408.
[9]Sugiyama Y,Yagita Y,Oyama N,et al.Granulocyte Colony-Stimulating Factor Enhances Arteriogenesis and Ameliorates Cerebral Damage in a Mouse Model of Ischemic Stroke[J].Stroke,2011,42(3):770-775.
[10]Hua Y,Keep RF,Gu Y,et al.Thrombin and brain recovery after intracerebral hemorrhage[J].Stroke,2009,40(3 Suppl):S88-89.
[11]Tang T,Liu XJ,Zhang ZQ,et al.Cerebral angiogenesis after eollagenase-indueed intraeerebral hemorrhage in rats[J].Brain Res,2007,1175:134-142.
[12]Xi G,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J].Lancet Neurol,2006,5(1):53-63.
[13]Sadanandam A,Rosenbaugh EG,Singh S,et al.Semaphorin 5A promotes angiogenesis by increasing endothelial cell proliferation,migration,and decreasing apoptosis[J].Microvasc Res,2010,79(1):1-9.
[14]汪国文,王祖义,刘学刚,等.CD31 与CD34 显示非小细胞肺癌微血管密度的对比分析[J].蚌埠医学院学报,2009,34(3),185-187.
[15]Shang J,Deguchi K,Ohta Y,et al.Strong neurogenesis,angiogenesis,synaptogenesis,and antifibrosis of hepatocyte growth factor in rats brainafter transient middle cerebral artery occlusion[J].J Neurosci Res,2011,89(1):86-95.
[16]Higuchi T,Wester HJ,Schwaiger M.Imaging of angiogenesis in cardiology[J].Eur J Nucl Med Mol Imaging,2007,34(Suppl 1):S9-19.
[17]Shimotake J,Derugin N,Wendland M,et al.Vascular endothelial growth factor receptor-2 inhibition promotes cell death and limits endothelial cell proliferation in a neonatal rodent model of stroke[J].Stroke,2010,41(2):343-349.
[18]Chen B,Cheng Q,Yang K,et al.Thrombin mediates severe neurovascula injury during ischemia[J].Stroke,2010,41(10):2348-2352.
[19]Lei C,Lin S,Zhang C,et al.Effects of high-mobility group box1 on cerebral angiogenesis and neurogenesis after intracerebral hemorrhage[J].Neuroscience,2013,15(229):9-12.
[20]Sun J,Zhou W,Ma D,et al.Endothelial cells promote neural stem cell proliferation and differentiation associated with VEGF activated Notch and Pten signaling[J].Dev Dyn,2010,239(9):2345-2353.
