GDNF 及dbcAMP 对神经干细胞诱导分化为多巴胺能神经元作用的实验研究
2014-03-11吕晓红
陈 立,杜 娟,陈 丽,吕晓红
帕金森病(Parkinson’s Disease,PD)是中老年人常见的神经系统变性疾病,主要病理变化是路易小体形成和黑质多巴胺能神经元丢失,目前的治疗只能通过多巴胺替代疗法改善其症状,并不能阻止病情的进展。神经干细胞的全能性和成体干细胞横向分化的多潜能性为帕金森的治疗提供了新的思路和方法。本实验利用神经营养因子GDNF 及dbcAMP 对神经干细胞进行单独及联合诱导,希望能获得足够数量的多巴胺能神经元,为定向诱导分化的神经元进一步应用于临床打下基础。
1 材料与方法
1.1 动物 清洁级孕14~16 d Wistar 大鼠由吉林大学动物中心提供。
1.2 试剂 培养基DMEM/F12、B27(Gibco)、碱性成纤维细胞生长因子(bFGF)、表皮细胞生长因子(EGF)和胶质细胞源性神经营养因子(GDNF)(Peprotech),胎牛血清(FBS)(杭州四季青公司),二丁酰环磷腺苷酸(dibutyryl adenosine 3’,5’cyclic monophosphate,dbcAMP)(Santa),兔抗鼠神经元特异性中间丝(Neuron-specific intermediate filament,Nestin)、兔抗鼠5-溴脱氧尿苷(5-Bromodeoxyuridine,Brdu)、兔抗鼠络氨酸羟化酶(TH)多克隆抗体、山羊抗兔免疫组化试剂盒、异硫氰酸荧光素(FITC)标记山羊抗兔IgG(武汉博士德公司)。
1.3 神经干细胞的体外分离及原代培养 神经干细胞的体外分离与培养 取妊娠14~16 d 的Wistar 大鼠,给予乙醚吸入麻醉,无菌操作取出胚胎,置于冰浴的无菌磷酸盐缓冲液(PBS)内,分离胚胎中的脑组织,小心剥离脑膜及血管,将取出的脑组织剪成小组织块,加入0.125% 胰蛋白酶消化30 min 左右,用含10% 胎牛血清终止消化,0.01%DNaseI 继续对脑组织消化30 min 左右,离心,将离心后的细胞悬浮于干细胞培养基中,培养基包含bFGF 20 ng/ml 和EGF 20 ng/ml 及DMEM/F12 培养基(另含2% B27,HEPES 10 mmol/L,谷氨酰胺2 mmol/L,青霉素100U/ml,链霉素100 U/ml),调整细胞密度至5×105/ml,接种至25 ml 培养瓶。在37℃饱和湿度、5% CO2/95%空气的二氧化碳培养箱中培养。每2~3 d 半量换液1 次,7 d 传代1 次。
1.4 神经干细胞的鉴定 待培养至1 w 左右时取细胞悬液1 瓶,细胞离心(1000 r/min,5 min)后弃上清,重悬,吸管吹打分离细胞克隆,注意力度要适当均匀,重新细胞计数后以5×104/ml 接种于装有细胞爬片的24 孔板内,进行Nestin 及Brdu 鉴定。
1.5 NSC 的诱导分化 取第2 代的NSC 以1×105/ml 的密度接种于置有预先经多聚赖氨酸包被盖玻片的24 孔培养板。分别加入以下培养液:A组(对照组)DMEM/F12+10% FBS+2% B27,B组加入20 ng/ml GDNF,C 组加入200 μmol/L dbcAMP,D 组加入200 μmol/L dbcAMP+20 ng/ml GDNF。每组3 孔,以后每3 d 半量换液1 次,分化7 d 后终止诱导。
1.6 免疫细胞化学染色 取出终止诱导的细胞爬片,0.01 mol/L PBS(pH 7.4)洗3 次,4%多聚甲醛固定15 min,0.3% TritonX-100 中室温下孵育标本15 min,3% H2O2(0.01 mol/L PBS 配制)处理标本10 min,一抗分别为小鼠抗人Nestin 单克隆抗体,兔抗Brdu(1∶100),兔抗TH 多克隆抗体,4 ℃湿盒过夜(一抗用PBS 稀释),滴加二抗37 ℃孵育标本30 min,滴加试剂SABC,20~37 ℃条件下20 min,DAB 避光显色5~10 min,苏木素复染,自来水返蓝,中性树胶封片,显微镜下观察,拍照。
1.7 统计学分析 免疫细胞化学染色TH 阳性的细胞代表多巴胺(Dopamine,DA)能神经元。TH 阳性细胞数/总细胞数×100%即为所得TH 阳性细胞率。所有数据经SPSS 13.0 统计软件处理,实验结果采用±s 表示,TH 细胞阳性率的多组样本均数的比较用单因素方差分析。P<0.05差异有统计学意义。
2 结果
2.1 孕14~16 d Wistar 大鼠无血清培养
在无血清,神经营养因子培养条件下,24 h 可见少量细胞贴壁(见图1),大部分细胞悬浮生长,部分细胞分裂成3~4 个细胞团,随着时间推移,细胞团数量逐渐增多,体积增大,大部分悬浮生长,成球形,折光性较好,无细胞突起(见图2),培养至1 w倒置显微镜观察可见大量悬浮生长的神经球,少量神经球贴壁并有突起。
2.2 Nestin 鉴定
收集培养1 w 的神经干细胞球制作细胞爬片,行免疫细胞化学染色鉴定,结果显示神经球呈现棕黄色,表明其具备干细胞特性(见图3、图4)。
2.3 Brdu 鉴定
收集细胞前24 h 给予Brdu,后制作细胞爬片,行免疫细胞化学染色,结果显示大部分神经球呈现棕黄色,与对照组相比具有明显差异,表明其具备干细胞增殖分化的能力(见图5、图6)。
2.4 神经干细胞向多巴胺能神经元分化的鉴定
2.4.1 血清分化组 通过免疫细胞化学鉴定,TH 阳性细胞数目很少,平均阳性率0.67%(见图7)。
2.4.2 实验组A(不同剂量组GDNF 诱导神经干细胞分化)加入GDNF10 μg/L,20 μg/L 及40 μg/L 分化1W 平均阳性率为7.1%,10.2%,10.0%。GDNF 组与血清对照组相比具有统计学意义(P<0.05),GDNF 在20 μg/L 浓度诱导下分化效率最高(见图8、图9),GDNF 在40 μg/L 时分化率没有明显提高。
2.4.3 实验组B(不同剂量组dbcAMP 诱导神经干细胞分化)加入dbcAMP100 μmol/L,200 μmol/L 及400 μmol/L 分化1W 平均阳性率为4.56%,7.99%,7.25%。dbcAMP 组与血清对照组相比具有统计学意义(P<0.05),dbcAMP 在200 μmol/L 浓度诱导下分化效率最高(见图10、图11),dbcAMP 在200 μmol/L 及400 μmol/L 浓度设置下TH 细胞阳性率差别不大。
2.4.4 实验 组C(GDNF20 μg/L 联合dbcAMP200 μmol/L 诱导分化)选取GDNF 及dbcAMP 单独诱导时TH 细胞阳性率最高时的浓度进行组合,分别加入GDNF20 μg/L,dbcAMP200 μmol/L,分化1W 后TH 细胞平均阳性率为13.36%,与单独诱导时分化率相比可进一步提高(见图12),具有统计学意义(P<0.05)。
表1 GDNF 及dbcAMP 联合诱导分化后TH 阳性细胞表达率(%,±s)

表1 GDNF 及dbcAMP 联合诱导分化后TH 阳性细胞表达率(%,±s)
各实验组分别与A 组比较△P<0.05;B 组、C 组分别与D 组比较* P<0.05
3 讨论
1992 年Reynolds 和Richards 最先从成年鼠的纹状体和海马中分离出能够进行自我更新的多潜能细胞群落,由此提出了神经干细胞(neural stem cells,NSCs)的概念。2000 年Gage[1]将神经干细胞概括为可生成神经组织或者来源于神经系统的具有自我更新能力并且能够通过不对称细胞分裂产生新细胞。神经干细胞具有多向分化及自我更新的能力,其主要生物学属性包括:(1)自我更新能力;(2)多向分化能力;(3)良好的细胞整合能力;(4)低免疫原性。
神经干细胞存在于哺乳动物神经系统的多个部位,目前已从胚胎期哺乳动物的皮质区、海马、纹状体、嗅球、侧脑室、间脑、中脑、小脑、脊髓和视网膜中分离得到了干细胞[2,3],成年期的哺乳动物神经干细胞主要存在于侧脑室脑室下区及海马齿状回颗粒细胞下区[4]。
3.1 NSCs 定向分化中多巴胺能相关诱导剂应用机制的探讨
目前神经干细胞培养中涉及到多种诱导机制。张文治[5]对人胚大脑神经干细胞增殖与分化的实验研究表明,EGF 和bFGF 协同作用效果明显优于单用,另外Svendsen[6]利用EGF 和FGF-2 体外诱导出能够长期生存的人类中枢神经系统前体细胞,并成功移植入帕金森病大鼠模型。本实验从孕15 d 胎鼠脑组织中提取干细胞并进行无血清培养及传代,对于神经干细胞的鉴定主要采用应用比较广泛的Nestin 蛋白及Brdu 蛋白进行标记。并采用EGF 和bFGF 联合培养,浓度均为20 μg/L,培养结果显示二者联合应用可极大的促进神经干细胞的增殖。
B27 是一种神经细胞生长添加剂,由于含有抗氧化剂等成分,能够减少神经细胞的损伤,被广泛应用于中枢神经细胞的原代培养。因此本实验中也加入了神经细胞添加因子以促进神经干细胞的增殖。GDNF 是1993 年Lin 等发现并克隆出来的,它是一种神经营养因子,是转化生长因子家族中的一员。
GDNF 广泛分布于中枢神经系统的的多巴胺区域,在腹侧苍白球、嗅结节、梨状区等也有表达[7]。近年来,随着神经干细胞的大量深入研究,GDNF 在其中的作用越来越重要,GDNF 不仅对多巴胺能神经元具有营养、支持、保护和修复作用,而且在神经干细胞分化为多巴胺能神经元中也起着重要作用。研究表明,GDNF 主要是通过其受体发挥作用的[8]。因此本实验在细胞培养液中添加GDNF 促进干细胞的分化及维持多巴胺神经元的健康生长。
dbcAMP 是一种重要的细胞内分子,它作为第二信使,是细胞内媒介物,在细胞内它可在腺苷酸环化酶的作用下促使cAMP 合成,其诱导分化作用与其升高细胞内cAMP 程度有关。Tio 等[9]利用dbcAPM及IBMX 对间充质干细胞进行诱导,发现分化的细胞表达多巴胺能神经元早期蛋白Nurr1 及TH 蛋白;Roger 等[10]利用dbcAPM 对小鼠神经瘤细胞(Neuro-2a,N2a)进行诱导分化,发现dbcAPM 能极大的提高TH 细胞的阳性表达率,在dbcAMP 的作用下骨髓间充质干细胞(mesenchymal stem cells,MSC)及N2a 细胞均可表达DA 能神经元标记蛋白,因此本实验利用dbcAMP 对NSCs 进行诱导分化,虽然分化比例较低,但仍有TH 阳性细胞表达,且与GDNF 联合诱导有较高的TH 细胞表达率,目前关于dbcAMP 在NSCs 分化中的作用机制仍不十分明确。
3.2 GDNF 和dbcAMP 在NSCs 向多巴胺能神经元定向分化中的诱导效应及有效剂量的探讨
Majd 等[11]研究表明在FGF2、BDNF 和GDNF 存在的培养环境下,使DA 能神经元的存活率增强了15 倍,并且促进了神经突触的生长。而dbcAMP 促进所有神经元神经突触的生长,但是不能增加DA能神经元的存活。实验发现随着诱导分化时间逐渐延长,TH 细胞阳性率逐渐降低,因此本实验确定诱导分化的时间为1 w。具体如下:在实验组A(GDNF组)中,我们设置了3 个不同剂量组:10 μg/L、20 μg/L、40 μg/L,其中浓度为10 μg/L 时与血清诱导组相比TH 细胞阳性率显著升高,当剂量增加到20 μg/L 时,TH 细胞阳性率较10 μg/L 时升高,二者相比有统计学意义,而随着剂量继续增加至40 μg/L时,TH 细胞阳性率未再继续升高。说明GDNF 在10 μg/L~20 μg/L 范围内存在剂量依赖性。在实验组B(dbcAMP)中,我们同样设置了3 个不同剂量组:100 μmol/L、200 μmol/L、400 μmol/L,其中浓度为100 μmol/L 时与血清诱导组相比TH 细胞阳性率升高,当剂量增加到200 μmol/L 时,TH 细胞阳性率较100 μmol/L 时升高,二者相比有统计学意义,而随着剂量继续增加至400 μmol/L 时,TH 细胞阳性率未再继续升高。同样,dbcAMP 在100 μmol/L~200 μmol/L 范围内也存在剂量依赖性。综合实验组A及实验组B 的实验结果,我们在实验组C 中利用二者的最佳浓度进行诱导,结果显示二者联合诱导较单独诱导时更能促进NSCs 向多巴胺能神经元分化,二者联合具有协同作用。实验结果表明:在神经营养因子的作用下,分离的神经干细胞能够快速增殖并形成神经球,GDNF 及dbcAMP 均有诱导神经干细胞向多巴胺能神经元分化的作用,其中GDNF 在20 μg/L 时诱导效能最高,dbcAMP 在200 μmol/L 时诱导效能最高。二者联合诱导作用更佳。
本实验虽然获得了预期结果,但仍有一些问题有待进一步研究,比如,如何获得用于移植的高纯度NSCs;GDNF 及dbcAMP 二者诱导NSCs 分化为多巴胺神经元的比例还不是很高;如何诱导出统一的异质性较低的不同分化阶段的有功能的多巴胺神经元尚需进一步的努力;诱导分化机制还有待进一步阐明等。
3.3 NSCs 向多巴胺能定向分化研究应用于临床存在的问题
目前的相关研究中,重点关注原生的或者转基因的干/前体细胞在功能障碍的纹状体中是否能够存活、分化及功能融合等问题,包括从培养到移植后功能鉴定的各个环节都需要优化。迫切需要优化的问题可能有以下几个方面:首先,多巴胺神经元异质性问题。在相关的人胚胎干细胞分化为多巴胺神经元的报道中,显示同为TH 阳性的细胞中却存在着明显的异质性,而定向分化的多巴胺细胞的同质性是细胞移植治疗的必要条件。虽然人们已经从生物化学、遗传学、免疫细胞化学和电理生理学特性方面证明:来源于人胚胎干细胞中脑腹侧的永生的多克隆神经干细胞系可以作为产生A9 多巴胺神经元的有效模式系;但是在帕金森大鼠长期体内移植的研究表明,该移植物尚不能均匀的成熟[12]。Datta I 等[13]用严格的无血清营养添加合适的细胞外基质(extracellularmatrix,ECM)使人胚胎干细胞系9(human embryonic stem cell-line,HUES9)相对比较均一的向多巴胺能神经元定向分化,但其移植后细胞的存活率及功能有待测定。因此,如何筛选出以同质性和克隆性为特点的NSCs,允许具有可控性能的细胞进行移植,是目前学者对移植细胞长期体内存活的进一步尝试。
其次,移植前多巴胺细胞的分化程度问题。Moon[14]应用一种PD 基因模型-无晶状体小鼠,分别在拟胚体(Embryoid Body,EB)、神经前体细胞(Neural Precursor Cells,NP)和已分化的神经元(Differented neurons ND)阶段对该模型进行细胞移植治疗,结果表明NP 阶段代表移植的最佳阶段。
再次,移植后细胞的存活时间和功能问题。Ziavra[15]将6-羟基多巴胺(6-hydroxydopamine,6-OHDA)立体定位注射于小鼠右侧上行黑质纹状体多巴胺通路中并随后执行NPC 移植,接着进行脱水吗啡诱导的旋转和双向免疫激光共聚焦扫描实验。结果显示,移植细胞至少存活3W,移植的神经前体细胞占宿主纹状体区域的总体细胞数的百分比从0.2%(移植0W)上升到0.6%(移植3W);移植细胞功能整合在纹状体中,明显的减少了脱水吗啡处理后产生的对侧旋转动作。同时,在纹状体环境中GFP 阳性细胞分化成β-III 微管表达的神经元,而不是胶质细胞。最重要的是,GFP-阳性的细胞进一步分化为多巴胺能(TH-阳性)和中型多棘神经元(dopamine and adenosine 3’5’-monophosphate-regulated phosphoprotein,Mr 32 kD,DARPP-32-阳性)表型。
另外,用于临床试验中的干细胞来源问题。目前研究发现以体外产生的早期妊娠骨髓间充质为来源的神经前体细胞在体内能够最终分化,并且能够改善与帕金森相关的运动功能。因此胎盘可能是治疗神经疾病的干细胞良好来源[16],或者说胚胎干细胞(embryonic stem cells,ESC)是帕金森疾病替代治疗(中脑多巴胺神经元)的一个有前景的资源[17]。但是,ESC 的移植模式伴随着介入不适应和致瘤细胞的风险。来自于转基因系的经流式细胞仪纯化的细胞移植表明:中期和晚期的细胞移植物几乎全部是唯一的DA 神经元。中期神经元细胞移植表现出DA 神经元存活量最大并在帕金森小鼠模型中诱导出强大的运动缺陷的恢复。因此,胚胎干细胞中期分化的神经元最适合进行DA 神经元移植。
3.4 神经干细胞移植治疗PD 的展望
PD 是中老年人常见神经系统变性疾病,主要病理改变是路易小体形成和黑质多巴胺能神经元缺失,由于其病因及发病机制尚未彻底明了,虽然通过多巴胺替代疗法可以改善症状,但并不能阻止病情进展,而且药物替代治疗不可避免的副作用也限制其临床长期应用。神经干细胞的发现为帕金森病的治疗提供了新的思路和方法。通过移植多巴胺能神经元替代已经变性的神经元,恢复黑质纹状体多巴胺系统的完整性并改善其功能,神经干细胞治疗可能是帕金森病众多治疗方案中一项非常有前途的治疗措施。目前已有很多关于应用神经干细胞治疗PD 的基础及临床实验研究。Mimura 等[18]证实脑内多巴胺能神经元移植可以使帕金森动物模型的行为学得到改善。2005 年Takagi 等[19]在猴的胚胎干细胞中加入FGF20 进行诱导分化,培养出大量多巴胺能神经元,后移植到经1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-phenyl-1,2,3,6-tetrahydro pyridine,MPTP)处理的帕金森模型猴,移植后性能鉴定试验发现存活的移植细胞能够行使多巴胺神经元的功能,并显著改善帕金森病模型猴的行为学症状。由于MPTP 诱导产生的帕金森病模型非常接近人类帕金森病,因此实验结果对于细胞移植应用于临床具有极高的预测性[20]。Levesque 从神经外科手术中获得了皮质及皮质下脑组织,并从中成功分离出大量神经干细胞进行原代培养数月,经诱导分化,培养出大量多巴胺能神经元及γ-氨基丁酸能神经元后,研究人员将其移植到帕金森病患者的大脑纹状体内,应用帕金森病统一评分量表进行评估,结果显示:术前服用抗帕金森药物的患者症状改善达81%;移植术后2 y 该批患者症状改善达83%,术后5 y 评分回归基线。该实验表明移植的神经元能长时间的改善帕金森病患者的症状,同时也证明神经干细胞移植治疗帕金森病的前景非常诱人[21]。因此,获得足够数量的多巴胺能神经元是细胞移植的基础,而且移植源能够改善帕金森模型鼠的行为学症状,说明细胞移植治疗在理论上是可行的。任何可以显著提高神经干细胞向多巴胺能神经元分化的方法或方式都是值得尝试的;在不违背伦理学的基础上,更多的从来源、定向分化到移植到功能改善的各个环节的优化都是值得探索的。
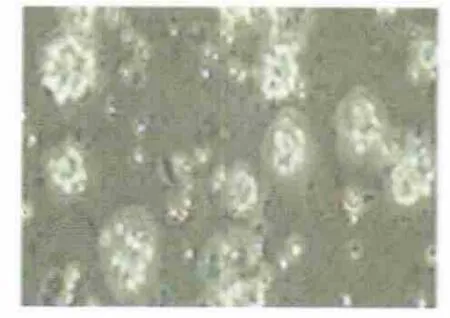
图1 原代培养24 h 细胞克隆(×200)

图2 原代培养3 d 细胞克隆(×200)
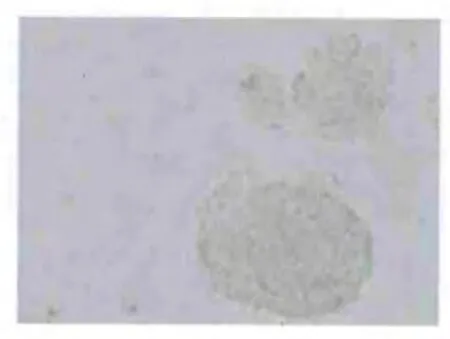
图3 未加一抗细胞阴性对照(DAB,×200)

图4 特异性标记物Nestin 表达(DAB,×200)

图5 未加一抗细胞阴性对照(DAB,×400)

图6 细胞中Brdu 表达(DAB,×400)
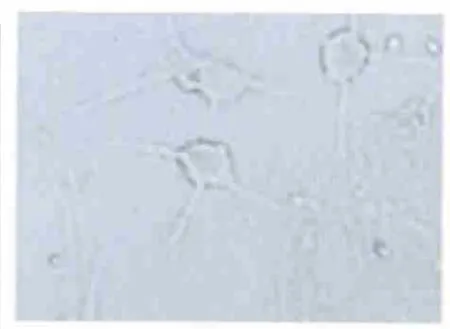
图7 TH 细胞在分化中的阴性表达(DAB,×400)

图8 GDNF 10 μg/L 诱导7d TH细胞表达(FITC,×400)

图9 GDNF 20 μg/L 诱导7dTH 细胞表达(FITC,×400)

图10 dbcAMP 100 μmol/L 诱导7d TH 细胞表达(DAB,×400)

图11 dbcAMP 200 μmol/L 诱导7d TH 细胞表达(DAB,×400)

图12 GDNF 20 μg/L 联合dbcAMP 200 μmol/L 诱导7d TH 细胞表达(DAB,×400)
[1]Gage HF.Mammalian neural cells[J].Science,2000,287(5457):1433-1438.
[2]Harrower TP,Tyers P,Hooks Y,et al.Long-term survival and integration of porcine expanded neural p recursor cell grafts in a rat model of Parkinson‘s disease[J].Exp Neurol,2006,197(1):56-69.
[3]Wong AM,Hodges H,Horsburgh K.Neural stem cell grafts reduce the extent of neuronal damage in a mouse model of global ischaemia[J].Brain Res,2005,1063(2):140-150.
[4]Doetsch F,Scharf C.Challenges for brain repair:Insights from adult neurogenesis in birds andmammals[J].Brain Behav Evol,2001,58(5):306-322.
[5]张文治,苏 心,秦进喜,等.EGF 和bFGF 促神经干细胞增殖与分化研究[J].现代神经疾病杂志,2002,2(6):354-359.
[6]Svendsen CN,Caldwell MA,Shen J,et al.Long-term survival of human central nervous system progenitor cells transplantation into a rat model of Parkinson disease[J].Exp Neurol,1997,148:135-146.
[7]郭雨霁,李盛芳.神经营养因子家族及其受体的研究进展[J].神经解剖学杂志,2001,17(3):288-294.
[8]Schuchardt A,D’Agati V,Larsson-Blomberg L,et al.Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret[J].Nature,1994,3670:380-383.
[9]Tio M,Tan HK,Lee W,et al.Roles of dbcAMP,IBMX and RA in Aspects of Neural Differentiation of Cord Blood Derived Mesenchymal-LikeStem Cells[J].Plos One,2010,5(2):1-11.
[10]Tremblay RG,Sikorska M,Sandhu JK,et al.Differentiation of mouse Neuro 2A cells into dopamine neurons[J].Journal of Neuroscience Methods,2010,186:60-67.
[11]Majd S,Smardencas A,Parish CL,et al.Development of an in vitro model to evaluate the regenerative capacity of adult brain-derived tyrosine hydroxylase-expressing dopaminergic neurons[J].Neurochem Res,2011,36(6):967-977.
[12]Ramos-Moreno T,Lendínez JG,Pino-Barrio MJ,et al.Clonal human fetal ventral mesencephalic dopaminergic neuron precursors for celltherapyresearch[J].PLoS One,2012,7(12):52714.
[13]Datta I,Ganapathy K,Tattikota SM,et al.Directed differentiation of humanembryonic stem cell-line HUES9 to dopaminergic neurons in a serum-freedefined culture niche[J].Cell Biol Int,2013,37(1):54-64.
[14]Moon JS,Lee HS,Kang J,et al.Stem cell grafting improves both motorand cognitive impairments in a genetic model of Parkinson’s disease,the aphakiamouse[J].Cell Transplant,2012.[Epub ahead of print].
[15]Ziavra D,Makri G,Giompres P,et al.Neural stem cells transplanted in a mousemodel of Parkinson’s disease differentiate to neuronal phenotypes and reducerotational deficit[J].CNS Neurol Disord Drug Targets,2012,11(7):829-835.
[16]Park S,Kim E,Koh SE,et al.Dopaminergic differentiation of neural progenitorsderived from placental mesenchymal stem cells in the brains of Parkinson’sdisease model rats and alleviation of asymmetric rotational behavior[J].Brain Res,2012,1466:158-166.
[17]Ganat YM,Calder EL,Kriks S,et al.Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment[J].Clin Invest,2012,122(8):2928-2939.
[18]Mimura T,Dezawa M,Kanno H,et al.Behavioral and histologicalevaluation of a focal cerebral rat model transplanted with neurons induced from bone marrow stromal cells[J].Neuropathol Exp Neurol,2005,64(12):1108-1117.
[19]Takagi Y,Takahashi J,Saiki H,et al.Dopaminergic neurons generated from monkey embryonic stem cells function in a Parkinson primate model[J].Clin Invest,2005,115(1):102-109.
[20]Langston JM.The promise of stem cells in Parkinson’s disease[J].Clin Invest,2005,15(1):23-25.
[21]Levesque M.Neural stem cells-derived biotherapeutics for human degenerative disorders:Clinical experience in Parkinson’s disease[C].BIT’s 3rd Annual world congress of regenerative medicine and stem cells,2010.253.
