限制生长保存龙眼胚性愈伤组织体胚发生过程的RAPD分析
2013-12-24林秀莲张新英赖钟雄
林秀莲,张新英,叶 炜,3,赖钟雄
(1.福建农林大学园艺植物生物工程研究所,福建福州350002;2.惠州农业学校生物工程科,广东惠州561002;3.三明市农业科学研究所,福建三明365509)
龙眼胚性愈伤组织(embryogenic callus,EC)经限制生长保存后能成功地恢复生长、进行体胚发生和再生完整植株[1].然而,组织培养物,尤其是EC,保存的价值在于能否保持其遗传稳定性,这是衡量限制生长保存成败的重要指标.叶炜[2]研究表明,新诱导的龙眼EC与继代保存1 a后的EC之间随机扩增多态性DNA(random amplified polymorphic DNAs,RAPD)谱带存在一定差异,但在邻近的继代周期间的RAPD谱带类似;郭玉琼等[3]对玻璃化超低温保存的龙眼EC进行RAPD遗传稳定性检测的结果表明,超低温保存的体细胞无性系遗传稳定性基本得到保持,但也发现存在小量的变异现象,有个别引物扩增的谱带在超低温保存前后存在一些差异.RAPD标记近年来在果树上应用较多.迄今为止,国内外对RAPD在果树上的应用研究主要集中在品种鉴定、分类研究、系谱分析、遗传图谱构建、特殊性状的基因标记等方面[4-6].采用 RAPD 进行遗传稳定性检测已经在桃、小麦[7]、锦橙[8]、荔枝[9]、龙眼[2-3,10]上应用.本试验选取不同保存时间的红核子龙眼不同发育阶段体胚为材料,利用RAPD技术分析EC体胚发生过程变异的规律,旨在为龙眼离体种质库的建立提供参考.
1 材料与方法
1.1 材料
供试材料分别为保存5个月、3 a、13 a的红核子龙眼胚性培养物,分别取EC、30 d球型胚、30 d早期子叶胚、45 d中期子叶胚、75 d成熟子叶胚和体胚苗[11],每个阶段各取1个样品,重复3次.
主要仪器设备有Mastercycler gradier PCR仪(Eppendorf公司)、Avanti 30 Centrifuge Beckman台式高速离心机、AllegraTM21RC Centrifuge Beckman台式高速离心机、TGL-16C普通离心机、T6 spectrophotometer型分光光度计、GIS-2008凝胶电泳成像仪、H.H.S WSZ-133-65电热恒温水浴锅、SK-1快速混匀器、DYY-Ⅲ32型电泳槽(18孔)、ZF-90多功能暗箱式紫外透射仪、SERIESZ VX350超低温冰箱、奥立龙828酸度计、移液器吸头(Tips)、50 mL离心管 (Eppendorf管)、PCR薄壁管(200 μL)、Gilson微量移液器、Nichipet FX微量移液器、冷柜、微波炉、BS 110S电子天平、研钵等.
主要试剂:Taq DNA聚合酶、dNTP(dNTP Mix)、Buffer(10×PCR Buffer)、MgCl2、引物、琼脂糖等购自上海Sangon生物工程公司;PVP、Tris-HCl、SDS、EDTA、硼酸、乙醇、异丙醇、溴化乙锭(EB)等试剂均为国产分析纯产品;液氮购自福建省福州第二化工厂.
主要溶液的配制参照郭玉琼等[3]的方法.
1.2 方法
1.2.1 DNA的提取 基因组DNA的提取参照郭玉琼等[3]的方法并加以改进.称取供试材料1 g,用液氮磨成粉末;将干燥的粉末转入10 mL的离心管中,待液氮挥发尽,加入3.5 mL DNA Extraction BufferⅠ和0.5 mL 20%SDS,混匀;于65℃水浴箱中温浴20 min,不时轻轻旋转混匀,然后加入1.25 mL KAc(5 mol·L-1),混匀,于0℃的冰浴中放置20 min;于25000 g、4℃离心20 min,弃沉淀,取上清液移至新离心管中,加入2.5 mL异丙醇,轻轻上下颠倒混匀,于-20℃的冰柜中放置40 min,沉淀核酸;于20000 g、4℃离心20 min,弃上清液,加入700 μL Extraction BufferⅡ溶解DNA 沉淀;于15000 g、4℃离心15 min,沉淀不溶性杂质,弃沉淀,取上清液移至新离心管中,加入等体积的4 mol·L-1LiCl,于5℃的冰箱中放置过夜沉淀RNA;于15000 g、4℃离心30 min,弃沉淀,取上清液移至新离心管中,加入预冷的75 μL NaAc(3 mol·L-1),再加入500 μL预冷的异丙醇,轻轻混匀,于室温下放置5 min;于15000 g、15℃离心15 min,沉淀DNA,弃上清液,沉淀用500 μL 80%冰乙醇洗脱,晾干后用200 μL TE Buffer溶解,于-20℃保存备用.
1.2.2 DNA质量的检测 提取的8 μL基因组DNA经0.8%琼脂糖凝胶电泳,于紫外透射仪上鉴定DNA质量.琼脂糖凝胶中溴化乙锭的工作浓度为0.5 μg·mL-1,电泳缓冲液为0.5 × TBE.
将提取的DNA样品,用TE Buffer按一定比例稀释,并以TE Buffer作空白对照,装入比色杯,用T6 spectrophotometer型分光光度计测定D260nm和D280nm.D260nm/D280nm可估测所提取的DNA纯度;DNA的浓度=D260nm×50×稀释倍数.
根据所测定的DNA浓度,用TE Buffer将DNA样品稀释至50 ng·mL-1,保存于-20℃的冰柜中,用于RAPD-PCR扩增的DNA模板.
1.2.3 RAPD 反应引物的筛选 引物筛选在叶炜[2]、郭玉琼[3]、钟凤林[10]等方法的基础上选取上海Sangon生物工程公司生产的34条随机引物作为筛选的对象;以保存13 a的龙眼EC DNA为模板,对34条随机引物进行筛选.
1.2.4 RAPD-PCR扩增 RAPD-PCR扩增反应及数据分析参照钟凤林[10]的方法,采用筛选得到的10条10 bp寡聚核苷酸的随机引物进行PCR扩增,扩增反应在Mastercycler gradient PCR仪上进行.反应体系25 μL,含 1 μL 50 ng·μL-1DNA 模板、2.5 μL 10 × PCR Buffer、1 μL 10 mmol·L-1dNTPS、0.5 μL 5 U Taq DNA 聚合酶、1 μL 10 mmol·L-1随机引物、2.5 μL Mg2+、16.5 μL 无菌双蒸水.反应程序:94 ℃预变性 10 min;94℃变性1 min,36℃退火1 min,72℃延伸10 min,45个循环;72℃延伸10 min;4℃保存.
1.2.5 变异率的计算 龙眼EC体胚发生过程的遗传距离按如下公式计算:R=1-2Nxy/(Nx+Ny).式中,R表示种质X和种质Y的遗传距离;Nxy表示种质X和Y经RAPD反应后共有的扩增谱带数;Nx、Ny分别表示X和Y种质具有的总扩增谱带数.
龙眼EC体胚发生过程的变异率用遗传距离的百分数表示:变异率/%=R×100.
2 结果与分析
2.1 龙眼EC不同发育阶段体胚DNA RAPD扩增引物的筛选
对龙眼EC体胚发生过程中的基因组DNA的纯度和浓度进行分析,并经琼脂糖凝胶电泳检测,所选取的样本适合进行RAPD扩增,在此基础上进行引物筛选.
以保存13 a的EC(LC2胚性细胞系)的DNA为模板,对36条10 bp的随机引物进行筛选,共筛选出10 条多态性好、谱带清晰的引物 S11、S12、S47、S76、S85、S92、S114、S125、S130、S181 作为 RAPD-PCR 扩增的引物.
2.2 龙眼EC不同发育阶段体胚RAPD的扩增结果
采用已筛选的10条随机引物对保存5个月、3a、13a的龙眼EC体胚发生过程中的基因组进行RAPD扩增,结果见图1、表1.
对保存5个月的EC不同发育阶段体胚的基因组DNA进行RAPD扩增.结果(表1)表明,保存5个月的EC不同发育阶段体胚共扩增出220条谱带.EC、球形胚、早期子叶胚、中期子叶胚、成熟子叶胚、体胚苗等 6 个阶段的相对变异率分别为 0.91% 、0.45% 、2.27% 、2.73% 、3.18% 、2.27% .
对保存3 a的EC不同发育阶段体胚的基因组DNA进行RAPD扩增.结果(表1)表明,保存3 a的EC不同发育阶段体胚共扩增出196条谱带.EC、球形胚、早期子叶胚、中期子叶胚、成熟子叶胚、体胚苗等6个阶段的相对变异率分别为 5.10% 、2.55% 、5.10% 、1.53% 、1.02% 、1.02% .


图1 10条随机引物对不同保存时间的龙眼EC不同发育阶段体胚RAPD扩增的图谱Fig.1 RAPD pattern amplified by 10 selected primers in longan embryogenic cultures at different developmental stages during somatic embryogenesis under different time of minimal growth conservation
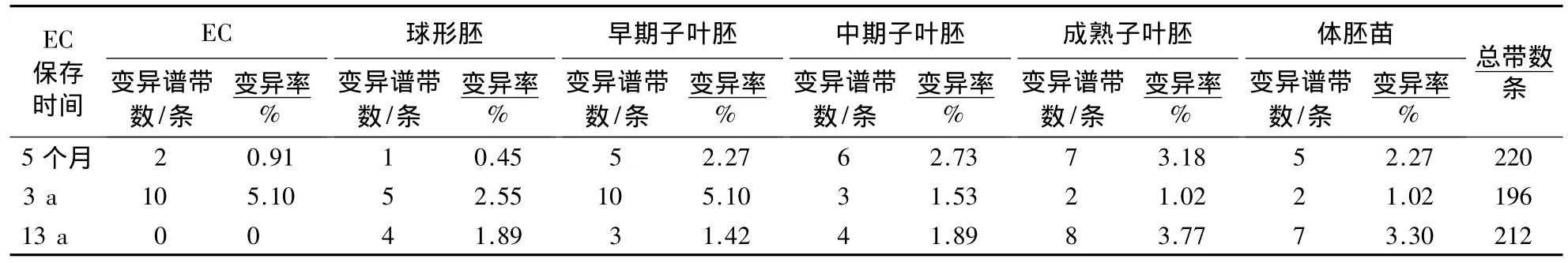
表1 10条随机引物对不同保存时间的龙眼EC不同发育阶段体胚RAPD的变异情况Table 1 DNA amplification results of longan embryogenic cultures at different developmental stages during somatic embryogenesis cultured for different conservation time by different primers
对保存13 a的EC不同发育阶段体胚的基因组DNA进行RAPD扩增.结果(表1)表明:保存13 a的EC不同发育阶段体胚共扩增出212条谱带.EC、球形胚、早期子叶胚、中期子叶胚、成熟子叶胚、体胚苗等6 个阶段的相对变异率分别为 0%、1.89%、1.42%、1.89% 、3.77%、3.30%.
3 讨论
3.1 龙眼EC不同发育阶段体胚的遗传稳定性
在离体培养的过程中,体细胞无性系变异应该是一个动态平衡的过程,尽管在继代过程中不断产生变异细胞,但诸如程序性死亡程序可能不断地淘汰变异细胞,最终使变异保持在一定的水平上[12-13],培养基的选择作用可能最终导致一种主要的核型成为优势核型[14].本试验对保存5个月、3 a、13 a的红核子龙眼胚性培养物进行体胚发生,分化率均可以达到100%,且都能完成正常分化,再生完整植株.利用RAPDPCR检测3个保存时间的龙眼EC体胚发生再生植株基因组DNA差异的结果表明,同一基因型的龙眼EC在分化体胚的过程中确实存在一定的遗传变异,但不同保存时间的EC在体胚发生过程中的相对变异率都保持在比较小的变异范围内(小于5.1%).因此,龙眼EC作为离体保存材料,在实际应用上是可行的,可以用于龙眼离体种质库的建立.植物愈伤组织存在变异是一种普遍的现象,在榨菜[15]、甜菜[16]、大蒜[17]等作物的愈伤组织及其再生植株也存在RAPD多态性现象,是否能在实际中用于离体种质的保存,关键在于其变异率是否在允许范围之内.
3.2 龙眼EC不同发育阶段体胚DNA的变异机理
林秀莲等[18]对3个保存时间龙眼EC体胚发生过程中的染色体数目进行观察,发现它们之间的染色体数目存在差异.本试验结果表明:3个保存时间龙眼EC体胚在发生再生植株的过程中,DNA遗传物质发生了变化.这种变异可能与染色体畸变、DNA的甲基化、转座子活化等有关.本试验结果有助于进一步探索龙眼离体培养和体胚分化的分子机理.
早期研究认为,无性系变异可能是供体植物细胞中预先存在的变异或嵌合细胞所造成的.但随着植物细胞和组织培养技术的迅速发展和广泛应用,大量试验证明变异主要发生在组织培养中,即细胞脱分化和再分化过程中.多数试验证明变异主要发生在外植体脱分化形成愈伤组织和愈伤组织继代的过程中,对变异机理和影响因素的探讨,目前也主要集中在此阶段的研究上.薛启汉等[19]在对甘薯EC以及相应的体细胞胚胎DNA指纹多态性的研究中发现,EC仅在2个位点出现变异,体细胞胚胎无性系中有14个位点发生不同位点的变异,从而说明甘薯在细胞脱分化阶段DNA已开始发生变异,但体细胞无性系变异大量发生阶段仍然是体细胞胚胎发生的诱导阶段.荔枝白色胚与玻璃化胚之间存在DNA差异,表明玻璃化胚与白色胚已存在一定的遗传差异[9].曾黎辉等[20]用简单重复序列区间(ISSR)分子标记技术研究了龙眼变异单株的多样性及其来源,为龙眼种质资源的开发与利用提供了一定的参考价值.而在本试验中,由于愈伤组织及其体胚发生再生植株过程的遗传变异机理相当复杂,需要多种途径加以分析验证,因此对本试验所获得的变异体还需进一步进行遗传分析.
[1]LIN X L,LAI Z X,XU Q F.High frequency plant regeneration via in vitro somatic embryogensis in fifteen cultivars of Dimocarpus longan Lour.[J].Acta Horticulturae,2010,863:155-160.
[2]叶炜.龙眼离体种质保存初步研究[D].福州:福建农林大学,2006.
[3]郭玉琼,赖钟雄,吕柳新.玻璃化法超低温保存龙眼胚性愈伤组织的初步探讨[J].福建农林大学学报:自然科学版,2006,35(3):262-265.
[4]李发芳,罗正荣,蔡礼鸿.RAPD及其在果树上的应用[J].果树科学,1998,15(3):256-260.
[5]史永忠,潘瑞炽,王小青,等.铁皮石斛种质资源的低温离体培养[J].应用与环境学报,2000,6(4):326-330.
[6]史永忠,邓秀新,郭文武,等.RAPD技术与果树种质资源及育种研究[J].中国果树,1997(2):46-48,56
[7]刁现民,段胜夕,陈振玲,等.谷子体细胞无性系变异分析[J].中国农业科学,1999,32(1):21-26.
[8]林定波,颜秋生,沈德绪.柑橘抗寒细胞变异的获得及其抗性遗传稳定性的研究[J].植物学报,1999,41(2):136-141.
[9]黄素华.荔枝体细胞胚胎发生过程中的遗传变异的研究[D].福州:福建农林大学,2001.
[10]钟凤林.龙眼遗传资源的RAPD与POD同工酶分析[D].福州:福建农林大学,2006.
[11]林秀莲.龙眼胚性愈伤组织限制生长保存及其生理与遗传机理的研究[D].福州:福建农林大学,2009.
[12]伊华林,邓秀新.植物种质离体保存技术研究进展[J].植物学通报,1999,16(5):574-581.
[13]伊华林.果树体细胞无性系变异与品种改良[J].植物生理学通讯,2002,38(4):412-417.
[14]黄学林,李筱菊.高等植物组织离体培养的形态建成及其调控[M].北京:科学出版社,1995:179-185.
[15]徐春霞,葛亚明,朱雪云,等.榨菜继代培养愈伤组织及其再生植株的变异性分析[J].核农学报,2007,21(3):237-241.
[16]MUNTHALI M T,NEWBURY H J,FORD LLOYD B V.The detection of somaclonal variants of beet using RAPD[J].Plant Cell Reports,1996,15:474-478.
[17]AL-ZAHIM M A,FORD LLOYD B V,NEWBURY H J.Detection of somaclonal variation in garlic(Allium sativum L.)using RAPD and cytological analysis[J].Plant Cell Reports,1999,8:473-477.
[18]林秀莲,赖钟雄.龙眼胚性愈伤组织限制生长保存及其染色体数目变异[J].热带作物学报,2009,30(10):1488-1490.
[19]薛启汉,张赞.甘薯体细胞胚胎发生遗传变异的RAPD分析[J].江苏农业学报,2000,16(4):212-216.
[20]曾黎辉,洪自同,林文忠,等.龙眼种质资源的ISSR分析[J].福建农林大学学报:自然科学版,2009,38(3):238-242.
