香樟胚性与非胚性愈伤组织间的差异研究
2020-11-03荆茹月李志辉
荆茹月,霍 坤,李志辉
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南省汨罗市玉池国有林场,湖南 汨罗 414400)
香樟Cinnamomum camphoraL.为樟科树种。是我国亚热带常绿阔叶林的代表种,国家二级保护的乡土树种,是天然香料提取、南方道路绿化、园林植物配置的首选树种[1]。20世纪后期体细胞胚胎作为植物组织培养中的重要技术手段应用于香樟的离体培养,在体细胞胚胎发生方面有杜丽等[2]以香樟未成熟合子胚为外植体通过诱导胚性愈伤组织产生完整植株。施雪萍等[3]在其基础上进一步完善了体胚发生体系并且研究了如何保持次生胚胚性。杨柳等[4]在此基础上研究了不同种源间香樟体细胞胚胎发生各个阶段所需的激素浓度的差异。目前已建立了较为完善的香樟组织培养及植株再生体系,为研究香樟胚性愈伤组织和非胚性愈伤组织提供了实验材料。
植物体细胞胚胎诱导过程中会出现多种不同类型的愈伤组织,尽管不同的愈伤组织可以根据外观、质地、颜色的不同加以区别,但在体胚发生中需要快速且准确地筛选出具有胚性、能进一步增殖成熟的胚性愈伤组织。为保证体细胞胚胎发生途径的后续步骤,对胚性愈伤组织和非胚性愈伤组织进行早期识别是十分重要的环节。近年来,对于植物体胚诱导阶段胚性愈伤组织和非胚性愈伤组织的研究从多个方面进行展开,如对枣[5]、荔枝[6]、香榧[7]进行的组织细胞学观察,在麻栎[8]、楸树[9]等树种中进一步发展为扫描电镜及透射电镜观察,以及在栓皮栎[10]等多个树种的体胚发生过程中的生理生化机理的研究都曾有报道。但在香樟体细胞胚发生过程中,仅有少数对于体细胞胚发生过程的切片观察,而对胚性愈伤组织和非胚性愈伤组织的扫描电镜观察和生理生化的研究未有报道。
本文通过对香樟4 种愈伤组织进行形态、石蜡切片及扫描电镜观察,从组织细胞水平对胚性愈伤组织和非胚性愈伤组织作了外部形态和内部结构差异的比较;与此同时利用生物化学技术,探究胚性愈伤组织与非胚性愈伤组织间的可溶性蛋白质、可溶性糖、淀粉、抗氧化物酶含量的差异,通过两者的生理生化差异为香樟胚性和非胚性愈伤组织的区分提供可靠的判断依据,进一步优化诱导培养基的成分、提高体胚诱导率,为建立起愈伤组织的胚性发生能力与生化代谢间的关系提供了理论基础。
1 材料与方法
1.1 材料准备
2018年7月上旬,在湖南省长沙市中南林业科技大学校园内选择20年生,胸径24~26 cm,长势一致且无病虫害的1 株香樟优树为材料供体,采集外表嫩绿、光滑,无明显机械损伤,直径在0.6 cm 左右的未成熟果实,去除果皮果肉,洗净种子保存于4 ℃冰箱内备用。
1.2 实验方法
1.2.1 愈伤组织的诱导
选取百粒重超过130 g 的种子,流水冲洗10 min,去除浮于水面上的种子,沥水后放入事先灭菌过的烧杯中置于超净工作台上,75%的酒精浸泡60 s,无菌水冲洗3 次后,转入0.1% HgCl2溶液中摇晃灭菌8 min,无菌水冲洗3~5 次。在超净工作台上划开种壳中部,取出未成熟合子胚以全胚胚根向下接种于香樟体胚发生诱导培养基上(MS+1.0mg/L 6-BA+0.3 mg/L 2,4-D+1.0 mg/L 链霉素+6.5 g/L 琼脂+700 mg/L 水解酪蛋白+30 g/L蔗糖),14 d 转1 次,培养温度为(23±2)℃,培养湿度为50%~60%,pH 值调至5.8~6.0,在121 ℃下消毒灭菌20 min,采用暗培养,每瓶接入2 个外植体,每个处理接种15 瓶,3 次重复。在接种10 d 后开始,根据颜色、形态、质地特征,分别选取胚性和非胚性愈伤组织,作为研究的材料,并对其进行拍照记录(图1)。
1.2.2 愈伤组织的细胞学观察
实验采用常规石蜡切片[11],新鲜材料用50%酒精配制的FAA 固定液固定并用注射器进行抽气,切片厚度为9 um;用甘油和蛋清3∶2 的比例制作粘片剂,在载玻片上按照同方向拍打蛋液,烤片并烘干;进行脱蜡和染色时,采用0.5%的固绿染色7 min,在95%的酒精中冲洗去多余的固绿,中性树胶封片,将制作好的玻片放置于蔡司倒置显微镜下观察拍照记录。
1.2.3 愈伤组织的扫描电镜观察
扫描电镜样品的制作参照Fowke[12]的方法,挑选新鲜的胚性愈伤组织和非胚性愈伤组织材料固定在4%戊二醛中4 h,经过一系列处理,在(CPD)临界点干燥,粘台,离子溅射仪喷金,在SEM-500 Philips 下进行观察拍照记录。
1.2.4 愈伤组织的透射电镜观察
透射电镜样品的制作出去参照Fowke[12],用乙醇逐级脱水每次30 min,环氧丙烷过渡3 次,每次30 min,调节环氧丙烷∶包埋剂比例为3∶1、1∶1、1∶3 进行渗透,渗透时间分别为1、2、3 h,在纯树脂包埋剂中过夜。在恒温箱中经历35 ℃~45 ℃~60 ℃分段升温,在LKB-V 超薄切片机上切片,醋酸双氧铀染色,在Hitachi H-600型透射电镜下观察拍照。
1.2.5 愈伤组织的生理生化指标测定
可溶性糖含量的测定采用蒽酮比色法测定[13],称取胚性和非胚性愈伤组织0.2 g,放入25 mL 刻度试管中,加入10~15 mL蒸馏水,塑料薄膜封口,沸水浴30 min,浸提2 次,在630 nm 波长下测其吸光度。
淀粉含量的测定[13]是向提取过可溶性糖的沉淀中加入10 mL 蒸馏水,沸水浴15 min,冷却至室温后加入4 mL 的9.2 mol·L-1HClO4,4 000 r/min 离心10 min,浸提2 次,在630 nm 波长下测其吸光度。
可溶性蛋白含量测定采用考马斯亮蓝G-250 染色法[13],准确称取胚性和非胚性愈伤组织各0.2 g,放入研钵,加入5 mL 磷酸缓冲液,冰浴中研磨成匀浆,4 000 r/min 离心10 min,浸提2 次,上清液即为蛋白质提取液,在595 nm 处测量吸光值,计算可溶性蛋白含量。
过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)含量测定采用单一提取法,准确称取胚性和非胚性愈伤组织各0.2 g 加入磷酸缓冲液7 mL,冰浴研磨后,转入离心管中,并于4 ℃下12 000 r/min 离心15 min,取上清液分别进行各项酶活性测定。超氧化物歧化酶(SOD)活性采用氮蓝四唑还原法测定[13],过氧化物酶(POD)活性采用愈创木酚比色法测定[13],过氧化氢酶(CAT)活性采用还原过氧化氢的方法测定[13]。每项指标均重复测定3 次,取平均值。
1.3 数据统计与处理
利用Excel 2013 对数据进行处理,利用SPSS 20.0 软件进行单因素方差分析,平均数在P=0.05水平上进行邓肯多重比较。图表中数据均为平均值±标准差。
2 结果与分析
2.1 愈伤组织的类型及组织细胞学观察
香樟未成熟合子胚接种后,子叶连接处最先诱导出愈伤组织,愈伤组织类型与激素、碳源及温度、光照等环境因素紧密相关。依据愈伤组织形态和细胞特征可分为4 种类型(表1)。
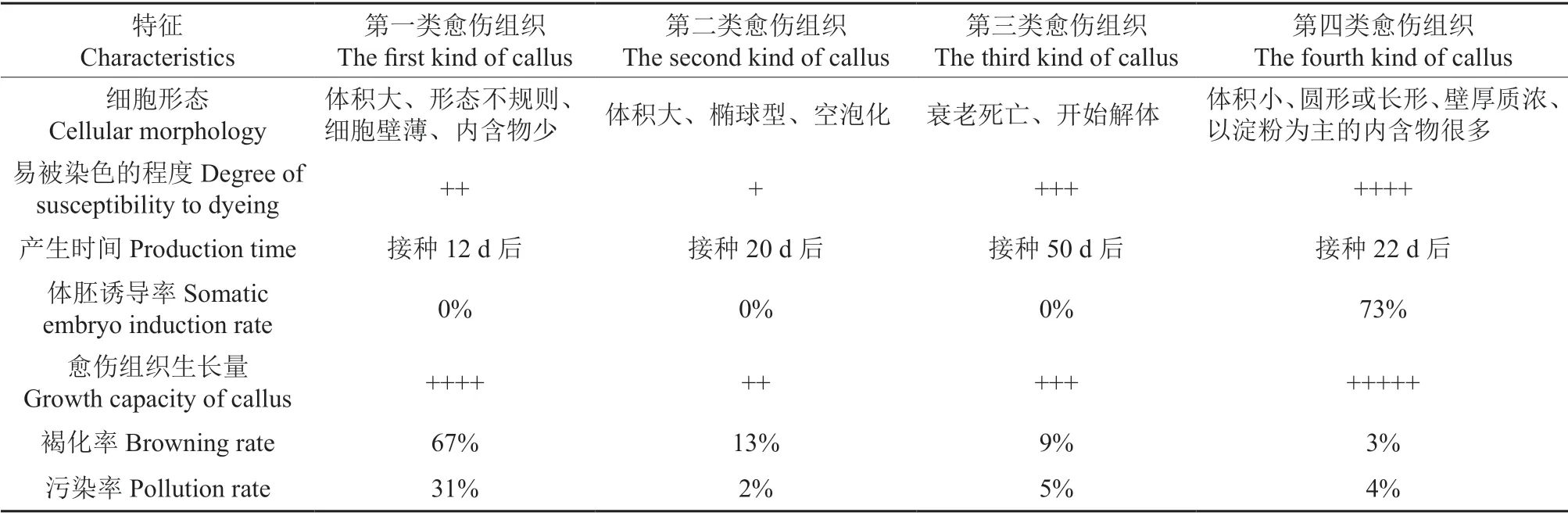
表1 4 类愈伤组织的特征分析†Table 1 Characteristic analysis of four types of Cinnamoumum camphora callus
第1 类愈伤组织(图1A)由1 mm 的小颗粒团块状组成,细胞大形态不规则,细胞壁薄,细胞内含物少,仅含有少量的淀粉粒。愈伤组织呈灰色半透明,质地松软部分呈水渍化,含水量高,和母体联系紧密,不易分离。生长速度快,能在培养基中多次增殖,但随着增值次数的增多,生长速度逐渐减慢,最终褐化死亡,不能发育为体胚细胞,属于非胚性愈伤组织。第2 类愈伤组织(图1B)由5 mm 的大颗粒凸起组成,细胞体积大壁薄多为椭球形,细胞空泡化明显。愈伤组织为白色不透明,质地紧密光滑,和母体连接紧密不易分离。生长速度缓慢,在培养基中多次转接并没有很大的变化,连续转接5 次后仍然维持原样,随着继代次数的增加,白色块状结构越来越紧实,不能诱导出体胚细胞,属于非胚性愈伤组织。第3 类愈伤组织(图1C)由2 mm 的颗粒分散组成,细胞多数已经衰老、破碎开始解体,在少数衰老细胞中能看到淀粉粒的积累。愈伤组织为深黄色大颗粒状,组织脆性疏松,和外植体连接十分松散不需要外力即可分离。生长速度较缓慢,生活力低下,继代培养1~2 次即褐化死亡,不能诱导出体胚细胞,属于非胚性愈伤组织。第4 类愈伤组织(图1D)由2 mm 的球状凸起组成,细胞壁厚质浓、细胞体积较小、细胞内含物多,愈伤组织整体呈现白色,表面散布淡黄色颗粒,愈伤组织与外植体联系较少,生长速度较快并能多次继代,培养1 个月后愈伤组织发育出肉眼可见白色子叶胚,可以诱导出体胚细胞,属于胚性愈伤组织。

图1 香樟愈伤组织的类型Fig.1 Types of Cinnamomum camphora callus
2.2 香樟胚性细胞与非胚性细胞的差异与形成过程
显微观察胚性愈伤组织可以看到其中有多个分化中心,分化中心内部是胚细胞,其外部是非胚性细胞(图2A)。胚细胞较小约为13~30 um,椭球型,排列紧密,易被染色:一种为细胞质浓厚,细胞核位于中间,淀粉粒含量多,细胞多位于分化中心的边缘,另一种为细胞质浓厚,但细胞核位于边缘且淀粉粒含量较少,该类胚性细胞一般处于分化中心的中央,推测该类胚性细胞已经完成了初步的分化,随后将发育成特定的胚组织(图2B)。
分化中心周围由于细胞质浓厚、细胞体积大、淀粉粒含量较多、具有中央大液泡、几乎不含有细胞器的非胚性细胞包围,在这类非胚性细胞的外围分布着只含有少数细胞质,除此以外几乎不含有任何营养物质,细胞体积很大呈现空泡状的第二种非胚性细胞(图2C)。

图2 香樟胚性细胞与非胚性细胞间的差异Fig.2 Differences between embryonic and non-embryonic cells of Cinnamomum camphora
2.3 香樟的胚性愈伤组织与非胚性愈伤组织的扫描电镜观察
从愈伤组织的扫描电镜观察中可以看出4 种愈伤组织表面的差异明显,第一类愈伤组织表面细胞不饱满大部分死亡破裂,呈雪花状分布,表面粗糙,细胞之间结合较紧密,几乎看不到空隙,细胞表面有大量絮状附着物(图3A),属于非胚性愈伤组织;第二类愈伤组织表面细胞形成较大的凸起,形状呈不规则的球形或椭球型,在大的凸起上分布着不明显的小凸起,细胞之间结合较紧密,几乎看不到空隙,其中部分的细胞老化,存在小的凹陷(图3B),属于非胚性愈伤组织。第三类愈伤组织表面细胞排列整齐,细胞表面有少量附着物,大部分以单个细胞存在,绝大部分细胞老化,凹陷明显(图3C),属于非胚性愈伤组织。第四类愈伤组织表面细胞凸起,呈规则的颗粒状突起或皱褶凸起,容易成团分布,大小近似,成团的细胞间结合十分紧密,而细胞团与细胞团之间存在空隙,细胞表面有少量絮状附着物,边缘部分表面细胞老化死亡破裂(图3D),属于胚性愈伤组织。

图3 香樟愈伤组织的扫描电镜观察Fig.3 Scanning observation of Cinnamomum camphora callus
2.4 香樟胚性愈伤组织与非胚性愈伤组织的透射电镜观察
从愈伤组织的透射电镜观察图4中可以看出4种愈伤组织间的差异明显,第一类愈伤组织的细胞没有明显的形状,细胞间排列紧密,有较大的液泡,细胞质较少且分布在细胞四周,内部只有零星的小物质,没有细胞核和其它细胞器,细胞壁变形,有轻微的质壁分离现象(图4A),属于非胚性愈伤组织。第二类愈伤组织有明显的中央大液泡,细胞质很少分布于细胞的边缘,存在少量的淀粉粒及零星的小物质,没有细胞核和其他细胞器,质壁分离现象不明显(图4B),属于非胚性愈伤组织。第三类愈伤组织只有少量的细胞质和液泡,液泡皱缩,质壁分离现象明显(图4C),属于非胚性愈伤组织。第四类愈伤组织有浓厚的细胞质,细胞核大,核仁明显,内含物很丰富,在靠近细胞膜的胞质区域里有较多的淀粉粒和线粒体,还可观察到其内含有淀粉粒的叶绿体,有很多脂体分布在靠近细胞膜的区域(图4D),属于胚性愈伤组织。

图4 香樟愈伤组织的透射电镜观察Fig.4 Ultrastructure of Cinnamomum camphora callus
2.5 香樟胚性愈伤组织与非胚性愈伤组织的生理生化特性研究
香樟胚性和非胚性愈伤组织的生理生化特性测定结果见表2,结果显示第四类愈伤组织内的可溶性糖含量、可溶性蛋白含量、淀粉以及抗氧化物酶(除POD 酶外)的活性均明显高于前三类愈伤组织中各成分的含量,结合组织细胞学观察的结果再次验证第一类、第二类、第三类愈伤组织为非胚性愈伤组织,而第四类愈伤组织为胚性愈伤组织。
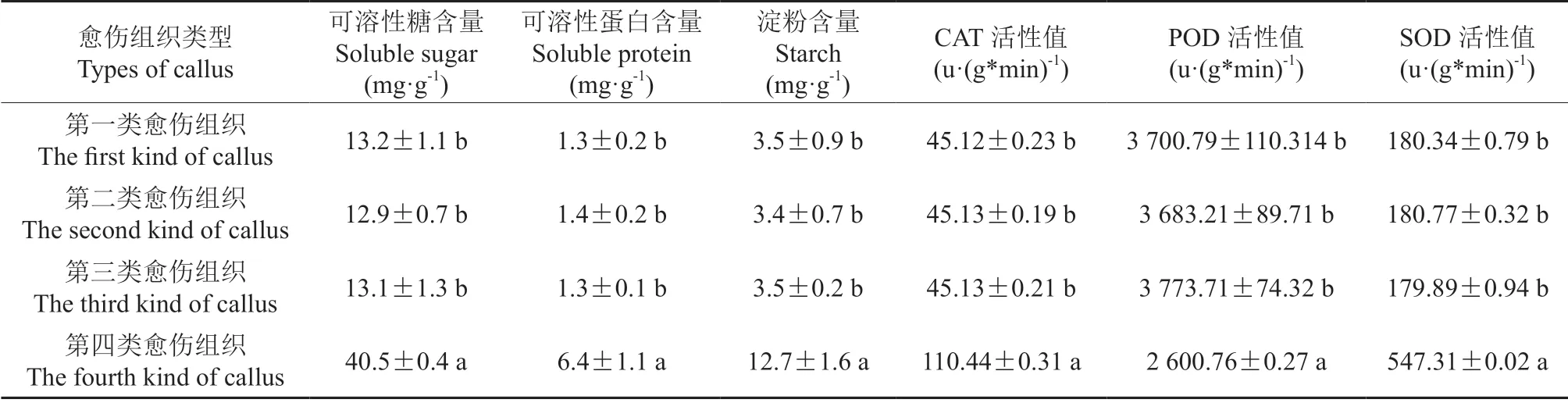
表2 香樟胚性愈伤组织与非胚性愈伤组织的生理生化特性测定Table 2 Physiological and biochemical characteristics of embryogenic and non-embryogenic callus of Cinnamomum camphora
香樟胚性愈伤组织的可溶性糖的含量约为非胚性愈伤组织中的3 倍,胚性愈伤组织与非胚性愈伤组织的可溶性糖的含量差异显著(P<0.05),在三种非胚性愈伤组织可溶性糖的含量差异不明显(P>0.05)。
香樟胚性愈伤组织中可溶性蛋白质的含量显著大于非胚性愈伤组织,两者相差约4.7 倍。胚性愈伤组织与非胚性愈伤组织的可溶性蛋白含量差异显著(P<0.05),说明香樟胚性愈伤组织可溶性蛋白含量极显著高于非胚性愈伤组织,而在非胚性愈伤组织间三者差异不显著(P>0.05)。
香樟胚性愈伤组织的淀粉的含量约为非胚性愈伤组织中的3.6 倍,胚性愈伤组织与非胚性愈伤组织的淀粉的含量差异显著(P<0.05),而三种非胚性愈伤组织淀粉的含量差异不明显(P>0.05)。
香樟胚性愈伤组织中过氧化氢酶(CAT)活性明显高于非胚性愈伤组织,其活性大小约为非胚性愈伤组织的2.4 倍,胚性愈伤组织与非胚性愈伤组织的CAT 的含量差异显著(P<0.05),在三种非胚性愈伤组织中CAT 的含量差异不明显(P>0.05)。
香樟胚性愈伤组织中过氧化物酶(POD)活性非胚性愈伤组织的活性明显高于胚性愈伤组织中POD 活性,约为胚性愈伤组织中的1.4 倍,胚性愈伤组织与非胚性愈伤组织的POD 酶含量差异显著(P<0.05),而三种非胚性愈伤组织POD的含量差异不明显(P>0.05)。
香樟胚性愈伤组织中超氧化物歧化酶(SOD)活性表现为胚性愈伤组织仍明显高于非胚性愈伤组织,其活性为非胚性愈伤组织中的3 倍,胚性愈伤组织与非胚性愈伤组织的SOD 酶含量差异显著(P<0.05),而三种非胚性愈伤组织SOD 酶的含量差异不明显(P>0.05)。
2.6 香樟胚性愈伤组织与非胚性愈伤组织的发生位置差异
对于胚性愈伤组织和非胚性愈伤组织发生的位置来说,从图5可以看出,非胚性愈伤组织先发生在两片子叶的中间,向外部不断扩增。胚性愈伤组织的发生位置有三种:一种是发生在胚根端(图5A),直接发生方式形成的胚性愈伤组织多发生在此;第二种发生在已形成的愈伤组织的外侧(图5B),愈伤组织边缘细胞通过有丝分裂活动形成胚性细胞,胚性细胞进一步分裂、增殖,形成颗粒团块状的胚性愈伤组织,位于愈伤组织外侧。第三种情况较特殊是极少数非胚性愈伤组织在多次转接接近褐化或衰退的时候其边缘会出现极少量的胚性愈伤组织(图5C),这种转化与培养基中所使用的激素关系很大,外植体脱分化形成的愈伤组织体积越大,其表面的细胞受到外植体内激素的制约越小,多次继代后,随着愈伤组织内部2,4-d的积累,极少部分细胞脱分化在褐化的表面形成了胚性愈伤组织。

图5 香樟愈伤组织的发生位置Fig.5 Location of Cinnamomum camphora callus
3 讨论与结论
本研究通过对4 种愈伤组织进行组织细胞学观察、扫描电镜观察可以看出,不同愈伤组织的组织学形态不同,其细胞学观察也存在着明显的差异。这与蒙古黄榆[14]、柑橘[15]、黄山栾树[16]等木本植物的研究结果类似。扫描电镜的结果与香雪兰[17]、西洋参[17]、人参[17]、光棘豆[17]的研究结果类似。但在对楸树[9]的研究中还发现紫色愈伤组织表面细胞呈现线形条纹,以及楸树褐色愈伤组织及麻栎非胚性愈伤组织表面细胞形态为长条形,这在香樟的扫描电镜观察中还没有发现,可能是由于树种间的不同和培养基中的激素种类、浓度引起愈伤组织的发育情况不同造成的。
本研究通过对4 种愈伤组织进行组织细胞学观察、扫描透射电镜观察可以看出,胚性愈伤组织细胞质浓,细胞核大,细胞器丰富,而非胚性愈伤组织只有大液泡和稀薄的细胞质,几乎不含有细胞器,本研究与在石刁柏[18]、楸树[9]、山杏[19]、早实核桃[20]中得到的结果类似。
研究表明淀粉含量是决定胚胎发生能力的关键因素,在对马唐愈伤组织的组织学研究中可以得出,胚性组织中淀粉粒含量是非胚性中的10~40 倍[21]。这与本研究的结果相符。
有关体细胞胚发生中胚性和非胚性组织中可溶性蛋白质含量已有大量的研究报道,其中胚性愈伤组织代谢活性明显高于非胚性。对连香树[22]等植物体细胞胚的研究过程中发现胚性愈伤组织的可溶性蛋白质含量和合成速率远高于非胚性愈伤组织。郑晓峰等[17]对西洋参、香雪兰、光棘豆和人参4种植物的胚性、非胚性愈伤组织及胚状体的可溶性蛋白进行了分析,结果表明,这4 种植物的胚性愈伤组织中可溶性蛋白含量远远超过非胚性愈伤组织.这与本研究中香樟的胚性愈伤组织的可溶性蛋白含量大约是非胚性的4.7 倍的结果相符。
可溶性糖含量水平标志着源端的同化物供应能力和库端对同化物的转化、利用能力[23]。在本实验中,香樟胚性愈伤组织可溶性糖含量显著高于非胚性愈伤组织,这与Neves 等[24]在甘蔗、孟姣等[10]在栓皮栎中的研究相符,表明胚性愈伤组织新陈代谢速率高于非胚型愈伤组织,高浓度的可溶性糖为胚性愈伤组织产生体细胞提供能量。而在张献龙等[25]对陆地棉的研究以及李茜等[26]在对白皮松体细胞胚的研究发现表明其胚性愈伤组织中可溶性糖含量会接近或低于非胚性愈伤组织,这是因为胚性愈伤组织已经将可溶性糖转化成诱导体细胞胚所需的RNA 和蛋白质。因此取样的时间不同很可能会导致胚性愈伤组织和非胚性愈伤组织的可溶性糖含量的差异。
抗氧化酶常作为植物生理代谢活动的指标酶,其活性的变化可以反映出外植体生理代谢水平的变化及胚胎发育情况[27]。一般认为,POD 在体胚诱导阶段起主要作用,而SOD 和CAT 在体胚的发育和成熟中发挥主要作用[28]。杜虹等[29]研究大白菜子叶培养过程中观察到,再分化时期POD 活性较高,酶的反应活跃。崔凯荣等[30]测定枸杞的体胚发生中发现,抑制SOD 活性后,体胚发生频率会降低,抑制CAT 活性后,体胚发生频率会升高。本实验结果与上述结果类似:胚性愈伤组织中SOD、CAT 酶的活性均高于非胚性愈伤组织,且POD 酶的活性在胚性愈伤组织中占有主要作用,说明胚性愈伤组织细胞的适应性、抗逆性强于非胚性愈伤组织,为诱导出体细胞胚做好了准备。
在本研究中已经从组织学、细胞学以及生理生化三个方面分析了香樟胚性愈伤组织和非胚性愈伤组织之间的差异,在但对体细胞胚胎发生过程中的特异性蛋白、同工酶的活性未做更深层次的研究。之后的研究过程中还可以继续分析测定完整的体细胞胚胎发生过程中的生理生化特性以及蛋白质的动态变化,找出体细胞胚胎发生的分子标志物,对体细胞胚胎发生发育过程进行调控,更深入的揭示体细胞胚胎发生的分子机理。
