丝棉木松散型胚性愈伤组织的诱导与增殖*
2021-08-11许丁帆刘艳军陶则满黄俊轩李建科武春霞
许丁帆,刘艳军,陶则满,黄俊轩,李建科,武春霞
(天津农学院 园艺园林学院,天津 300392)
丝绵木(EuonymusmaackiiRupr.),卫矛科(Celastraceae)卫矛属(EuonymusL.)落叶灌木或小乔木,其根、茎、皮、枝、叶、果皆可入药,具有活血、祛风湿、抗肿瘤等作用[1-3]。丝棉木耐贫瘠、耐盐碱、抗恶劣环境,具较高的观赏、药用价值和较强的空气净化能力,极其符合人们追求高质量的居住环境和舒适健康生活的需求,已逐渐成为园林绿化中的主流树种之一[4]。丝棉木种苗繁育主要以播种[5]、嫁接[6-7]和扦插[8]繁殖为主,虽然这些技术简单、成本低,但苗木繁殖效率低,远不能满足目前市场需求。因此,进行丝棉木无性快繁技术研究,提高繁殖系数,是解决丝棉木种苗不足、保持母树优良性状的重要途径。前人分别采用了丝棉木嫩茎、叶片为外植体,通过腋芽增殖和器官发生途径开展丝棉木组织培养和植株再生研究,初步建立了丝棉木组培快繁体系[9-12],但仍存在繁殖系数低等缺陷,尚未能推广应用。
利用体细胞胚胎发生途径进行植物繁殖较器官发生途径具有较高的遗传稳定性,能保持无性系母本的优良性状,有利于优良无性系苗木的规模化生产,在种质资源繁殖与保存方面的应用前景广阔[13]。而松散型胚性愈伤组织是胚胎形成的前体和体细胞胚胎发生的关键材料,是研究胚胎起源、植物再生过程生理、分子和形态的理想材料[14-15]。建立丝棉木松散型胚性愈伤组织培养体系,可应用于丝棉木良种繁育、体细胞离体诱变育种、遗传转化及其次生代谢物生产等研究。目前,未见关于丝棉木胚性愈伤组织诱导的相关报道。本试验以丝棉木茎段为外植体,建立丝棉木松散型胚性愈伤组织诱导体系,为丝棉木工厂化繁育、遗传转化体系的建立及药用有效成分生产等研究奠定基础。
1 材料与方法
1.1 试验材料
试验所用丝棉木植株生长于天津农学院东校区敏学楼西北侧花坛内,于2020年6月中旬剪取丝棉木植株中上部生长健壮、无病虫害的枝条备用。
1.2 试验方法
1.2.1 外植体消毒
将丝棉木枝条在超净台中剪成约1~2 cm的茎段,每个茎段上带1~2个腋芽,70%(V/V)乙醇消毒30~35 s,2%次氯酸钠溶液消毒15 min,期间不断摇晃,将消毒后茎段用无菌水反复冲洗3次,每次冲洗时间10 min,最后用无菌滤纸吸干茎段表面水分,剪去两端消毒损伤部分,接种至含有125 mg/L 羧苄青霉素钠的1/2MS培养基上,培养基附加20.0 g/L蔗糖,待腋芽萌发。
1.2.2 丝棉木松散型愈伤组织的诱导
接种15 d后丝棉木腋芽萌发后快速生长,剪取其幼嫩茎段,长约0.5 cm,接种到不同的松散型愈伤组织诱导培养基上。培养基以MS为基本培养基,分别添加不同浓度BA、2,4-D(表1),所有培养基均添加30.0 g/L蔗糖和7.0 g/L琼脂粉,灭菌前调节pH至5.8,121 ℃、0.1 MPa下灭菌20 min。试验采用100 mL广口三角瓶为容器,瓶中加入40 mL培养基,每种愈伤组织诱导培养基接种5瓶,每瓶接种丝棉木茎段5个,试验重复3次。培养条件为:(25±2) ℃,24 h光照,光照强度1 000 Lx。30 d后统计各处理愈伤组织诱导率。
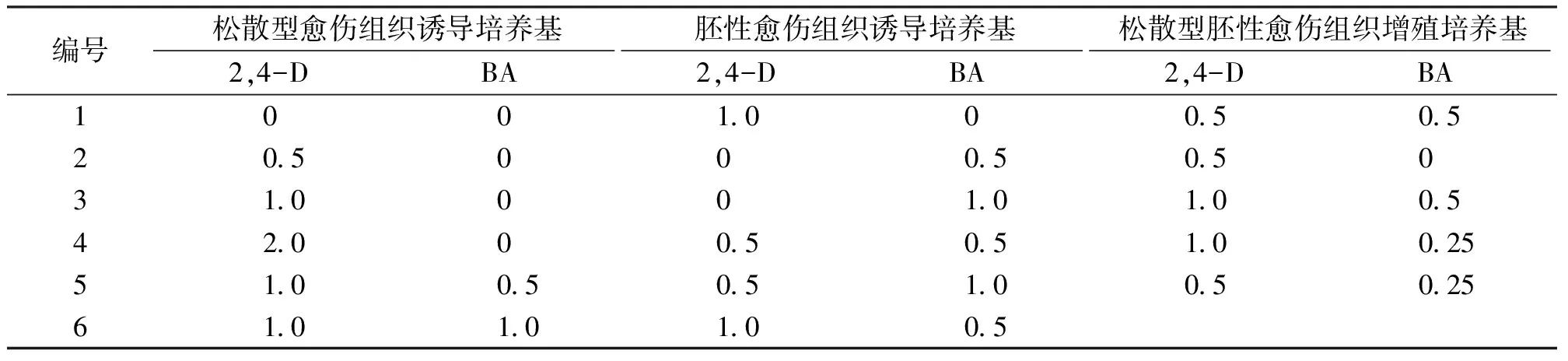
表1 不同类型培养基中2,4-D及BA浓度Tab.1 2,4-D and BA concentrations in different types of media mg/L
1.2.3 丝棉木胚性愈伤组织的诱导
将诱导的松散型愈伤组织从外植体上切下,大小约为0.25 cm3,选择生长状态基本一致的愈伤组织分别接种至不同的胚性愈伤组织诱导培养基上。诱导培养基采用MS为基本培养基,分别添加不同浓度的BA、2,4-D,培养基蔗糖、琼脂粉添加量与灭菌方法同1.2.2。试验重复3次,每5瓶胚性愈伤组织诱导培养基为一个小区,每瓶接种5块愈伤组织。培养条件为(23±2) ℃,连续光照,光照强度2 000 Lx。接种后每天观察愈伤组织生长情况,40 d后取少量愈伤组织采用醋酸洋红染色,盖上盖玻片,覆一层吸水纸,用带橡皮头的铅笔垂直敲打,或以大拇指紧压盖玻片,使材料分散压平,使用Leica DM 2000显微镜观察愈伤组织的胚性情况。
1.2.4 丝棉木松散型胚性愈伤组织的增殖培养
选择胚性愈伤组织边缘新长的结构松散、质地硬脆的愈伤组织,用镊子分散成约0.25 cm3的小块,选择生长状态一致的愈伤组织接种到丝棉木松散型胚性愈伤组织增殖培养基上。每15 d继代培养一次,每次继代培养时选择愈伤组织边缘新长的愈伤组织,每次继代培养后结合显微镜压片观察愈伤组织胚性保持情况,5次继代培养后记录愈伤组织生长速度、结构质地与颜色。培养基采用MS为基本培养基,改变培养基中BA与2,4-D的浓度,蔗糖、琼脂粉添加量与配制方法同1.2.2。培养条件同1.2.3。
1.3 数据处理及分析
愈伤组织诱导率%=(诱导出愈伤组织的外植体数/接种外植体数)×100%;
试验数据采用Excel 2013和SPSS Statistic 17.0进行数据分析,Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 不同植物激素浓度配比对愈伤组织形成的影响
由表2可知,丝棉木茎段在含不同激素的培养基上均能产生愈伤组织,且愈伤组织诱导率之间差异不显著;同时,外植体在不含植物激素的培养基上也能产生愈伤组织,说明丝棉木茎段外植体极易诱导产生愈伤组织。但从愈伤组织生长情况来看,不同培养基间差异较大。在不含激素的MS培养基上,茎段外植体伤口部位20 d后才出现绿色的愈伤组织,且愈伤组织结构紧密、质地硬,生长速度缓慢,这种愈伤组织一般很难诱导结构松散的愈伤组织。在含有一定浓度2,4-D的愈伤组织诱导培养基上,茎段外植体快速膨大,7 d后即出现愈伤组织,且愈伤组织生长速度均较不含激素的培养基上愈伤组织的生长速度明显加快,愈伤组织生长速度随着2,4-D浓度的升高而明显提高,说明2,4-D有利于愈伤组织诱导并促进愈伤组织的生长。当培养基中添加0.5 mg/L 2,4-D时,愈伤组织结构紧密、质地较硬(图1B);当2,4-D浓度为1.0 mg/L时,愈伤组织结构松散、质地较硬;当2,4-D浓度为2.0 mg/L时,诱导出的为白色松软型愈伤组织(图1A)。这说明愈伤组织结构会随着2,4-D浓度的提高而逐渐变松散,愈伤组织质地随着2,4-D浓度的提高而变软。当培养基中2,4-D浓度为1.0 mg/L时可诱导出结构松散、质地较硬的愈伤组织(图1C),适于继续诱导胚性愈伤组织;在此基础上附加一定浓度BA时,愈伤组织结构变得紧密,颜色转为绿色,这种愈伤组织虽可进一步诱导再生,但由于其结构紧密不适合进一步诱导松散型胚性愈伤组织。因此,附加1.0 mg/L 2,4-D的MS培养基为丝棉木松散型愈伤组织诱导的理想培养基。

表2 不同诱导培养基对愈伤组织形成的影响Tab.2 Effects of different induction media on callus induction

图1 不同类型的愈伤组织注:A为结构松散、质地较软的半透明状愈伤组织,B为结构紧密、质地较硬的愈伤组织,C为结构松散、质地较硬的愈伤组织,D为结构松散、质地较硬的胚性愈伤组织。Fig.1 Different types of callus
2.2 不同植物激素浓度配比对胚性愈伤组织形成的影响
由表3可知,不同培养基上愈伤组织胚性情况、愈伤组织特性与生长速度存在较大差异。当继续在松散型愈伤组织诱导培养基上进行培养,即只附加1.0 mg/L 2,4-D时,愈伤组织保持较快速度的增殖生长,为结构松散、质地较硬的白色愈伤组织,但显微镜观察发现此类愈伤组织未能被醋酸洋红染色,且细胞较大,细胞质浓度低、液泡较大,为典型的非胚性愈伤组织(图2A)。在培养基中只附加一定浓度的BA时,愈伤组织质地坚硬,结构紧密,颜色逐渐变绿,生长速度缓慢,显微镜观察发现此类愈伤组织多数内部组织化且分化出了厚壁组织、导管等,此类愈伤组织已经失去薄壁细胞的特点,分化为成熟组织,仅愈伤组织表层有少量分生组织细胞。当培养基中BA和2,4-D的比值较高时,即MS+1.0 mg/L BA+0.5 mg/L 2,4-D时,愈伤组织结构紧密、质地较硬,仅愈伤组织部分边缘细胞可被醋酸洋红染色,染色的细胞体积小、细胞核大、胞质浓,表现为胚性细胞特性(图2B);而当培养基中BA和2,4-D的比值较低时,即MS+0.5 mg/L BA+1.0 mg/L 2,4-D,愈伤组织结构松散、质地较硬,仅少数细胞可被醋酸洋红染色,表现为胚性细胞特性。当培养基中BA和2,4-D的比值一致时,即MS+0.5 mg/L BA+0.5 mg/L 2,4-D上,愈伤组织能够被醋酸洋红溶液染为红色,为典型的胚性愈伤组织特征,且此时愈伤组织结构松散、质地较硬(图2D),生长速度也较快。因此,MS+0.5 mg/L BA+0.5 mg/L 2,4-D为丝棉木松散型胚性愈伤组织诱导的理想培养基。
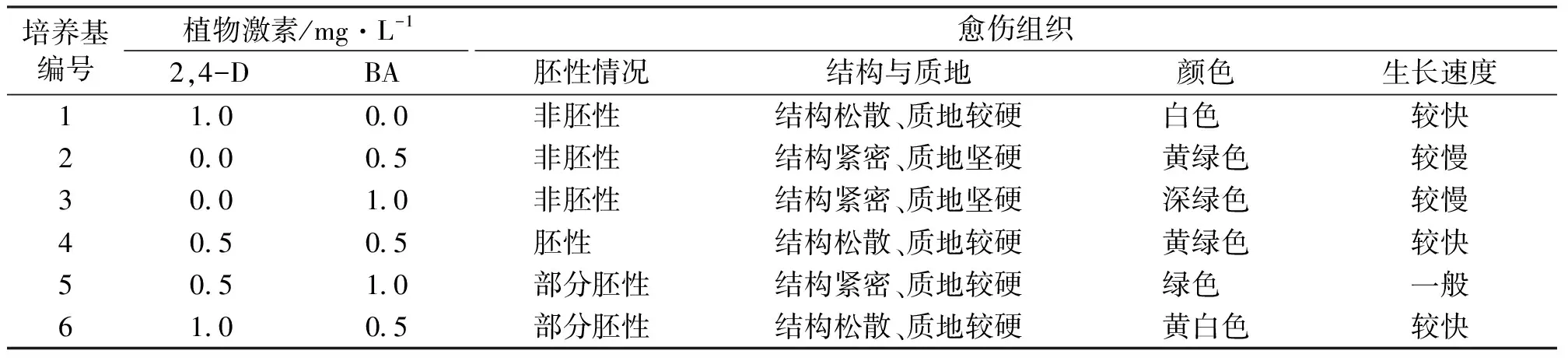
表3 不同诱导培养基对胚性愈伤组织形成的影响Tab.3 Effects of different induction media on embryogenic callus induction
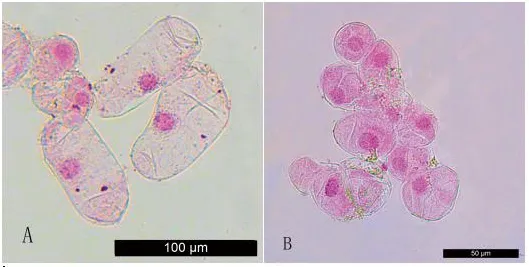
图2 愈伤组织显微观察注:A为非胚性愈伤组织,B为胚性愈伤组织。Fig.2 Microscopic observation of callus
2.3 不同植物激素浓度配比对松散型胚性愈伤组织增殖的影响
由表4可知,当松散型胚性愈伤组织继续在原培养基中长期继代培养,胚性愈伤组织会随着继代培养次数的增加而逐渐丧失胚性,愈伤组织出现组织化现象且愈伤组织结构变得越来越紧密。当培养基只加入2,4-D,胚性愈伤组织胚性很难保持,随着继代培养次数的增加而逐渐变软,说明单独使用2,4-D不利于胚性愈伤组织维持胚性。当采用0.5 mg/L BA+1.0 mg/L 2,4-D激素组合和0.25 mg/L BA+1.0 mg/L 2,4-D时,愈伤组织随着继代培养次数的增加而逐渐变松散,但愈伤组织质地也随着继代培养次数的增加而逐渐变软,同时愈伤组织胚性会随着继代培养次数的增加而逐渐丧失,说明高浓度2,4-D不利于胚性愈伤组织的保持。当采用0.25 mg/L BA+0.5 mg/L 2,4-D组合时,随着继代培养次数的增加愈伤组织结构保持松散且愈伤组织质地也较硬脆,筛选结构松散、质地硬脆的胚性愈伤组织进行继代培养,经过2~3次继代培养后,愈伤组织表面出现一些瘤状颗粒,且结构松散、质地紧密,通过显微镜观察愈伤组织细胞个体较小、细胞质浓度大、细胞核大,为典型的胚性愈伤组织特征;并且在此激素组合的培养基上,松散型胚性愈伤组织可以稳定增殖,生长速度较快且保持胚性。因此,理想的丝棉木松散型胚性愈伤组织增殖与保持培养基配方为:MS+0.25 mg/L BA+0.5 mg/L 2,4-D。

表4 不同增殖培养基对松散型胚性愈伤组织胚性保持的影响Tab.4 Effects of different propagation media on embryogenic retention of loose embryogenic callus
3 讨论与结论
松散型胚性愈伤组织是体细胞离体诱变和基因转化研究的理想试材。但诱导松散型胚性愈伤组织过程复杂,会受到激素、继代时间、培养条件等因素的影响[16-17]。本试验主要通过调整培养基中的激素水平最终获得丝棉木松散型胚性愈伤组织,发现适宜浓度的2,4-D会加快愈伤组织形成,并有利于形成结构松散的愈伤组织,但2,4-D浓度过高会导致愈伤组织质地变软,最终导致细胞褐化死亡。这与霍云谦[18]在诱导甘草(Glycyrrhizauralensis)愈伤组织时发现随着2,4-D浓度的提高愈伤组织褐化程度加重,认为2,4-D使用浓度不宜过高的结论相一致。
BA作为外源激素可改善细胞内源生长素和细胞分裂素的比例,调节细胞生理生化状态,有利于胚性愈伤组织的发生。有研究表明[19-20],培养基中2,4-D与BA配合使用有利于胚性愈伤组织发生。本试验单独使用2,4-D或BA均不能获得胚性愈伤组织,但当BA配合使用2,4-D时,愈伤组织胚性化;当培养基中2,4-D浓度较BA浓度高或低时,愈伤组织胚性化程度均较低;当采用相同浓度的2,4-D和BA,即含有0.5 mg/L 2,4-D和0.5 mg/L BA的培养基上可诱导出结构松散、质地较硬的胚性愈伤组织。史滟滪等[21]认为2,4-D在愈伤组织胚性化过程中起决定性作用,在一定浓度范围内浓度的增加有利于胚性愈伤组织的诱导,2,4-D浓度过高或过低均不利于胚性愈伤组织的形成和分化再生。因此,在诱导胚性愈伤组织时需要注意BA和2,4-D的配比使用量,2,4-D比例过高时,愈伤组织继续保持薄壁细胞特性;BA比例过高会导致愈伤组织老化,失去愈伤组织特性,分化出不定芽等组织结构。
适时的继代培养和继代选择是获得均质的松散型胚性愈伤组织的关键。在胚性愈伤组织增殖培养过程中,要对胚性愈伤组织进行继代选择,否则会造成胚性与非胚性愈伤组织、松散型与紧密型的愈伤组织混合继代,则很难获得均质的松散型胚性愈伤组织。在胚性愈伤组织增殖培养过程中,胚性愈伤组织退化是不可避免的,部分胚性愈伤组织可能会因为一些非胚性细胞的竞争优势而丧失胚性。闵义等[22]认为非胚性细胞容易占据生长的优势,应及早对胚性愈伤组织进行筛选,剔除非胚性愈伤组织,对保持接种物的均匀十分重要。因此,在继代培养时需结合显微镜观察,判断愈伤组织胚性,有目的筛选结构松散、质地硬脆的胚性愈伤组织进行继代培养,可加快获得均质的松散型胚性愈伤组织。同时,胚性愈伤组织的继代培养周期也会对其产生影响,继代培养周期过长可能会由于培养基营养不足等原因,导致胚性愈伤组织丧失胚性;而继代培养周期过短会增加工作量,对愈伤组织造成机械损伤,不利于愈伤组织生长。
本试验建立了一套高效的丝棉木松散型胚性愈伤组织诱导体系,总结如下:以不带腋芽的丝棉木幼嫩茎段为外植体,在MS+1.0 mg/L 2,4-D培养基上可以诱导出松散型愈伤组织;将松散型愈伤组织转接到MS+0.5 mg/L BA+0.5 mg/L 2,4-D的培养基上,经过30 d培养即可获得胚性愈伤组织;将诱导出的胚性愈伤组织转接到MS+0.25 mg/L BA+0.5 mg/L 2,4-D的培养基上,每15 d继代培养一次,继代时选择结构松散、质地较硬的愈伤组织进行继代,2~3次继代培养后即可获得均质的丝棉木松散型胚性愈伤组织。本试验结果可用于丝棉木的组培快繁、离体诱变育种及遗传转化等研究。
