保加利亚乳杆菌LJJ 自溶的影响因素分析*
2013-10-30崔文明刘鹭张书文逄晓阳李红娟吕加平
崔文明,刘鹭,张书文,逄晓阳,李红娟,吕加平
(中国农业科学院农产品加工研究所,农业部农产品加工综合性重点实验室,北京,100193)
乳酸菌自溶现象在乳酸菌发酵制品中普遍存在,是菌体自发进行的细胞溶解现象,被认为是细菌在不利环境中维持自我菌群生存的一种保护机制[1]。细菌自溶与自溶酶密切相关,通常认为自溶是由细菌内自溶酶的失衡作用所引起。自溶过程中自溶酶对细胞壁的水解作用会导致细胞壁破裂而出现孔洞,致使细胞质内容物流失[2]。
乳酸菌自溶过程中释放的胞内蛋白酶、肽酶、酯酶等酶类,可将蛋白、多肽和脂肪分解成不同的风味物质或风味前体物质,从而形成发酵制品的特殊风味和口感[3]。一般情况下,发酵剂菌株自溶对发酵制品的品质形成起着积极作用。以干酪生产为例,比较高自溶菌株Lactobacillus lactissubsp.cremorisAM2 与低自溶菌株Lactobacillus lactissubsp.cremorisHP 生产的切达干酪品质后发现,前者没有苦味且风味浓郁,而后者则苦味明显,且风味物质种类显著少于前者[4]。由于干酪成熟过程中产生的良好风味主要依赖于乳酸菌自溶所释放酶的水解作用,所以释放酶的种类及数量将决定着干酪成熟周期长短和风味优劣[5-6],表明发酵剂菌体快速自溶在一定程度上有利于促进干酪成熟。然而,当发酵剂菌体自溶速率过快时,会导致发酵制品产酸不足、凝乳不良及乳糖残留过多等问题而影响产品的品质和得率[7]。
鉴于乳酸菌自溶在发酵乳制品中的普遍性、重要性,而自溶酶调控自溶的相关机制尚不清晰的现状,本研究主要以保加利亚乳杆菌LJJ 菌株为研究对象,考察菌体温育温度、温育时间、环境pH、菌体生长阶段、SDS 浓度,Triton X-100 浓度对菌体自溶特性及溶菌酶活性、自溶过程的菌体形态变化的影响规律,以期初步解释乳酸菌自溶的诱发原因和自溶规律,为更进一步探讨乳酸菌的自溶机理提供依据。
1 材料与方法
1.1 材料与试剂
德式乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaricus)LJJ(本实验室分离保存);EDTA,HCl(分析纯,国药化学试剂有限公司)、十二烷基磺酸钠(SDS)(分析纯,北京拜尔迪生物有限公司)、Tris Base(Angus Chemical Company)、MRS 培养基(北京陆桥技术有限责任公司),溶菌酶检测试剂盒(南京建成生物有限公司)。
1.2 仪器与设备
AUW220 电子天平,日本 Shimadzu 公司;UV2300 分光光度仪,上海天美科学仪器有限公司;DHP-9082 型电热恒温培养箱,上海一恒科学仪器有限公司;DL-CJ-IN 高性能无菌试验台,哈尔滨市东联公司;LDZX-50KB 立式压力蒸汽灭菌锅,上海申安医疗器械厂;JY92-ⅡN 超声波细胞破碎机,宁波新芝生物科技股份有限公司;S-3400N 型扫描电镜,日本日立公司。
1.3 方法
1.3.1 菌株保藏及培养基制备
保存于-20℃冰箱的冻干菌粉,经MRS 液体培养基于37℃条件下活化3 次以上,然后储存于4℃冰箱备用。MRS 液体培养基按照商品说明书所示比例配制,115℃灭菌20 min。
1.3.2 菌体培养、收集、洗涤及重悬
经活化的实验菌株培养至对数生长期后,以4%(v/v)的接种量接种于MRS 液体培养基,37 ℃下培养至目标菌体浓度后,离心(5 000 r/min,4℃,10 min)收集菌体。无菌生理盐水悬浮洗涤菌体,重复洗涤3 次,无菌备用TE 缓冲液(50 mmol/L Tris,50 mmol/L EDTA)洗涤菌体1 次,悬浮收集菌体于适当pH 的上述TE 缓冲液,备用。
1.3.3 自溶度的检测方法
LJJ 菌悬液(OD600nm=0.4 ~0.6),取适量去除菌体,测定上清液OD260nm,读数记为A0。另取适量上述菌悬液置于培养箱温育t h 后,取样去除菌体,测定上清液OD600nm,读数记为At。超声波冰浴破碎(400 W,工作3 s,间隙3 s)剩余菌悬液至透明(表明菌体完全破碎),取样去除菌体,测定溶液OD260nm,读数记为As。菌体自溶度计算:
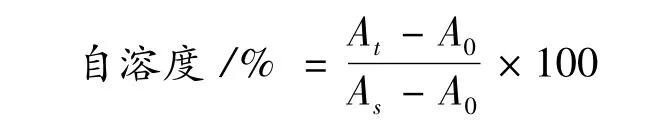
1.3.4 菌体生长阶段对其自溶度的影响
分别选取来自对数生长初期、中期、末期,生长稳定期和生长末期的菌体细胞,重悬于pH 8.0 的缓冲液中于37℃下振荡温育24h,测定其自溶度。
1.3.5 不同pH 对菌体自溶度的影响
洗涤菌体分别重悬于pH 为2.0,4.0,5.0,6.0,7.0,8.0,10.0 的洗涤缓冲液中,于37℃,振荡温育,测定其自溶度。
1.3.6 温度对菌体自溶度的影响
取对数生长期的菌体细胞,重悬于pH 8.0 的洗涤缓冲液中,分别置于4,25,37,50,60 和70℃环境中振荡温育,测定其自溶度。
1.3.7 SDS 浓度对菌体自溶的影响
取对数生长期菌体细胞重悬于pH 8.0 的洗涤缓冲液中,悬浮液中分别添加SDS 至终浓度为0.10,0.25,0.50 及1.00 g/L,置于37℃下振荡温育,测定其自溶度。
1.3.8 Triton X-100 浓度对菌体自溶的影响
取对数生长期菌体细胞,重悬于pH8.0 的洗涤缓冲液中,悬浮液中分别添加Triton X-100 至终浓度为0.25,0.50 及1.00 g/L,置于37℃下振荡温育,测定其自溶度。
1.3.9 扫描电镜观察
收获处于对数生长期的菌体细胞,生理盐水洗涤3 次,TE 缓冲液洗涤1 次后,取部分细胞,重悬浮于电镜样品固定液,备用。剩余样品取一部分添加终含量0.50 g/L 的SDS 与剩余部分样品置于37℃培养箱孵育24 h 后,离心收集菌体,重悬于电镜样品固定液。将正常细胞,24 h 自溶细胞和SDS 自溶细胞制备电镜样品后,置于扫描电镜下观察。
1.3.10 溶菌酶活力检测
采用比浊度法,参见试剂盒使用说明书。
1.3.11 数据处理与分析
应用Statistics Analysis System(SAS)9.2 进行单因素方差分析,P<0.05 视为差异显著。
2 结果与分析
2.1 不同生长阶段LJJ 菌株自溶度的变化
图1 结果显示,随着LJJ 细胞的不断增殖,细胞自溶度逐步降低(未包括迟滞期,0 ~2 h)。对数生长期(4 ~14 h)细胞具有最大的自溶度,约为70.0%,整个对数生长期阶段,生长中期(10 ~12 h)的细胞自溶度略高,但对数生长期内细胞自溶度间无在统计学意义上的显著性差异(P>0.05)。稳定期(20 ~32 h)细胞自溶度次之,约为43.0%,极显著低于对数生长期自溶度(P<0.01)。衰退期(36 ~45 h)细胞自溶度最低,一般低于20.0%且随着时间的延长自溶度逐渐降低。来自对数生长期与稳定期过渡区间(16 ~18 h)和稳定期与衰退期过渡区间(32 ~34 h)的LJJ 细胞自溶度分别介于43.0% ~60.0% 和20.0% ~43.0%,且与来自对数生长期,稳定期,衰退期的LJJ 细胞自溶度之间存在显著性差异(P<0.01)。
2.2 不同pH 对LJJ 菌株自溶的影响
研究结果表明,LJJ 菌株发生自溶的最适pH 为6.0 ~8.0。菌体自溶与环境pH 值关系密切,低酸性环境可显著抑制乳酸菌的自溶。自溶8 h 时,LJJ 菌体自溶度随着环境pH 升高而增大,彼此间差异显著(P<0.01)。自溶持续发生24h 时,除pH 5.0 菌悬体系的自溶度较低外,其余体系的自溶度开始趋于一致。当自溶时间延长至96h 时,pH 6.0 环境体系中菌体自溶度反而高于pH 8.0 和pH 7.0 环境体系中的菌体自溶度(图2 A)。环境pH 大于8.0 时,LJJ 自溶受到部分抑制,当pH 大于或等于10.0 时,自溶受到显著(P<0.01)抑制(图2B)。
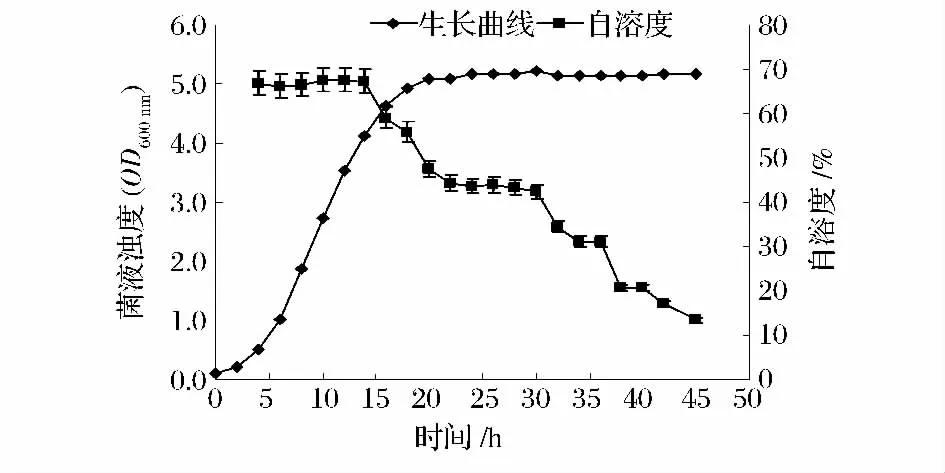
图1 来自不同生长阶段的LJJ 菌株自溶度的变化Fig.1 The autolysis rate of LJJ from different growth phases
2.3 孵育温度对LJJ 菌株自溶的影响
由图3A 中所示,0 ~50℃,在相同温育时间下,LJJ 的自溶度随温度升高而增大,同时到达自溶度趋于稳定所需的时间也随着温度的升高而缩短。其中,环境温度50℃时,96h 时的自溶度为90.6%,为4 个温度水平中的最大自溶度,而且在12h 已基本达到最大,此时自溶度为81.3%显著高于37℃时的46.8%(P<0.01)。而图3B 显示,当温度升高至60℃以上时,LJJ 自溶度开始随着温度的升高而降低。
2.4 SDS 对LJJ 自溶的抑制作用

图3 温度对乳酸菌自溶的影响Fig.3 Effects of incubation temperature on the autolysis of LJJ
当环境中存在SDS 时,LJJ 的自溶受到抑制。环境中SDS 浓度为0.10 g/L 时,乳酸菌自溶度即降为空白对照的约62.0%,且随着悬浮体系中SDS 含量的增加,乳酸菌的自溶度逐渐降低,当环境中SDS 浓度为0.50 g/L 时,乳酸菌的自溶几乎被完全抑制,此时自溶度仅为对照的0.03%。因此,SDS 是乳酸菌LJJ 自溶的较强抑制剂(图4A 所示)。如图4B 所示,与商品溶菌酶试验组对比,SDS 对商品自溶酶的抑制效果与LJJ 自溶抑制基本完全对应,表明SDS 对LJJ自溶的抑制可能是通过抑制其自溶酶活性而实现的。
2.5 Triton X-100 对LJJ 自溶的影响
研究结果如图5 所示,Triton X-100 的存在可促进LJJ 自溶的发生并增强溶菌酶的活性,且随着Triton X-100 浓度的增大,菌体自溶增速和酶活增强作用越明显。当环境体系中Triton X-100 添加量为1.0 g/L 时,LJJ 的自溶度相比对照增大了20.7%(温育24h)(图5A),而溶菌酶的活性与空白对照相比提高了39.5%。比较图5A 和图5B,发现Triton X-100对溶菌酶酶活性的增强效果与加速LJJ 自溶的效果基本趋于一致。
2.6 扫描电镜观察LJJ 自溶中的细胞形态变化

图4 SDS 浓度对LJJ 自溶与溶菌酶活力的影响Fig.4 Effects of SDS concentration on the autolysis of LJJ and lysmozye activity

图5 Triton X-100 对LJJ 自溶和溶菌酶的影响Fig.5 Effects of Triton X-100 concentration on the autolysis of LJJ and lysmozye activity
对数生长期收获的LJJ 菌体细胞,菌体完整饱满,表面光滑(图6A);而将正常LJJ 细胞于TE 缓冲液(pH8.0)中37℃下温育24 h 后,LJJ 细胞的完整性遭到破坏,细胞发生不同程度的萎缩和凹陷,而且在细胞表面出现孔洞(图6B),胞内内容物也开始逐步释放至周围环境中。相同TE 缓冲液中添加终浓度0.50 g/L 的SDS 时,虽然LJJ 的细胞出现了不同程度萎缩、凹陷和变形,但其细胞上并未出现明显的孔洞(图6C),表明SDS 在一定程度上通过抑制自溶酶活性而抑制菌体自溶的发生。

图6 LJJ 正常细胞与自溶细胞的扫描电镜图片Fig.6 Electron micrographs showing the control cells and the autolysis cells of LJJ
3 讨 论
3.1 乳酸菌的最适自溶条件
本研究确定的LJJ 的最适自溶条件为最适温度50℃(0 ~50℃),最适环境pH 6.0 ~8.0。该结果与李艾黎[8]等人和孙洁[9]等人分别研究的保加利亚乳杆菌KLDS 1.9201 和LD3 的最适自溶温度55℃(0~55℃),最适环境pH 5.5 ~7.5 和pH 6.0 ~7.0 基本一致。不同之处在于孙洁[9]等研究发现,当环境pH 7.5 时,自溶度就开始有所下降,而本研究发现虽然在最适pH 范围内的初始阶段自溶度随会随着pH的升高而增大,但自溶24h 时,不同环境pH 下的自溶度趋于相同。此外,Kang[10],冯镇[11]等研究的干酪乳杆菌和乳杆菌LB-3 的最适自溶条件也处于相一致的温度及pH 范围。
对数生长期菌体细胞自溶度最大的结论与Kang[10]等人的研究结论一致,但Kang[10]等人的研究发现来自对数生长初中末期的菌体细胞的自溶度间也存在显著性的差异与本研究存在不一致处。比较两者研究结果发现,当菌体生长至OD600nm约为1.5时,此时菌体细胞表现出最大的自溶活性。
3.2 乳酸菌自溶与自溶酶
据报道细菌自溶是由细菌中存在的若干自溶酶引起,即自溶酶破坏细胞壁对细菌自溶发挥着关键性作用[12-14]。
(1)最适自溶条件与乳酸菌自溶酶
LJJ 自溶的最适pH 和温度范围与自溶酶的最适作用条件一致。以研究较深入的溶菌酶[15-16]为例,其最适pH 范围约在6.0 ~8.0,而最适作用温度在65~75℃。当温度高于65℃以上时,其热稳定性开始降低,半衰期随着温度的升高快速减少。65℃时,溶菌酶半衰期大于3 h,75℃时半衰期则为45 min[17]。对比上述实验结果,乳酸菌的自溶最适pH 范围在6.0 ~8.0,与溶菌酶酶活的最适范围pH 一致。自溶的最适温度在60℃以下,低于溶菌酶的最适作用温度,推测这是由于当溶菌酶在较高温度下短期内的酶活虽有较大增强,但热稳定性开始降低。在孵育的24 h 内,短时间的高酶活性的自溶效果要低于较低酶活性下长时间的自溶效果。
(2)不同生长阶段自溶酶的变化规律
正常情况下,自溶酶对菌体细胞分裂作用是有序进行的,不会导致菌体的自溶,而一旦在外界刺激下将导致作用失序而引起自溶[18]。此时自溶酶产量越多,自溶速率也越高。对数生长期细菌快速增殖,细胞生命活动活跃,负责分裂子母代细胞细胞壁的自溶酶得以大量产生,所以处于此阶段的细胞在分离、洗涤、悬浮后最易发生自溶。细菌生长进入稳定期后,由于细菌菌体处于相对稳定的动态平衡中,细胞的活跃度显著降低,自溶酶生成量减少,难以发生自溶。当细菌生长进入衰退期后,由于营养、环境等因素的制约,部分菌体开始裂解死亡,且负责破坏细胞壁的自溶酶的产量比稳定期细胞有所增加[19]。
(3)乳酸菌自溶与自溶酶抑制剂和催化剂
SDS 对溶菌酶活性和对LJJ 自溶的抑制趋势基本一致,Triton X-100 对溶菌酶活性和对LJJ 自溶的增强效果基本一致,均表明溶菌酶在LJJ 的自溶中起着重要作用。
已有的报道显示,不同乳酸菌中自溶酶的种类及数量都各不相同[14,18]。因此,实现对LJJ 自溶的完全抑制,则需要对多种自溶酶同时存在抑制效果。而SDS 刚好是自溶酶中溶菌酶[20]、N-乙酰胞壁酰-L-丙氨酸酰氨酶和部分内肽酶的强抑制剂[20]。因此,SDS对乳酸菌自溶的抑制效果,是与其较广较强的自溶酶抑制范围相一致的,是SDS 对自溶酶酶活抑制作用的结果。Triton X-100 被广泛应用溶菌酶[21],N-乙酰胞壁酰-L-丙氨酸酰氨酶[22]于自溶酶酶谱分析的复性剂,其可以通过与变性蛋白的结合形成复合体,从而避免蛋白间聚合并在合适的条件下使蛋白正确折叠保持活性,从而在一定程度上起到催化自溶酶活性的效果[23]。
环境pH、温度、SDS、Triton X-100 和不同生长阶段等通过影响乳酸菌自溶酶活性而影响乳酸菌自溶。所以,通过调控乳酸菌自溶酶活性即可达到调控乳酸菌自溶的目的。
[1] Angelis M D,Pollacci P,Gobbetti M. Autolysis ofLactobacillus sanfranciscensis[J]. European Food Research and Technology,1999,210 (1):57 -61.
[2] Østlie H M,Vegarud G,Langsrud T. Autolysis of propionibacteria:Detection of autolytic enzymes by renaturing SDS-PAGE and additional buffer studies[J]. International Journal of Food Microbiology,2007,117 (2):167 -174.
[3] Slattery L,Callaghan J,Fitzgerald G F,et al.Lactobacillus helveticus-A thermophilic dairy starter related to gut bacteria[J]. Journal of Dairy Science,2010,93 (10):4 435 -4 454.
[4] Chopin A,Bolotin A,Sorokin A,et al. Analysis of six prophages inLactococcus lactisIL1403:different genetic structure of temperate and virulent phage populations[J].Nucleic Acids Research,2001,29 (3):644 -651.
[5] Christensson C,Pillidge CJ,Ward LW,et al. Nucleotide sequence and characterization of the cell envelope proteinase plasmid inLactococcus lactissubsp.cremorisHP[J].Journal of Applied Microbiology,2001,91 (2):334 -343.
[6] Hickey DK,Kilcawley KN,Beresford TP,et al. Starter strain related effects on the biochemical and sensory properties of Cheddar cheese[J]. Journal of Dairy Research,2007,74 (1):9 -17.
[7] Pillidge CJ,Rallabhandi PS,Tong XZ,et al. Autolysis ofLactococcus lactis[J]. International Dairy Journal,2002,12 (2 -3):133 -140.
[8] 李艾黎,邓凯波,霍贵成. 环境因素对酸奶菌株自溶的影响[J]. 微生物学通报,2008,35 (8):1262 -1267.
[9] 孙洁. 乳酸菌发酵剂菌株的自溶特性及机理研究[D]. 北京:中国农业科学院,2010:29 -37.
[10] Kang OJ,Vézinz LP,Labcrge S,et al. Some factors influencing the autolysis ofLactobacillus bulgaricusandLactobacillus casei[J]. Journal of Dairy Science,1998,81(3):639 -646.
[11] 冯镇,张兰威. 乳酸菌发生自溶的影响因素研究[J].中国乳品工业,2003,31 (3):7 -9.
[12] Lortal S,Chartier MP. Role,mechanisms and control of lactic acid bacteria lysis in cheese [J]. International Dairy Journal,2005,15 (6 -9):857 -871.
[13] Nobuya Inagaki,Akinori Iguchi,Takahiro Yokoyama,et al. Molecular properties of the glucosaminidase AcmA fromLactococcus lactisMG1363:Mutational and biochemical analyses[J]. Gene,2009,447 (2):61 -71.
[14] Rice KC,Bayles KW. Molecular control of bacterial death and lysis[J]. Microbiology and Molecular Biology Reviews,2008,72 (1):85 -109.
[15] 刘慧,王凤山,楚杰. 蛋清溶菌酶部分酶学性质及酶活性的影响因素研究[J]. 中国生化药物杂志,2008,29 (6):385 -387.
[16] 李潜. 溶菌酶高产菌株的筛选及其产酶研究[D]. 石家庄:河北农业大学,2008:19 -29.
[17] Goyal MK,Roy I,Banerjee UC,ea tl. Role of benzyl alcohol in the prevention of heat-induced aggregation and inactivation of hen egg white lysozyme [J]. European Journal of Pharmaceutics & Biopharmaceutics,2009,71(2):367 -376.
[18] Vollmer W,Joris B,Charlier P,et al. Bacterial peptidoglycan (murein)hydrolases[J]. FEMS Microbiology reviews,2008,32 (2):259 -286.
[19] Uehara T,Parzych KR,Dinh T,et al. Daughter cell separation is controlled by cytokinetic ring-activated cell wall hydrolysis[J]. EMBO Journal,2010,29 (8):1412 -1422.
[20] Callewaert L,Herreweghe JM,Vanderkelen L,et al.Guards of the great wall:bacterial lysozyme inhibitors[J]. Trends in Microbiology,2012,20 (10):501 -510.
[21] Jebava I,Plockova M,Lortal S,et al. The nine peptidoglycan hydrolases genes inLactobacillus helveticusare ubiquitous and early transcribed[J]. International Journal of Food Microbiology,2011,148 (1):1 -7.
[22] Layec S,Decaris B,Leblond-Bourget N. Diversity of Firmicutes peptidoglycan hydrolases and specificities of the involved in daughter cell separation[J]. Research in Microbiology,2008,159 (7 - 8):507 -515.
[23] Kerff F,Petrella S,Mercier F,et al. Specific structural features of the N -acetylmur -amoyl -L-alanine amidase AmiD fromEscherichia coliand mechanistic implications for enzymes of this family[J]. Journal of Molecular Biology,2010,397 (1):249 -259.
