玫瑰果多酚的提取
2013-11-19刘鹏莉庄桂东王珊珊于丹李群飞迟玉森
刘鹏莉,庄桂东,王珊珊,于丹,李群飞,迟玉森
(青岛农业大学,山东青岛,266109)
玫瑰果也称作蔷薇果,是玫瑰花谢后由花托发育而成的肉质浆果。《中药大辞典》中记载:玫瑰果具有健脾消食,活血调经,敛肺止咳等作用[1]。新近研究发现,玫瑰果还具有抗衰老、抗疲劳、抗辐射、耐缺氧、除血栓、降血压、防癌、治癌、强身壮阳、健脑增智、延年益寿的作用[2-3]。
植物多酚又称单宁或鞣质,广泛存在于蔬菜、水果及茶等植物中,具有抗氧化、抗癌、降血压和预防心脑血管疾病等作用。[4]
本实验采用溶剂法提取玫瑰果中多酚类物质,通过单因素和正交试验筛选,确定提取工艺参数。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料
玫瑰果,青岛农业大学校园内种植。
1.1.2 试剂
没食子酸对照品,中国药品生物制品检定所;Na2CO3,95%乙醇,福林酚,均为分析纯。
1.1.3 仪器
1 000~5 000 μL移液枪,DRAGON;TU-1810S型紫外可见分光光度计,北京普析通用仪器有限责任公司;RE-52AA型旋转蒸发器,上海亚荣生化仪器厂;AR1140电子分析天平,奥豪斯国际贸易(上海)有限公司;SX-7001D电子天平,顺德拓普域电子有限公司;102型电热鼓风干燥箱,中国龙口市先科仪器公司;双列四孔电热恒温水浴锅,中国龙口市先科仪器公司。
1.2 实验方法
1.2.1 玫瑰果处理方法
将凋谢的玫瑰花花托去除残余花瓣、花萼、花蕊及花柄,留曲玫瑰果实。
1.2.1 玫瑰果干物质含量测定
定量称取10 g玫瑰果,放入干燥箱中90℃干燥至前后两次称量总重变化小于0.02 g。真空冷却,称量干燥后的玫瑰果质量,计算玫瑰果干物质含量。

1.2.2 标准曲线的绘制[5]
1.2.2.1 试剂配制
10%福林酚(Folin-Ciocalteu)试剂:将20 mL福林酚(Folin-Ciocalteu)试剂转移到200 mL容量瓶中,用水定容并摇匀。
75 g/L NaCO3溶液配制:称取37.50 g±0.01 g NaCO3,加适量水溶解,转移至500 mL容量瓶中,定容至刻度,摇匀。
1.2.2.2 绘制标准曲线
精密称取0.110 g±0.001 g没食子酸,加水溶解并定容至100 mL,摇匀,得没食子酸标准储备溶液(1 000 μg/mL)。用移液枪分别移取 1.0、2.0、3.0、4.0、5.0 mL没食子酸标准溶液于100 mL容量瓶中,分别用蒸馏水定容至刻度,摇匀,得没食子酸工作液,质量浓度分别为 10、20、30、40、50 μg/mL。
用移液枪分别移取没食子酸工作液各1.0 mL于10 mL容量瓶中,向容量瓶中分别加入5 mL 10%福林酚试剂,摇匀,静置2~3 min,再加入4 mL 75 g/L NaCO3溶液,摇匀,静置60 min。同时做空白。
用10 mL比色皿进行光谱扫描,确定770 nm处为最大吸收波长。在770 nm波长条件下,用分光光度计测定没食子酸工作液的吸光度(A)。以吸光度A为纵坐标,没食子酸质量浓度c(μg/mL)为横坐标,制作标准曲线。建立回归方程如下:

1.2.3 玫瑰果多酚的提取[6-7]
定量称取10 g玫瑰果果肉,粉碎,加入提取剂,在一定温度条件下提取一定时间,将提取液过滤,既得玫瑰果多酚提取液。取少量提取液用于多酚含量测定,剩余提取液真空浓缩至质量恒定,既得多酚粗提物。

1.2.4 总酚的测定[21]
取1 mL待测液至50 mL容量瓶中,定容至刻度。取1 mL定容后的溶液于10 mL容量瓶中,加入5 mL 10%福林酚试剂,摇匀,静置2~3 min,再加入4 mL 75 g/L NaCO3溶液,摇匀,静置60 min。同样条件下以蒸馏水设置空白对照。用10 mL比色皿在770 nm下测定吸光度,并计算多酚得率。

A,样品吸光度;V,样品提取液体积(mL);d,稀释因子(通常为1 mL,稀释成100 mL,则其稀释因子为100),50;SLOPEstd,没食子酸标准曲线的斜率,0.0108;m,样品干物质含量(g);m0,样品质量(g)。
2 结果与分析
2.1 玫瑰果多酚提取单因素试验研究
2.1.1 提取剂对多酚提取效果的影响
由于乙醇安全无毒、廉价易得、回收率高,本实验只选用乙醇与水2种试剂作为提取剂。
定量称取10 g玫瑰果果肉2份,粉碎,分别加入20倍量(mL/g)的无水乙醇、水,置于70℃水浴中提取40 min。结果如图1所示。
从学生认为这门课程需要改进的方面来看,在学习资源方面,学生希望增加英语歌曲、视频等多媒体资源。在学习内容方面,学生希望能更多地接触到与日常生活密切相关的话题。
由图1可以看出,用无水乙醇做提取剂时,多酚得率较高。并且,由于水中易溶解氧,当用水作为提取剂提取多酚时,易造成多酚氧化,而氧气在乙醇中溶解度较低,因此将乙醇选为提取剂。
2.1.2 乙醇体积分数对多酚提取效果的影响
定量称取10 g玫瑰果果肉5份,粉碎,分别加入20倍量(mL/g)不同体积分数的乙醇溶液(55%、65%、75%、85%、95%),置于 70℃ 水浴中提取 40 min。结果如图2所示。

图1 提取剂对多酚得率的影响Fig.1 Effect of solvent type on the yield of polyphenols

图2 乙醇体积分数对多酚得率的影响Fig.2 Effect of ethanol concentration on the yield of polyphenols
由图2可知,当乙醇体积分数为75%,多酚得率最高。可能是由于多酚类物质以氢键与蛋白质、多糖结合为稳定的化合物,而有机溶剂能够使氢键断裂;同时,玫瑰果中多酚类物质可能为水溶性物与脂溶性物的混合体,乙醇与水的混合体更利于多酚的溶解。因此,确定乙醇体积分数为75%。
2.1.3 料液比对多酚提取效果的影响
定量称取10 g玫瑰果果肉5份,粉碎,分别加入10、15、20、25、30 倍量(mL/g)体积分数为 75% 的乙醇溶液,置于70℃水浴中提取40 min。结果如图3所示。
由图3可知,随着料液比的减小,多酚得率增加,当料液比小于1∶20时,多酚得率略微降低。这说明当料液比为1∶20时,提取剂已足够将玫瑰果中的多酚溶解,同时考虑提取剂用量及浓缩时间,选取1∶20为提取料液比。
定量称取10 g玫瑰果果肉5份,粉碎,加入20倍量(mL/g)体积分数为75%的乙醇溶液,分别置于40、50、60、70、80℃ 水浴中提取 40 min。结果如图 4所示。
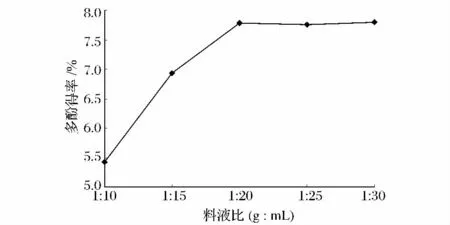
图3 料液比对多酚得率的影响Fig.3 Effect of material/liquid ratio on the yield of polyphenols

图4 提取温度对多酚得率的影响Fig.4 Effect of extraction temperature on the yield of polyphenols
由图4可知,随温度升高,多酚得率增加,当温度超过60℃时,多酚得率又有所减少。可能是由于温度升高使多酚溶解度增大,而过高温度使多酚氧化造成损失。因此,选择60℃为提取温度。
2.1.5 提取时间对多酚提取效果的影响
定量称取10 g玫瑰果果肉5份,粉碎,加入20倍量(mL/g)体积分数为75%的乙醇溶液,置于60℃水浴中分别提取 10、20、30、40、50 min。结果如图 5所示。
由图5可知,随提取时间的延长,多酚得率增大,当提取超过40 min时,多酚得率无明显变化。因此,选择40 min为提取时间。
2.1.6 提取次数对多酚提取效果的影响
定量称取10 g玫瑰果果肉5份,粉碎,加入20倍量(mL/g)体积分数为75%的乙醇溶液,置于60℃水浴中提取40 min。分别提取 1、2、3、4、5 次。结果如图6所示。

图5 提取时间对多酚得率的影响Fig.5 Effect of extraction time on the yield of polyphenols

图6提取次数对多酚得率的影响Fig.6 Effect of extraction times on the yield of polyphenols
由图6可知,提取3次时,多酚得率最高,但与提取2次相比,无明显优势。而且,当提取次数达到4次时,多酚得率反而有所下降,可能是由于长时间提取使多酚氧化损失。因此,可虑到生产成本,选择2次为提取次数。
2.2 玫瑰果多酚提取优化实验结果
在单因素试验基础上,采用L9(34)正交试验,对乙醇体积分数、料液比、提取温度及提取时间进行试验,确定优化工艺参数。
由表1极差(R)分析可知,各因素对多酚提取率的影响次序为D>A>C>B,即乙醇体积分数(D)为主要影响因素,其次为提取温度(A)、料液比(C)、提取时间(B),最佳提取工艺为D2A2C2B2。
由于得出的最佳工艺组合在正交试验中并没有出现,需进行补充实验。定量称取10 g玫瑰果果肉,粉碎,按工艺组合D2A2C2B2进行提取实验,即加入20倍量(mL/g)体积分数为75%的乙醇溶液,置于70℃水浴中提取40 min,测定多酚得率为9.17%,大于正交试验结果中的最大值9.03,因此,确定最佳提取工艺为D2A2C2B2。
2.3 重复实验
利用正交试验得出的最佳提取工艺,定量称取3份玫瑰果,按料液比1∶20加入体积分数为75%的乙醇,在70℃下提取40 min,重复提取2次。结果见表2。

表1 正交试验设计及结果Table 1 Orthogonal array design arrangement and experimental results

表2 重复性实验结果Table 2 Repeatability verification for optimized extraction conditions
3 结论与讨论
(1)实验采用乙醇法提取玫瑰果多酚,具有安全、环保、操作简单的特点。
(2)实验采用新国标法测定玫瑰果多酚得率,实验结果更加准确、可信。
(3)正交试验确定了最佳提取工艺为:提取温度70℃,提取时间40 min,料液比 1∶20(g∶mL),乙醇体积分数75%,提取次数2次。方差分析表明,乙醇体积分数对提取效果影响显著,提取温度和料液比次之,提取时间影响不显著。
(4)乙醇浸提法提取玫瑰果多酚得率达9%以上,这表明玫瑰果中多酚物质含量较高,可以作为多酚的提取原料,为保健食品领域提供新的资源。
(5)玫瑰果多酚的提取温度在单因素试验中的结论为60℃较好,但在正交试验中则70℃较好,这可能是由于单因素试验中提取次数选取为一次,提取液中多酚浓度大、与氧气接触的机会大,提取温度超过60℃时,继续升温,多酚几乎不再溶出,而过高的温度使多酚氧化破坏;正交试验中提取次数选取为两次,第二次提取液中多酚的浓度较小,升高温度使多酚的溶解度及扩散速度增大,利于其溶出,同时,提取液中多酚含量较少,不易与氧气接触,升温造成的氧化损失少。因此,受提取次数的影响,最终通过正交试验确定的提取温度为70℃。
[1] 南京中医药大学.中药大辞典[M].上海:科学技术出版社,2006.
[2] 史凤英,吴英俊,吴景时.牡丹江产野玫瑰果对血管药理作用研究[J].中国林副特产,2005(2):36.
[3] 李明,李艳芳,孙永超.中药玫瑰花的研究进展[J].卫生职业教育,2007,25(8):146-148.
[4] 石碧,狄莹.植物多酚[M].北京:科学出版社,2000.
[5] GB/T 8313-2008.茶叶中茶多酚和儿茶素类含量的检测方法[S].
[6] 黄皓,毛志方,涂云飞等.两种方法测定茶叶中茶多酚含量的比较[J].中国茶叶加工,2009(2):43-44.
[7] 汪跃华,孟祥春,林银凤等.南山茶茶籽多酚的提取及测定[J].安徽农业科学,2011,39(1):118-119.
