全质紫甘薯汁护色增色技术
2013-10-30刘婷婷李新华陈红丽
刘婷婷,李新华,陈红丽
(沈阳农业大学 食品学院,辽宁 沈阳,110866)
紫甘薯,又名黑薯,是我国从日本引种、改良、驯化、培育成功的甘薯新品种[1]。由于紫甘薯中含有大量以花色苷类物质为主的活性物质,因此具有较强的降血压、降血脂、抗突变、抗氧化、抗肿瘤等生理活性和功能[2]。随着我国国民生活水平的不断提高,紫甘薯的营养价值和药用价值受到越来越多的重视,尤其是紫甘薯深加工产品的发展前景十分广阔[3]。
国内的紫甘薯产品市场大多处在初级阶段,而且少有大规模的紫甘薯深加工产品上市,不少技术问题有待研究。紫甘薯深加工产品,特别是饮料类产品中往往要添加各种酸味剂等调配成分,酸性成分使用不当,常会出现紫甘薯紫色泽不稳定问题,如褪色或色度变暗以及褐变等现象。这使得紫甘薯产品失去了鲜艳诱人的感官品质。在紫甘薯汁以及紫甘薯饮料类产品研制过程中,防止或延缓紫甘薯色泽改变,研究紫甘薯色泽变化规律,合理利用各种酸味剂,稳定和改善其天然色泽是一个必须要解决的技术问题。
本试验在研究全质紫甘薯汁的制作工艺的同时,重点对全质紫甘薯汁的色泽保护及增色方面进行研究,以便得出具有清亮紫红色的全质紫甘薯汁,为继续开发紫甘薯全质饮料等产品提供一定的理论和技术指导。
1 材料与方法
1.1 材料与试剂
紫甘薯,市售;蔗糖,柠檬酸,蜂蜜,柠檬酸钠,黄原胶,海藻酸钠,羧甲基纤维素钠,抗坏血酸,富马酸,均为市售食用级;α-淀粉酶(酶活≥4 000 U/g),北京奥博星生物技术有限公司。
1.2 仪器与设备
TDL-5-A 型离心机,上海安亭科学仪器厂;pHS-25 型酸度计,上海理达仪器厂;电子分析天平,北京奥多利斯仪器系统有限公司;SS230-A 多功能是食物搅拌器,顺德市方胜电器实业有限公司;HH-6 型数显恒温水浴锅,常州国华电器有限公司;TD-45 数显糖度计,浙江托普仪器有限公司;CR-400 型全自动色差仪,柯尼卡美能达公司。
1.3 实验方法
1.3.1 全质紫甘薯汁制备工艺流程
原料选择→去皮→清洗切分→护色处理→打浆→过滤→酶解→紫甘薯汁
1.3.2 操作要点
1.3.2.1 原料预处理
原料选取无霉变、无虫蚀、无冻伤、无机械伤、紫色素均匀的新鲜紫甘薯。冲去紫甘薯外表的泥沙和杂物,手工去除表皮后切分成小块。
1.3.2.2 护色、打浆
将紫甘薯小块迅速放入护色剂中护色30 min,随后以4 倍量的水进行打浆并过滤(留下的滤液一般约为原料的4.5 倍)。以打浆后的紫甘薯浆液L*(明度值)和△E*(总色差值)为指标,按设定的护色剂种类、用量分别作单一护色剂的护色及增色效果试验,并在此基础上做复合护色剂的护色及增色效果试验,确定最佳护色工艺条件。
1.3.2.3 酶解
在不同pH 值、酶解温度、酶解时间下加入0.2%α-淀粉酶进行酶解。以可溶性固形物的增长率、L*及△E*为指标,按设定的酶解温度、酶解时间、酶解pH 值分别作单因素试验,分析酶解过程对全质紫甘薯汁色泽的影响。
1.3.3 抗坏血酸对全质紫甘薯汁的护色及增色试验
共6 个处理,分别为0%,0.2%,0.4%,0.6%,0.8%,1.0%的抗坏血酸溶液,加入6 个烧杯,然后将切碎的同质量紫甘薯分别加入到上述不同的溶液中浸泡30 min,打浆并过滤后测定不同烧杯中紫甘薯浆液的L*、△E*并品尝口感。
1.3.4 柠檬酸对全质紫甘薯汁的护色及增色试验
共6 个处理,分别为0%,0.3%,0.6%,0.9%,1.2%,1.5%的柠檬酸溶液,加入6 个烧杯,然后将切碎的同质量紫甘薯分别加入到上述不同的溶液中浸泡30 min,打浆并过滤后测定不同烧杯中紫甘薯浆液的L*、△E*并品尝口感。
1.3.5 富马酸对全质紫甘薯汁的护色及增色试验
共6 个处理,分别为0%,0.4%,0.8%,1.2%,1.6%,2.0%的富马酸溶液,加入6 个烧杯,然后将切碎的同质量紫甘薯分别加入到上述不同的溶液中浸泡30 min,打浆并过滤后测定不同烧杯中紫甘薯浆液的L*、△E*并品尝口感。
1.3.6 复合护色剂对全质紫甘薯汁的护色及增色试验
根据对紫甘薯护色及增色的单因素试验结果,设计二因素三水平的正交试验,以确定紫甘薯护色的最佳条件,试验设计见表1。

表1 正交试验因素水平Table 1 The factors and levels of orthogonal test
1.3.7 酶解过程对全质紫甘薯汁色泽的影响试验
将已护色的紫甘薯浆液取16 份,每份200 mL,标好序号。l ~6 号中用柠檬酸钠及柠檬酸调浆液pH值分别为2.5、3、3.5、4、4.5 和5,加入0.2%α-淀粉酶以60 ℃酶解90 min,离心后取上清液测其可溶性固形物含量、L*及△E*,算出可溶性固形物增长率;7~11 号调pH 值为4.5,加入0.2%α-淀粉酶分别以40、50、60、70、80 ℃酶解90 min,离心后取上清液测其可溶性固形物含量、L*及△E*,算出可溶性固形物增长率;12 ~16 号调pH 值为4.5,加入加入0.2%α-淀粉酶以60 ℃分别酶解50、60、70、80、90 min,离心后取上清液测其可溶性固形物含量、L*及△E*,算出可溶性固形物增长率。以各组可溶性固形物增长率、L*及△E*的大小来分析酶解过程对全质紫甘薯汁色泽的影响。
1.3.8 测定方法
由色差仪通过反射法测定不同处理的样品的L*及△E*。色泽明亮程度主要由L*值反映,L*为0 代表黑色,100 代表白色。L*增加,表示明亮度增加,也就表示色泽更加清亮。总色差由△E*反映,△E*变小表示颜色变浅。
pH 值采用pH 酸度计测定。可溶性固形物含量的测定使用阿贝折射仪。

式中:A1为原紫甘薯打浆后可溶性固形物含量;A2为酶解后可溶性固形物含量。
1.4 数据分析
采用SPSS 软件对试验数据进行分析。
2 结果与分析
2.1 单一酸味成分对全质紫甘薯汁的色泽变化的影响
2.1.1 抗坏血酸对全质紫甘薯汁的色泽变化的影响
抗坏血酸在含有多酚氧化酶的紫甘薯浆液中的护色及增色作用是相当复杂的。它既是还原剂可以还原醌类物质,而且可以作为铜离子的螯合剂,通过—OH 与多酚氧化酶的辅基Cu2+螯和,也可以直接被多酚氧化酶氧化,进行竞争性抑制褐变,从而保护色泽[4]。而且抗坏血酸作为酸化剂,可降低浆液中的pH 值,这就改变了花色苷的存在形式,使蓝色的醌式碱向无色的查尔酮及假碱甚至红色的吡喃阳离子转换。随着pH 的变小,紫甘薯浆液会变为更清亮鲜艳的紫红色,从而起到增色作用。
由图1 可以看出,紫甘薯浆液L*随着抗坏血酸用量的增加而增加。但由于紫甘薯浆液的色泽并不是一个单一的色调,L*这一个单独参数值的变化度不能完全反映紫甘薯浆液的实际变化状况,因此需要对图1 中的△E*也进行分析,得出总色差随抗坏血酸用量增大呈先增大、后减小的趋势。当抗坏血酸的用量为0.6%时总色差达到最大值23.33。
造成这一现象的原因是,当抗坏血酸的用量逐渐加大时,打浆后得到的紫甘薯浆液的pH 值从未护色时的6.4 逐渐向5 过度。紫甘薯浆液中的花色苷也随着pH 值的变化逐渐从醌式碱形式向无色的查尔酮及假碱转化[5],这就使浆液的色泽清亮,L*增加。但也由于这种转化,浆液的△E*变小,颜色逐渐变浅。综合考虑,选择0.6%为较适宜的抗坏血酸用量,此用量的紫甘薯浆液L*为29.98,△E*为23.33,高于新榨的紫甘薯原汁的L*及△E*,且具有较稳定的明亮鲜艳的紫红色,达到了较好的护色及增色效果。

图1 抗坏血酸用量对紫甘薯浆液L* 及△E* 的影响Fig.1 Effect ofascorbic acid content on the L*and △E* in purple sweet potato slurry
2.1.2 柠檬酸对全质紫甘薯汁的色泽变化的影响
柠檬酸中的羰基可与多酚氧化酶中的Cu2+产生比较强的螯合作用,从而对紫甘薯多酚氧化酶的活性有一定地抑制作用,即主要抑制酶促褐变来对紫甘薯浆液进行护色。柠檬酸还可降低pH,不但使氧气溶解度降低,且转变花色苷的存在形式,进一步起到增色作用。
如图2 所示,在选取的范围之内随着柠檬酸用量的增加,紫甘薯浆液L*呈上升的趋势,但△E*呈先减小、然后增大、再逐渐平缓的趋势。当柠檬酸的用量为0.6%时△E*最低为6.86,后随着柠檬酸用量的继续增加,△E*逐渐增大,当柠檬酸用量大于0.9%时,△E*趋于平稳。
造成这一现象的原因是,为在较宽范围内找出使紫甘薯浆液的色泽明亮鲜艳的柠檬酸用量,提升了每两个水平之间的差距,这就使得整体浆液的pH 值变化迅速,在柠檬酸用量为0.3%时显示了花色苷的分子形式从醌式碱向无色的查尔酮及假碱转化的效果,即浆液色泽变浅,△E*变小。在柠檬酸用量达到0.9%后,花色苷逐渐由无色的查尔酮及假碱向红色的吡喃阳离子转换,浆液△E*增加,后用量继续加大增幅放缓。结合紫甘薯浆液在后续酶解过程的最佳酶解pH 值,选择既有较好护色及增色效果,又不会使pH 值过小的0.9%为柠檬酸的较适宜用量。此用量的紫甘薯浆液L*为28.74,△E*为15.48,高于新榨的紫甘薯原汁的L*及△E*,且具有较适宜的口感。

图2 柠檬酸用量对紫甘薯浆液L* 及△E* 的影响Fig.2 Effect ofcitric acid content on the L*and △E* in purple sweet potato slurry
2.1.3 富马酸对全质紫甘薯汁的色泽变化的影响
富马酸作为酸化剂,理论上可降低浆液中的pH值,起到护色和增色的作用。取0% ~2%的富马酸进行试验,测试其护色及增色效果,结果如图3 所示。

图3 富马酸用量对紫甘薯浆液L* 及△E* 的影响Fig.3 Effect offumaric acid content on the L*and △E* in purple sweet potato slurry
由图3 可以看出,富马酸对紫甘薯几乎没有护色效果,在富马酸用量0% ~2%之间时,得到的紫甘薯浆液L*及△E*变化幅度极小。造成这一现象的原因是,在室温下,富马酸微溶于水溶液,虽然作为酸化剂,但很难对紫甘薯发挥其酸的作用。因此,从打浆后得到的紫甘薯浆液L*及△E*来看,富马酸不适用于紫甘薯的护色。
2.2 复合酸味剂对全质紫甘薯汁色泽变化的影响
由于抗坏血酸和柠檬酸作为酸化剂,都有降低紫甘薯浆液pH 值的作用,因此两者复合,酸度加倍,考虑到最终全质紫甘薯汁的酶解步骤的pH 值,选择0.6%和0.9%作为抗坏血酸用量和柠檬酸用量的第三水平进行正交试验。

表2 正交试验及结果Table 2 The results of the orthogonal experiment
表2 表明,用抗坏血酸和柠檬酸作为复合护色剂浸泡紫甘薯,对打浆并过滤后得到的紫甘薯浆液的护色及增色有一定的效果,且这种复合护色剂的效果好于抗坏血酸和柠檬酸作为单一护色剂的效果。从上表中极差Rj 值分析可以得到,两因素影响的主次顺序为:抗坏血酸用量>柠檬酸用量。然后根据结果进行下一步分析,得出试验工艺参数的最佳水平组合。
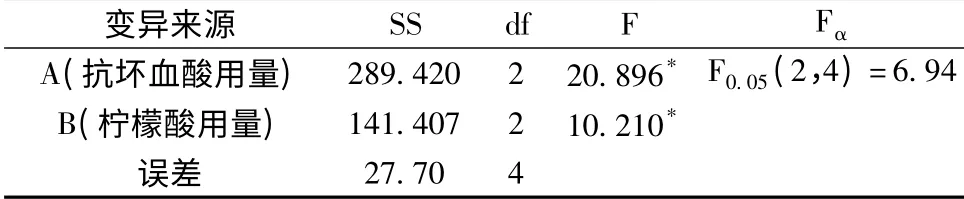
表3 方差分析表Table 3 Analysis of variance
由表3 的结果可知,A 因素(抗坏血酸用量)和B因素(柠檬酸用量)的F 值显著,说明抗坏血酸用量和柠檬酸用量对紫甘薯的护色有显著影响。

表4 多重比较用q 及LSR 值Table 4 LSR and q in multiple comparisons

表5 A 因素各水平均值多重比较Table 5 The levels mean of A factor in multiple comparisons

表6 B 因素各水平均值多重比较Table 6 The levels mean of B factor in multiple comparisons
采用q 检验法对A 因素和B 因素各水平进行多重比较,见表4 ~表6。加表4 ~表6 可由表5 看出,在显著性为0.05 水平下,A1A2A3均数间都差异显著。在显著性为0.01 水平下,A1A2A3均数间差异都不显著。多重比较结果以A2为最好,选定A2为最佳,即0.45%是抗坏血酸的最佳用量。
可由表6 看出,在显著性为0.05 水平下,B2与B3均数间差异不显著,其余均数间差异显著。在显著性为0.01 水平下,B1B2B3均数间差异都不显著。多重比较结果以B1为最好,选定B1为最佳,即0.60%是柠檬酸的最佳用量。
所以,从护色和增色效果考虑,A2B1为最佳组合水平。即0.45%的抗坏血酸和0.6%的柠檬酸混合为最佳的护色剂。以此护色剂浸泡30 min,再用4 倍的水打浆,打浆后得到的紫甘薯浆液的L*为38.87,△E*为24.47。
2.3 酶解过程对全质紫甘薯汁的色泽影响
2.3.1 酶解pH 值对全质紫甘薯汁的色泽变化的影响
从图4 可看出,随着紫甘薯浆液酶解pH 值的升高,可溶性固形物增长率有所上升,但全质紫甘薯汁的L*和△E*均呈现下降的趋势。这是由于,不同pH 值下紫甘薯花色苷的结构不同,在pH 值越小的情况下,花色苷越多的以比较稳定的吡喃阳离子形式存在,随着pH 值的增大,羟自由基与吡喃阳离子2位碳元素发生求核反应,向无色的查尔酮形式转化。当pH 值为5 时,花色苷较多处于查尔酮或醇式碱形式,较不稳定,易被加热、氧气等破坏,因而L*和△E*会随着酶解pH 值得增大而减少。
酶解pH 值对全质紫甘薯汁的影响主要体现在两个方面:一方面是酶解pH 值的大小影响紫甘薯淀粉的酶解效果,酶解pH 值升高则可溶性固形物增长率增加;另一方面是酶解pH 值的大小影响紫甘薯花色苷的存在形式和稳定性从而降低全质紫甘薯汁的L*和△E*。综合两方面,将酶解pH 值定为4 较适宜。

图4 酶解pH 值对全质紫甘薯汁可溶性固形物增长率、L* 及△E* 的影响Fig.4 Effect of enzymolysis different pH value on the soluble solids,L* and △E* in purple sweet potato juice
2.3.2 酶解温度对全质紫甘薯汁的色泽变化的影响
由图5 可知,随着酶解温度的升高,L*和△E*有所下降,可溶性固形物增长率有所上升,并在达到60℃后趋于平稳。可看出,酶解阶段对全质紫甘薯汁色泽的影响除于花色苷的自身结构和酶解pH 值有关之外还与酶解温度有关,酶解pH 值通过影响花色苷的结构而影响花色苷的稳定性,而酶解温度则是通过影响环境给花色苷传递的能量而影响花色苷的稳定性,酶解温度越高,环境为花色苷传递的能量越多,当能量达到破坏花色苷键能后花色苷就被破坏,所以酶解温度越高,花色苷越不稳定。当酶解温度超过60℃后,紫甘薯花色苷接收到足够多的能量,发生氧化反应导致共价键断裂并在此基础上引起了热降解。花色苷发生热降解,其结构就向查尔酮转变,导致有色结构吡喃阳离子减少,全质紫甘薯汁的L*和△E*下降。同时酶解温度的升高使紫甘薯花色苷性质不稳定,还因其具有一个裸露的阳离子,易受水分子攻击。温度升高会加速水分子的对流速度,促使水分子对花色苷的破坏作用。
由于酶解温度超过60 ℃后,可溶性固形物增长率变化不明显,△E*却下降迅速。综合考虑,选60℃为较适宜的酶解温度。
2.3.3 酶解时间对全质紫甘薯汁的色泽变化的影响
随着酶解时间的逐渐增加,全质紫甘薯汁的L*有所下降,△E*有所上升。这是由于,紫甘薯花色苷类化合物的不饱和性导致其对氧气敏感,可进行氧化反应改变结构,从而影响L*,使全质紫甘薯汁随着酶解时间的增加而色泽变暗。但全质紫甘薯汁中的其他成分如糖、酸、多酚类物质等与花色苷在加热时逐渐发生了分子间的辅色效应。这种辅色作用由于能够阻止从吡喃阳离子向无色的醇式碱形式的水化转换从而明显的提高花色苷的稳定性以及增强其颜色强度,使颜色加深,△E*有所上升。同时,持续的加热还会促进紫甘薯花色苷的溶出,也会使△E*有所上升。

图5 酶解温度对全质紫甘薯汁可溶性固形物增长率、L* 及△E* 的影响Fig.5 Effect of enzymolysis different temperatures on the soluble solids,L* and △E* in purple sweet potato juice

图6 酶解时间对全质紫甘薯汁可溶性固形物增长率、L* 及△E* 的影响Fig.6 Effect of enzymolysis different time on the soluble solids,L* and △E* in purple sweet potato juice
在酶解时间为90 min 时,可溶性固形物增长率和△E*均达到了较高值,而L*虽有不同程度的下降,但下降幅度较小。所以,从全质紫甘薯汁的可溶性固形物增长率、L*及△E*综合考虑,选择酶解时间为90 min 较适宜。
2.3.4 确定酶解条件
调护色后的紫甘薯浆液pH 值至4,加入0.2%α-淀粉酶以60 ℃酶解90 min,离心后取上清液测其可溶性固形物含量、L*及△E*,算出可溶性固形物增长率为56.9%,全质紫甘薯汁的L*为27.46,△E*为13.4。L*和△E*均比酶解前有所下降,总体色泽也由紫红色向紫色转变,但也由于酶解后紫薯汁更加澄清,使紫色不显灰败。
酶解过程对全质紫甘薯汁色泽的影响机理复杂,要在确定酶解pH 值,酶解温度,酶解时间的同时,在操作工艺方面尽量减少对色泽的破坏。可在保持酶解条件的基础上,迅速降低酶解后的紫甘薯汁温度,并且在酶解过程中尽量将容器装满并加盖,以减少对氧气的接触,条件允许的情况下还可在进行酶解的容器中充入氮气,以确保对氧气的隔绝。
3 结论
(1)紫甘薯的护色采用以下工艺条件:0.45%的抗坏血酸和0.6%的柠檬酸混合作为护色剂。以此护色剂浸泡30 min,再用4 倍的水对紫甘薯打浆,打浆后得到的紫甘薯浆液的L*为38.87,△E*为24.47。
(2)护色后的紫甘薯浆液调pH 值为4,以60 ℃酶解90 min,离心后得到有清透紫色色泽的全质紫甘薯汁。此时酶解效果良好,可溶性固形物增长率为56.9%,L*和△E*虽比酶解前有所下降,但由于紫甘薯汁更加澄清,所以色泽透亮,不会失去鲜艳诱人的感官品质。
(3)采用本工艺制备的全质紫甘薯汁即有明亮的紫红色色泽,又澄清无杂质,可为制备紫甘薯全质饮料提供前期技术参考。
[1] 刘功德,叶雪英,苏艳兰. 澄清型紫薯汁加工工艺的研究[J]. 大众科技,2012,14(8):110 -111.
[2] 齐希光,沈波,张晖,等. 响应面法优化紫薯花色苷提取工艺研究[J]. 粮食与饲料工业,2012,10:26 -32.
[3] 洪镭,刘亚鸥. 紫甘薯研究综述[J]. 吉林农业,2010,6:140.
[4] 刘军伟,胡志和,苏莹. 紫薯中多酚氧化酶活性的研究及褐变控制[J]. 食品科学,2012,33(17):207 -211.
[5] 方忠祥,倪元颖,李洪民. 紫肉甘薯中花青素在不同环境下稳定性的研究[J]. 食品与发酵工业,2002,28(10):31 -34.
