布洛芬抑制博莱霉素诱导的肺纤维化小鼠一氧化氮生成的机制研究
2013-09-07王春雷张烨蔡开霞王斯琪
王春雷,张烨,蔡开霞,王斯琪
(中国医科大学附属第一医院老年病科,沈阳 110001)
氧化应激反应在肺纤维化的发病中起重要作用,其中核因子 κB(nuclear factor-κB,NF-κB)作为重要的细胞因子、黏附分子及炎性介质的转录因子,参与急性肺损伤的发病[1]。研究表明,肺纤维化中可见 NF-κB 的激活[2,3]。NF-κB 在内、外源性刺激,如射线、化疗药物、活性氧等的参与下,作用于肺巨噬细胞、支气管肺泡上皮细胞等细胞后诱导性一氧化氮合成酶 (inducible nitric oxide synthase,iNOS)mRNA的表达,催化L-精氨酸产生过量一氧化氮(nitric oxide,NO)。iNOS和NO对肺纤维化的发生和发展起重要作用[4,5]。我们的前期研究证实:博莱霉素引起的肺纤维化中,NO表达明显增加,而布洛芬可抑制NO的表达,但其机制并不清楚。本研究拟探讨博莱霉素是否可引起小鼠肺组织中iNOS和NF-κB上调及布洛芬对其产生的影响。
1 材料与方法
1.1 材料
清洁级雄性C57BL/6小鼠购自中国医科大学实验动物中心;博莱霉素购自哈尔滨博莱制药有限公司;布洛芬购自烟台第二制药厂;NO试剂盒购自南京建成生物工程研究所;NF-κB p50和p65多克隆抗体购自美国Santa Cruz公司;抗iNOS抗体购自美国R&D公司。
1.2 方法
1.2.1 动物模型的建立及分组:取健康雄性C57BL/6小鼠 50只,随机分为对照组(A)、模型组(B)、布洛芬 5 mg/kg(C)、10 mg/kg(D)、20 mg/kg(E)治疗组,每组10只。10%水合氯醛(3 mL/kg)麻醉小鼠后,用1 mL注射器吸取博莱霉素溶液(生理盐水配制3 mg/kg)气管快速注射后,将小鼠垂直放置,旋转3周,使博莱霉素均匀分布于肺部,缝合伤口,让小鼠自然清醒。A组注射同容积的生理盐水。C、D、E组注射博莱霉素1 d后,每天分别腹腔注射相应剂量的布洛芬(生理盐水配制)进行治疗,连续28 d。
1.2.2 血清NO含量检测:实验结束后,处死小鼠(每组各5只),腹主动脉采血,4 000 r/min离心10 min,收集血清,用NO化学法试剂盒检测小鼠血清中NO含量。
1.2.3 肺组织NF-κB的检测:实验结束后,处死小鼠(每组各5只)。取支气管、部分肺组织冻存于-80℃备用。采用2步法免疫组织化学法检测:用3%H2O2孵育肺组织超薄切片10 min。加一抗(1︰50兔抗NF-κB p65亚单位的抗体和1︰50兔抗NF-κB p50亚单位的抗体),室温孵育2 h,PBS冲洗,滴加试剂1,室温孵育20 min;PBS液冲洗,滴加二抗,室温孵育20 min。以细胞核染成棕褐色者为阳性细胞。每张病理切片随机选取10个高倍视野,计数其中阳性细胞数,计算阳性细胞占细胞总数的百分比。
1.2.4 Western blot法检测各组肺组织中iNOS蛋白表达水平:取各组小鼠肺组织,RIPA裂解液裂解组织,BCA法进行蛋白质浓度测定,取20 μg等量蛋白质进行聚丙烯酰胺凝胶电泳(12%SDS-PAGE),转至PVDF膜,用5%蛋白液洗膜3次。用脱脂奶粉封闭1 h,分别加入兔抗鼠单克隆抗体anti-iNOS(1︰800)和 β-actin(1︰1 500),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1︰2 000)。ECL显色,凝胶成像分析系统进行扫描。
1.3 统计学分析
2 结果
2.1 各组小鼠血清NO含量的比较
与对照组[(1.646±0.44)μmol/g]比较,模型组小鼠血清 NO 含量[(5.500±0.87)μmol/g]显著增加(P<0.01)。布洛芬5 mg/kg治疗组血清NO含量[(4.064±0.64)μmol/g]无明显变化,而布洛芬 10 mg/kg治疗组[(2.174±0.51)μmol/g]、20 mg/kg治疗组[(1.927±0.35)μmol/g]血清 NO 含量明显降低(P<0.05,P<0.01),提示布洛芬可缓解肺纤维化所引起的NO增高。而且布洛芬20 mg/kg治疗组的血清NO明显低于5 mg/kg和10 mg/kg治疗组,说明血清NO含量与布洛芬剂量有一定关系。相关分析显示NO下降水平与布洛芬剂量呈负相关(y=-1.260 9x+6.568 5,R2=0.932 7),具有统计学意义。
2.2 各组肺组织NF-κB含量的比较
如表1所示:与对照组比较,模型组肺组织NF-κB含量显著增加(P<0.01)。布洛芬5 mg/kg治疗组肺组织NF-κB含量无明显变化,而布洛芬10 mg/kg和20 mg/kg治疗组肺组织NF-κB含量明显降低(P<0.05,P<0.01),而且布洛芬20 mg/kg和10 mg/kg治疗组的NF-κB明显低于布洛芬5 mg/kg治疗组。说明布洛芬抑制肺纤维化引起的NO增高与下调NF-κB 有关。

表1 各组肺组织NF-κB的比较(%)Tab.1 Comparison of NF-κB expression in the lung tissues from different groups(%)
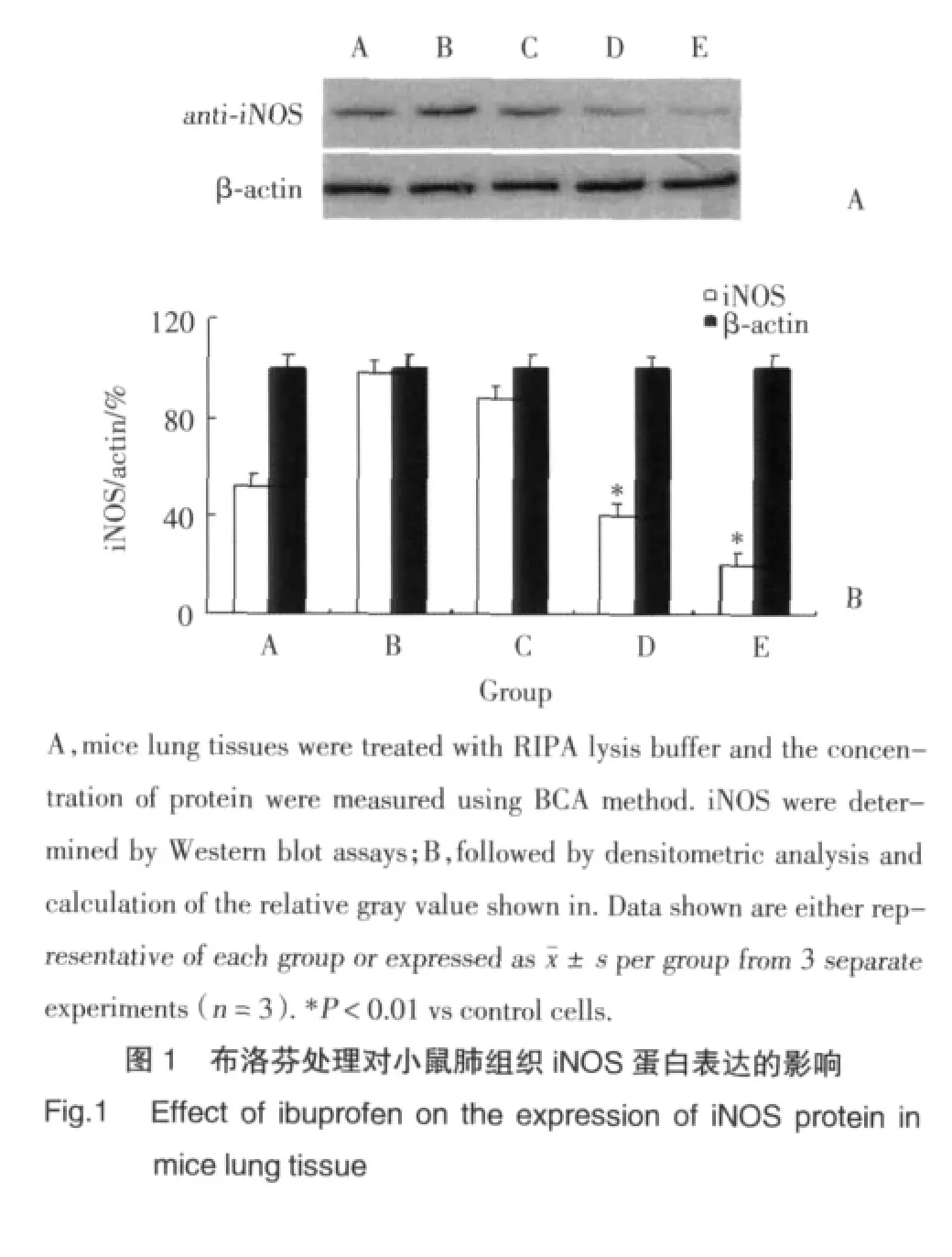
2.3 肺组织中iNOS蛋白表达水平
Western blot结果(图1)显示:与正常对照组比较,模型组肺组织iNOS表达明显增加(P<0.01),布洛芬5mg/kg治疗组无明显变化,而布洛芬10mg/kg、20 mg/kg治疗组则明显降低(P<0.05,P<0.01),且布洛芬20 mg/kg、10 mg/kg治疗组iNOS明显低于布洛芬5 mg/kg治疗组。
3 讨论
NO作为一种生物信使分子和细胞毒性效应分子,参与细胞内信号传导,具有舒张动脉、降低血小板黏滞性和抗炎作用,但过量NO及其代谢产物则可导致机体损伤。研究表明,肺内NO的大量生成可能是促使肺纤维化形成的因素之一[4],但其机制尚不清楚。本研究结果表明:博莱霉素诱导肺纤维化NF-κB表达上调,上调的NF-κB可能通过促进iNOS的转录和翻译增加其蛋白的表达,从而促进NO的生成,而布洛芬则可明显抑制上述反应,起到抑制纤维化的作用。
博莱霉素引起的鼠肺纤维化是公认的肺纤维化模型。目前认为,NO在肺间质纤维化的发生发展,特别是肺泡炎阶段起重要作用[6,7]。其可能的机制为:(1)肺纤维化时产生的NO可扩张微血管,增加毛细血管后微静脉的渗出,加重炎症和组织水肿;(2)通过影响线粒体呼吸链复合物引起细胞毒作用[8];(3)可能引起肺泡上皮细胞、肺泡巨噬细胞和肺成纤维细胞的增殖和调亡,参与肺纤维化的形成[9,10]。布洛芬可抑制NO的大量产生,抑制肺纤维化的发生和发展。本研究结果发现布洛芬可通过抑制NF-κB的表达从而下调iNOS的表达水平,从而降低NO水平。本研究结果为临床治疗肺纤维化提供了一种新的治疗途径。
[1]An J,Chang L,Yulong S,et al.NF-κB induced the donor liver cold preservation related acute lung injury in rat liver transplantation model[J].PLoS ONE,2011,6(9):4960.
[2]Henno P,Maurey C,Danel C,et al.Pulmonary vascular dysfunction in end-stage cystic fibrosis:role of NF-κB and endothelin-1[J].Eur Respir J,2009,34(6):1329-1337.
[3]林箐,倪莲芳,任雅丽,等.PPARγ和NF-κB在肺纤维化中的表达与意义[J].北京大学学报(医学版),2009,41(5):545-547.
[4]Hofer M,Mueller L,Rechsteiner T,et al.Extended nitric oxide measurements in exhaled air of cystic fibrosis and healthy adults[J].Lung,2009,187(1):307-313.
[5]Naura AS,Zerfaoui M,Kim H,et al.Requirement for inducible nitric oxide synthase in chronic allergen exposure-induced pulmonary fibrosis but not inflammation [J].J Immunol,2010,185 (5):3076-3085.
[6]孙玉敏,宋福成,陈晓玲.一氧化氮与肺纤维化的研究进展[J].现代生物医学进展,2006,6(9):105-118.
[7]李伟峰,胡玉洁,袁伟锋,等 气管内滴入与雾化博莱霉素致小鼠肺纤维化模型的比较研究[J]南方医科大学学报,2012,32(2):221-224.
[8]陈颖,代华平,王辰,等,特发性肺纤维化患者蛋白C系统的研究[J].首都医科大学学报,2006,27(1):59-62.
[9]Nozaki Y,Hasegawa Y,Takeuchi A,et al.Nitric oxide as an inflammatory mediator of radiation pneumonitis in rats[J].Am J Physiol,1997,16(3):1651-1658.
[10]Barcas-Filho JV,Ferreira MA,Sesso A,et al.Evidence of type pneumocyte apoptosis in the pathogenesis of idiopathic pulmonary fibrosis/usual interstitial pneumonia [J].J Clin Pathol,2004,54(2):132-138.
