LKB1在子宫内膜样腺癌中的表达及意义
2013-09-07李爱琳柏兴华邓博雅姜彦多李光
李爱琳,柏兴华,邓博雅,姜彦多,李光
(1.中国医科大学附属第一医院放疗科,沈阳 110001;2.中国医科大学附属第一医院妇科,沈阳 110001;3.中国人民解放军第二零二医院病理科,沈阳 110003)
LKB1(liver kinase B1,又称 STK11)基因编码丝氨酸/苏氨酸蛋白激酶,通过磷酸腺苷激活的蛋白激酶(AMP-activated proteinkinase,AMPK)途径,下调哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR)活性,从而抑制细胞生长增殖、诱导细胞凋亡及抑制血管新生,是目前公认的抑癌基因[1~4]。在肺癌、宫颈癌等多种肿瘤中存在该基因的体细胞突变,其突变导致LKB1失活或下调,AMPK蛋白质不能正常激活,不再继续向mTOR发出抑制信号,导致细胞在能量不足的情况下仍保持生长态势,从而促进肿瘤发生发展[1,5,6]。Contreras 等[7,8]报道:在鼠模型中LKB1基因突变导致的LKB1表达下调引起高侵袭性子宫内膜样腺癌的发生,而且LKB1表达缺失的子宫内膜样腺癌对mTOR抑制剂雷帕霉素高度敏感[9]。目前,LKB1蛋白在人类子宫内膜样腺癌组织的表达情况及其对子宫内膜样腺癌发生的影响及与临床病理因素之间的关系尚不清楚。本研究拟应用免疫组织化学方法检测LKB1在子宫内膜样腺癌及子宫内膜单纯增生组织中的表达情况,并分析其与子宫内膜样腺癌临床病理特征及肿瘤微血管密度(microvessel density,MVD)的关系。
1 材料与方法
1.1 一般资料
50例子宫内膜样腺癌组织来自中国医科大学附属第一医院及中国人民解放军第二零二医院2006年1月至2010年1月进行手术治疗并经病理组织学检查确诊的手术标本。参照国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)2009年分期标准:Ⅰ期26例,Ⅱ期11例,Ⅲ期 13例;其中高分化(G1)15例,中分化(G2)19例,低分化(G3)16例。所有标本均为原发性肿瘤,术前未接受放化疗或激素治疗。患者年龄31~66岁,平均54.98岁。同时选取在中国人民解放军第二零二医院经手术切除的病理诊断为子宫内膜单纯性增生的30例子宫内膜组织进行对照研究。
1.2 主要试剂
浓缩型兔抗人多克隆抗体LKB1(1︰200;Abcam公司,美国);即用型鼠抗人单克隆抗体CD34(福州迈新生物技术开发公司);SP试剂盒(福州迈新生物技术开发公司);DAB显色试剂盒(福州迈新生物技术开发公司)。
1.3 免疫组织化学染色
组织蜡块行4 μm厚连续切片,石蜡切片常规脱蜡。采用链霉素抗生素蛋白—过氧化物酶(SP)法检测LKB1蛋白表达,以PBS代替一抗作为阴性对照。按照说明书进行操作。采用双盲阅片法进行结果判定:细胞质染成浅黄色、黄色或棕黄色者为阳性细胞。在10个高倍视野下(×400)确定细胞染色强度及阳性率百分比。染色强度评分:0分:无色;1分:浅黄色;2分:黄色;3分:棕黄色。阳性细胞数评分:0分:0%,1分:1%~25%,2分:26%~50%,3分:51%~75%,4分>75%。2项合计乘积为标本的分值,划分为2组:阴性:0~3分;阳性:≥4分。MVD计数:在低倍镜下挑选标本中肿瘤血管密集区,在高倍镜视野下(×400)随机选择4个视野,计数CD34阳性的血管数,计数后以±s表示。在比较LKB1表达与子宫内膜样腺癌MVD的联系时,根据MVD值将肿瘤分为<20、20~40、>40 组。
1.4 统计学分析
采用SPSS 16.0软件进行数据分析,应用χ2检验分析肿瘤组及对照组LKB1表达差异,应用χ2检验及Spearman非参数相关分析评价子宫内膜样腺癌组织中LKB1表达与患者临床病理参数和MVD的相关性,P<0.05为差异有统计学意义。
2 结果
2.1 LKB1在子宫内膜样腺癌、子宫内膜单纯性增生组织中的表达及定位
LKB1蛋白在子宫内膜样腺癌、子宫内膜单纯性增生组织中均有表达,其阳性染色呈棕黄色颗粒弥漫性分布于细胞质(图1)。子宫内膜样腺癌组织中LKB1表达阳性率[42%(21/50)]明显低于子宫内膜单纯性增生组织[66.7%(20/30)],差异有统计学意义(P=0.033)。
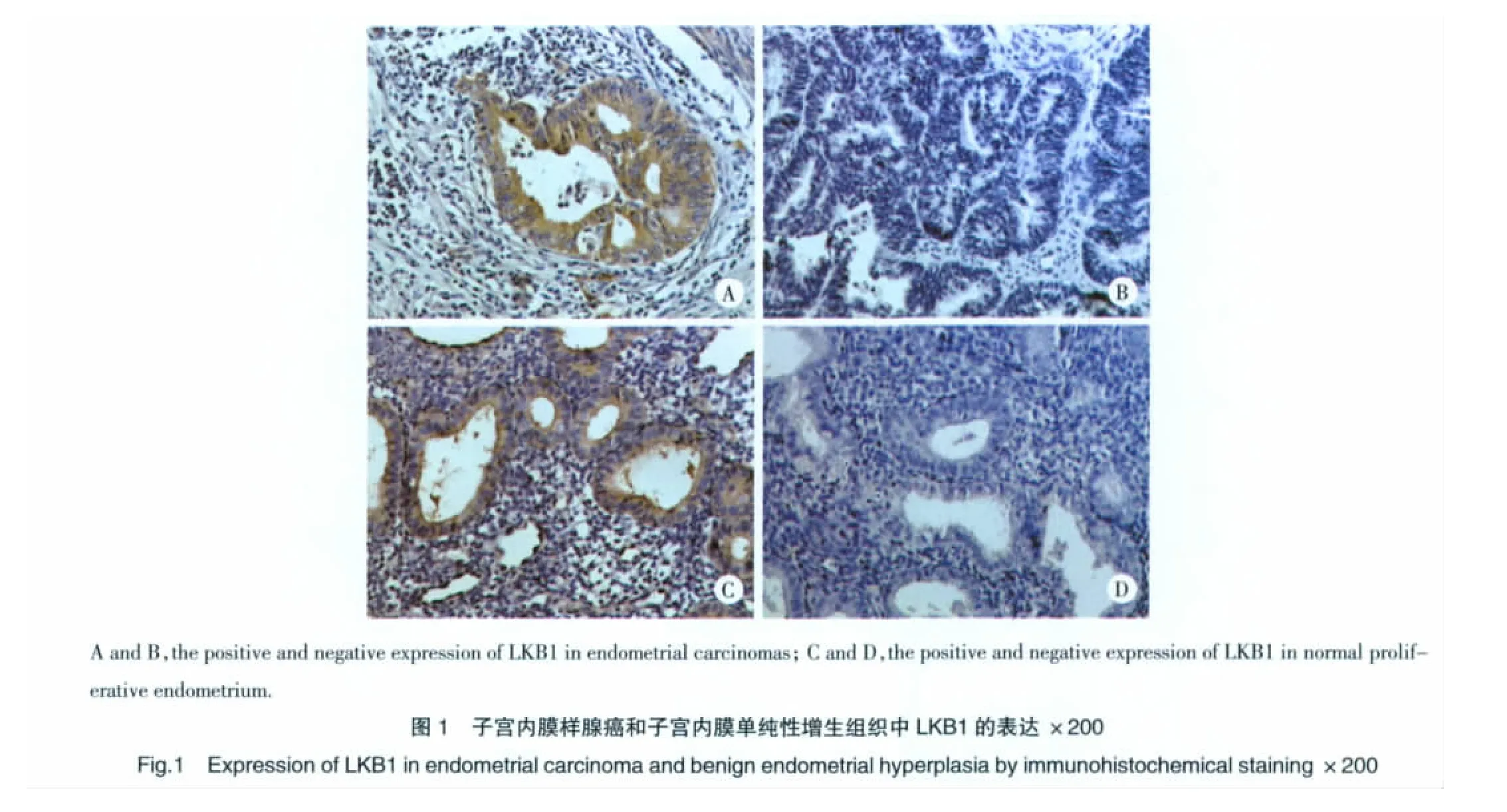
2.2 LKB1的表达与子宫内膜样腺癌临床病理特征及MVD的相关性
LKB1的表达与子宫内膜样腺癌的病理分级、肌层浸润相关,而与年龄、淋巴结转移和FIGO分期无关(P>0.05)。在病理分级G3的患者中LKB1的表达阳性率低于G1+G2的患者(18.8%vs 52.9%,P=0.022);在肌层浸润≥1/2的患者中LKB1的表达阳性率低于肌层浸润<1/2的患者(30.0%vs 45.0%,P=0.035)。此外,LKB1的表达与子宫内膜样腺癌的MVD呈负相关,MVD值高的子宫内膜样腺癌组织里LKB1表达下调(r=-0.374,P=0.030)。见表1及图2。


表1 LKB1表达与肿瘤病理参数及MVD的关系Tab.1 Relationship between expression of LKB1 and clinicopathological parameters,MVD in endometrial cancer patients
3 讨论
子宫内膜癌是发生于子宫内膜的上皮性恶性肿瘤,以来源于子宫内膜腺体的腺癌最常见,其致癌机制与癌基因、抑癌基因和DNA损伤修复基因的异常表达有关[10]。本研究结果表明:LKB1蛋白在子宫内膜样腺癌组织中的表达低于单纯子宫内膜增生组织中,差异有统计学意义(P=0.033)。Contreras等[7]发现在子宫内膜上皮LKB1突变的小鼠模型中,有53%(8/15)雌鼠在55周龄时发生子宫内膜样腺癌,认为LKB1表达下调可导致雌鼠子宫内膜样腺癌发病率升高,提示LKB1蛋白可能抑制子宫内膜样腺癌发生,并推测其在人类子宫内膜样腺癌中也存在同样作用。此外,在乳腺癌及肺癌等其他肿瘤中,也观察到肿瘤组织中LKB1蛋白的表达明显降低[11,12]。以上结果均与本研究结果一致。
本研究结果显示:LKB1的表达下调与子宫内膜样腺癌低分化相关。Ji等[12]在肺癌中也证实LKB1表达缺失导致肺鳞癌的分化降低。但Contreras等[7]在LKB1表达下调的雌鼠中观察到高分化子宫内膜样腺癌的发生,也有LKB1表达与肿瘤分化无关的报道。这些结果的不一致可能与不同物种、疾病和样本量有关,其机制还有待进一步探讨。本研究结果显示:LKB1的表达下调与子宫内膜样腺癌的肌层浸润深度呈正相关,这与Contreras等[7]报道的LKB1表达下调促进子宫内膜样腺癌高侵袭性的结果一致,也与LKB1在肺癌和乳腺癌中的角色相符[11,12]。但本研究中并未发现LKB1表达与淋巴结转移及FIGO分期的关系。
Zhuang等[11]报道在人类乳腺癌中LKB1蛋白过表达可以降低MVD,推测LKB1可能通过抑制VEGF表达从而抑制血管新生。本研究发现在子宫内膜样腺癌中LKB1的表达上调与肿瘤组织MVD呈负相关,推测LKB1可能抑制子宫内膜样腺癌血管生成过程,但此机制有待进一步研究证明。
综上所述,LKB1蛋白表达下调与子宫内膜样腺癌的发生发展密切相关,LKB1蛋白表达的检测有可能成为子宫内膜样腺癌早期诊断的分子标志,同时也可能用于子宫内膜样腺癌侵袭能力的预测。尽管对LKB1抑癌基因在子宫内膜样腺癌发生、侵袭和血管生成中的作用有了初步认识,但其详细的作用机制仍未完全明确,它在判断分期、转移和预后中的价值也有待于进一步研究。
[1]Shackelford DB,Shaw RJ.The LKB1-AMPK pathway:metabolism and growth control in tumour suppression[J].Nat Rev Cancer,2009,9(8):563-575.
[2]Meric-Bernstam F,Gonzalez-Angulo AM.Targeting the mTOR signaling network for cancer therapy [J].J Clin Oncol,2009,27(13):2278-2287.
[3]赵晓,李玉霞,凌焱,等.20例中国Peutz-Jeghers综合征患者STK11基因编码区突变分析 [J].南方医科大学学报,2012,32(4):511-514.
[4]胡新华,杨军,张志深,等.反义mTOR基因局部转染对移植静脉内膜增生的影响[J].中国医科大学学报,2007,36(2):163-165.
[5]Ylikorkala A,Rossi DJ,Korsisaari N,et al.Vascular abnormalities and deregulation of VEGF in Lkb1-deficient mice [J].Science,2001,293(5533):1323-1326.
[6]Katajisto P,Vaahtomeri K,Ekman N,et al.LKB1 signaling in mesenchymal cells required for suppression of gastrointestinal polyposis[J].Nat Genet,2008,40(4):455-459.
[7]Contreras CM,Gurumurthy S,Haynie JM,et al.Loss of Lkb1 provokes highly invasive endometrial adenocarcinomas [J].Cancer Res,2008,68(3):759-766.
[8]Contreras CM,Akbay EA,Gallardo TD,et al.Lkb1 inactivation is sufficient to drive endometrial cancers that are aggressive yet highly responsive to mTOR inhibitor monotherapy [J].Dis Model Mech,2010,3(3-4):181-193.
[9]Lu KW,Wu W,Dave B,et al.Loss of tuberous sclerosis complex-2 function and activation of mammalian target of rapamycin signaling in endometrial carcinoma[J].Clin Cancer Res,2008,14(9):2543-2550.
[10]崔开宇,孔宪超.肿瘤干细胞在子宫内膜癌的诊断与治疗中的研究进展[J].首都医科大学学报,2012,33(2):280-283.
[11]Zhuang ZG,Di GH,Shen ZZ,et al.Enhanced expression of LKB1 in breast cancer cells attenuates angiogenesis,invasion,and metastatic potential[J].Mol Cancer Res,2006,4(11):843-849.
[12]Ji H,Ramsey MR,Hayes DN,et al.LKB1 modulates lung cancer differentiation and metastasis[J].Nature,2007,448(7155):807-810.
