猪圆环病毒2型Rep'蛋白单克隆抗体制备及其抗原表位鉴定
2013-08-30刘建波吴洪丽王一平危艳武唐青海李胜斌刘长明
刘 丹,刘建波,吴洪丽,王一平,危艳武,唐青海,李胜斌,魏 萍,刘长明*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨 150001;2.东北农业大学动物医学学院,黑龙江哈尔滨 1500301)
猪圆环病毒(Porcine circovirses,PCVs)分为PCV1和PCV2两种血清型,并在猪群中广泛流行,但PCV1不引起临床症状,而PCV2被证明是断奶仔猪多系统衰竭综合征(PMWS)的主要病原[1]。PCV2还与猪皮炎与肾炎综合征(PDNS)、母猪繁殖障碍及增生性坏死性肺炎(PNP)、呼吸道疾病综合征(PRDC)、肉芽肿性肠炎和间质性肺炎等疾病有关[2-4],统称为猪圆环病毒病(PCVD)[1]。PCV2能够破坏猪体免疫系统,造成免疫抑制,诱发多种病原混合感染或继发感染,导致难以控制的严重疾病[1]。
PCVs基因组由单股负链闭合环状DNA构成,其中 PCV1含 1 759 nt, PCV2含 1 766 nt~1 768 nt,由2个大的反义开放阅读框架(ORF1和ORF2),其中ORF1编码Rep蛋白参与病毒的复制,是病毒的非结构蛋白;ORF2编码的Cap蛋白是病毒的主要结构蛋白[5]。PCV1与PCV2之间具有低水平的抗原交叉反应,主要与Rep蛋白同源性高有关[5-6]。PCV2-Rep基因为945 nt,编码314个氨基酸(aa),分子量为36 ku,预测有3个潜在糖基化位点。在病毒复制中PCV2-ORF1转录本mRNA第417 nt~799 nt处发生剪接,产生截短的Rep'蛋白,由178个aa组成,分子量为20.4 ku。剪接过程中Rep'蛋白C-末端阅读框移位,导致了Rep'与Rep蛋白第140位后C末端氨基酸序列完全不同[7]。研究表明,Rep和Rep'的结合位点位于ORF1与ORF2间茎-环结构区,两者为病毒复制必须的[5]。有关PCV2-Rep'抗原表位的研究还未见报道[8]。本研究利用杆状病毒表达的PCV2-rRep'蛋白免疫鼠制备MAb,并利用MAb对PCV2-Rep'抗原表位进行鉴定,为进一步开展该病毒分子生物学及诊断技术的研究奠定基础。
1 材料和方法
1.1 主要试剂、细胞及动物 弗氏佐剂、HAT、HT混合盐及兔抗鼠酶标IgG(HRP-IgG)均购自Sigma公司;ABTS购自BBI公司;预染蛋白Marker购自Fermentas公司;Mouse MonoAb-ID Kit(HRP)和Ni-NTA亲和层析试剂盒购自Invitrogen公司。6~8周龄雌性BALB/c鼠由本所实验动物中心提供。
1.2 重组蛋白的表达与纯化 重组杆状病毒表达PCV2-rRep'和PCV2-rRep蛋白的毒株构建及鉴定见文献[9],按照Ni-NTA亲和层析试剂盒操作说明书方法纯化重组蛋白。以SDS-PAGE进行蛋白电泳分析,紫外法凝胶扫描确定蛋白纯度。
1.3 动物免疫与细胞融合 将纯化的重组PCV2-rRep'蛋白与弗氏佐剂乳化制备免疫原,免疫小鼠程序按文献[10]。将重组杆状病毒表达纯化的PCV2-rRep'蛋白作为检测抗原,以间接ELISA法用于MAb阳性杂交瘤细胞株筛选,操作程序参考文献[10],P/N≥2.1判为阳性,免疫鼠血清抗体效价达1∶10 000以上用于细胞融合。细胞融合参考文献[10],以50%的聚乙二醇(PEG 1450)溶液对骨髓瘤细胞(SP2/0)与免疫鼠脾细胞按1∶5比例进行细胞融合。采用间接ELISA进行检测筛选呈阳性反应杂交瘤细胞株进行3次克隆纯化。
1.4 MAb亚类鉴定 按照Mouse MonoAb-ID Kit(HRP)试剂盒对MAb亚类进行鉴定,操作按说明书方法进行;腹水制备参考文献[10]的方法。
1.5 MAb免疫活性鉴定 用重组杆状病毒表达的PCV2-rRep'和PCV2-rRep蛋白,以野生型杆状病毒表达产物和健康Sf-21细胞作为阴性对照组,对制备的MAb进行western blot鉴定,操作程序参考文献[10]。
1.6 MAb抗原交叉反应鉴定 按文献[11]方法制备IPMA反应板,设PCV1与PCV2接种孔及未接种病毒对照孔,用MAb细胞培养上清进行PCV1和PCV2抗原交叉试验,光学显微镜观察判定。
1.7 肽扫描法抗原识别表位初步定位 根据GenBank中PCV2基因(HM 038034)序列,采用DNASTAR(Ver.7.2.1)软件对PCV2-LG株编码的Rep'蛋白基因(537 nt)推导出氨基酸序列,设计合成覆盖了该蛋白全部aa序列,以相互重叠6个aa的9个短肽,每段长度均为25 aa(表1)。短肽合成由上海吉尔生化有限公司完成。以合成肽作为包被抗原进行间接ELISA测定,包被浓度为20μg/mL,同设SP2/0上清作为阴性对照。
1.8 肽扫描法抗原识别表位精确定位 为更精确的确定抗原表位,将Rep'A-4片段对应的氨基酸序列从N端和C端的两侧以2个aa残基为单位顺移直到C末端与N末端肽段重合为止,共合成9条短肽,每段长度均为15 aa(表2)。将合成肽作为包被抗原进行间接ELISA测定,包被浓度为20μg/mL,同设SP2/0上清为对照。

表1 根据PCV2-Rep'蛋白编码氨基酸序列设计的合成多肽序列Table 1 Design of the synthesized peptide sequence overlapping PCV2-Rep'coding region

表2 覆盖Rep'-4段区合成肽序列设计Table 2 Design of the synthesized peptide sequence overlapping the Rep'-4 region
2 结 果
2.1 MAb制备及筛选 以纯化的PCV2-rRep'蛋白免疫小鼠脾脏细胞与SP2/0骨髓瘤细胞融合,经间接ELISA检测杂交瘤细胞培养上清,筛选到一株能够分泌抗PCV2-Rep'蛋白的MAb阳性杂交瘤细胞株,命名为3D1株。该细胞株经3次克隆纯化,并连续传10代,经冻存与复苏,表明分泌MAb能力稳定。
2.2 MAb亚类与效价测定 对MAb亚类鉴定结果表明,3D1株 MAb属于 IgG1,轻链为 κ;间接ELISA测定培养上清抗体效价为1∶1 600,腹水效价为 1∶819 200。
2.3 MAb免疫活性鉴定 以3D1 MAb与重组杆状病毒表达的PCV2-rRep'和PCV2-rRep蛋白进行western blot,试验结果显示,这株MAb与rRep'和rRep重组蛋白在20.4 ku和36.0 ku处出现特异性反应条带(图1),表明该株MAb具有良好的特异性和反应原性。
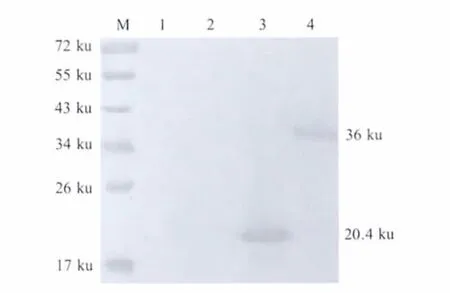
图1 3D1 MAb的western blot免疫活性鉴定Fig.1 Identification of 3D1 MAb against PCV2-rRep protein by western blot
2.4 MAb特异性鉴定 用MAb对PCV2感染细胞中 Rep'蛋白抗原进行了IPMA检测(图2)。MAb与PCV2感染阳性细胞反应呈棕红色(2A),与PCV2阳性血清反应情况相似(2B),健康对照细胞无着色反应(2C)。结果表明,该单抗能够与PCV2感染细胞中Rep'蛋白抗原产生特异性反应。同设另一组试验是用该MAb与PCV1-G株感染细胞检测结果为阴性,证明3D1株MAb仅与PCV2发生特异性反应,而与PCV1无交叉反应,结果未显示。
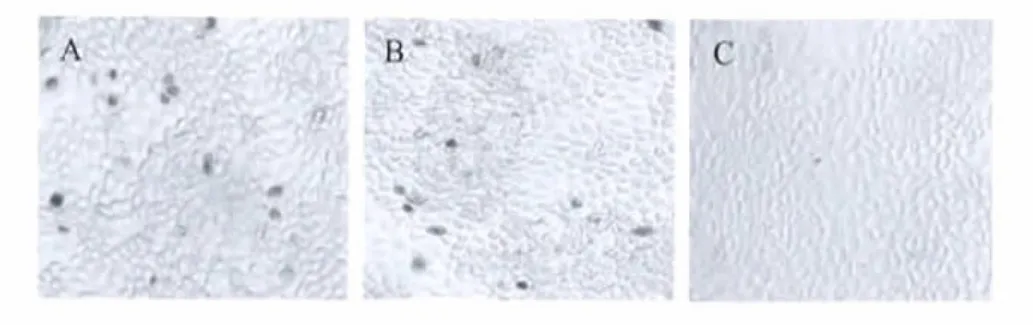
图2 用MAb对PCV2感染细胞中Rep'抗原的IPMA鉴定Fig.2 Identification of the Rep'antigen in in PCV2-infected cells by IPMA using MAb
2.5 抗原识别表位的初步定位 为了确定该MAb针对的PCV2-Rep'蛋白抗原表位,以MAb培养上清与合成的9段多肽进行ELISA检测结果如图3所示,这株单抗仅与Rep'A-4肽段抗原产生阳性反应,与其它肽段呈阴性,表明MAb对应的抗原表位位于Rep'A-4片段。
2.6 抗原识别表位的精确定位 根据Rep'A-4片段25个aa序列,再设计合成9条短肽,即Rep'A-4-1~9,各肽段间相差2个aa,以此合成肽作为包被抗原进行ELISA检测结果如图4所示。这株MAb可与Rep'A-4-1、Rep'A-4-8、Rep'A-4-9肽段产生阳性反应,与其他肽段呈阴性,表明该MAb的抗原识别表位由13个aa组成,确定核心序列为61FAN-

图3 用3D1株MAb对PCV2-Rep'抗原识别表位的初步定位Fig.3 Mapping of PCV2-Rep'recognition epitope w ith 25 peptide by ELISA
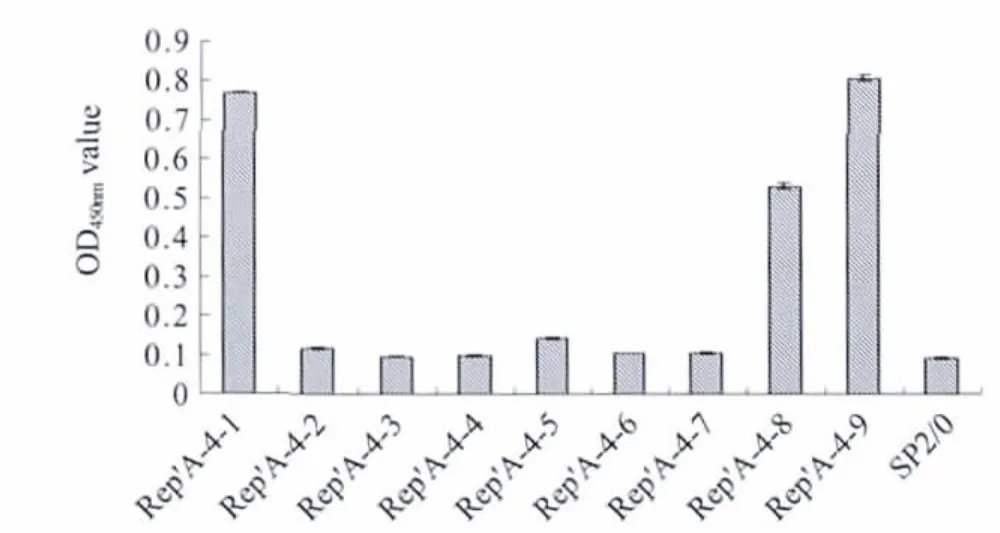
图4 3D1Mab对PCV2-Rep'抗原识别表位的精确定位Fig.4 Finemapping of PCV2-Rep'antigen recognition epitopes
3 讨论
随着PCV2灭活疫苗的广泛应用,使该病流行得到有效控制,但由此也产生了疫苗免疫与自然野毒感染间鉴别诊断的问题。因此,建立一种检测抗PCV2非结构Rep'和Rep蛋白抗体方法,与本实验室建立检测PCV2-Cap蛋白抗体的方法相结合[12],可以用于PCV2灭活疫苗及Cap亚单位疫苗免疫与自然野毒感染动物之间的血清学鉴别诊断。
利用杆状病毒表达的PCV2-Rep'蛋白作为免疫原制备MAb,具有抗原制备较全病毒容易,且纯度高,免疫原性好等优势[10]。在MAb筛选中使用了野生型杆状病毒表达产物和正常昆虫细胞作为对照进行平行检测,排除了非特异性。通过western-blot显示,制备的MAb不仅可以识别重组杆状病毒表达的剪切Rep'蛋白,也可与重组杆状病毒表达的全长Rep蛋白产生良好的免疫反应。抗原表位鉴定结果表明,其对应的核心序列为61FANFVKKQTFNKV73,该区域与Rep蛋白N端编码区相同,属于Rep'和Rep蛋白共有的同一线性抗原表位。Tao等利用MAb鉴定出PCV2-Rep蛋白2个线性抗原表位aa 39~aa 46和aa 99~aa 106[13],与本研究鉴定的抗原表位不同,该表位属于为首次鉴定。由于PCV1与PCV2在ORF1编码序列同源性高达83%,存在一定抗原交叉反应[5]。本实验以PCV1-G株、NMB株、Jiang su株、Tianjin株编码的PCV1-Rep蛋白的序列(58FANFAKKQTFNKV70)对比显示,与本研究鉴定的表位核心区仅差一个氨基酸残基(PCV2∶65V/PCV1∶62A)。3D1 MAb仅与PCV2发生反应,而与PCV1无交叉反应,表明该单抗适用于PCV2-Cap亚单位疫苗免疫与自然野毒感染动物间鉴别诊断的目的。
对该病毒复制机理表明,Rep'和Rep是病毒复制所必须的,它们共同参与了启动复制[14-15]。鉴于Rep'和Rep蛋白在转录剪切过程中C末端发生阅读框移位,导致了二者抗原性与作用机理可能存在很大不同。因此,该MAb为今后深入开展病毒复制机理研究提供了条件。
[1]Chae C.A review of porcine circoviruses 2-associated syndromes and diseases[J].Vet J,2005,169(3):326-336.
[2]Bolin S R,Stoffregen W C,Nayar G P,et al.Postweaning multisystem ic wasting syndrome induced after experimental inoculation of cesarean-derived,colostrum deprived piglets with type 2 porcine circovirus[J].JVet Diagn Invest,2001,13:185-194.
[3]A llan G M,M cNeilly F,Ellis J,et al.PMWS:experimental model and co-infections[J].Vet Microbiol,2004,98(2):165-168.
[4]Joaquiim S.Porcine circovirus type 2(PCV2)infections:Clinical signs,pathology and laboratory diagnosis[J].Virus Res,2012,164:10-19.
[5]Mankertz A,Caliskan R,Hattermann K,et al.Molecular biology of porcine circovirus:analyses of gene expression and viral replication[J].Vet Microbiol,2004,98:81-88.
[6]Mankertz A,Mankertz J,Wolf K,et al.Identification of a protein essential for replication of orcine circovirus[J].JGen Virol,1998,79(2):381-384.
[7]Cheung A K.Transcriptional analysis of porcine circovirus Type 2[J].Virology,2003,305(1):168-180.
[8]Shao-Bin Shang,Yu-Lan Jin,Xue-tao Jiang,et al.Finemapping of antigenic epitopes on capsid proteins of porcine circovirus,and antigenic phenotype of porcine circovirus type 2[J].Mol Immunol,2009,46:327-334.
[9]刘丹,吴洪丽,危艳武,等.猪圆环病毒2型Rep和Rep'蛋白免疫原性及其抗体中和活性的测定[J].中国兽医科学,2013,待发表.
[10]黄立平,刘长明,危艳武,等.抗猪圆环病毒 2型Cap蛋白中和性单克隆抗体的制备及鉴定[J].中国预防兽医学报,2009,2(2):132-136.
[11]刘长明,张超范,危颜武,等.猪圆环病毒2型免疫过氧化物酶单层细胞试验抗体检测试剂盒的研制及应用[J].中国预防兽医学报,2007,29(8):621-624.
[12]张朝霞,刘长明,危艳武,等.猪圆环病毒2型ELISA抗体检测试剂盒的研制及应用[J].中国预防兽医学报,2008,30(7):548-551.
[13]Tao Meng,Qiang Jia,Sen Liu,et al.Characterization and epitope mapping of monoclonal antibodies recognizing N-terminus of Rep of porcine circovirus type 2[J].JVirol Methods,2010,165:222-229.
[14]Cheung A K.The essential and nonessential transcription units for viral protein synthesis and DNA replication of porcine circovirus type 2[J].Virology,2003,313:452-459.
[15]Steinfeldt T,Finsterbusch T,Mankertz A.Demonstration of nicking/joining activity at the origin of DNA replication associated with the rep and rep'proteins of porcine circovirus type 1[J].JVirol,2006,80:6225-6234.
