昆虫杆状病毒基因组学研究进展
2018-09-28梁振普刘雅静张小霞李鹏娟张俊庆
梁振普,刘雅静,张小霞,李鹏娟,王 亮,张俊庆
(河南农业大学 生命科学学院,河南 郑州 450002)
杆状病毒属于杆状病毒科(Baculoviridae),是一类寄生于节肢动物(Arthropoda)的专一性病原微生物,其宿主主要是鳞翅目(Lepidoptera)、膜翅目(Hymenoptera)和双翅目(Diptera)的昆虫。已经完成测序的基因组大小为80~180 kb不等,编码89~181个开放阅读框(ORF)[1],被包裹在长度为230~385 nm、直径为40~60 nm的杆状核衣壳中[2-3]。目前已从800多种昆虫中分离鉴定出600多种杆状病毒[4]。杆状病毒在其复杂的复制周期中产生2种不同类型的病毒粒子:出芽型病毒(Budded virus,BV)和包涵体型病毒(Occlusion-derived virus,ODV)[5]。2种病毒粒子在病毒感染过程中的作用存在明显差异,BV是杆状病毒在昆虫体内传播或在培养细胞中传播所必需的,而ODV在杆状病毒经口感染宿主过程中发挥重要作用[6]。杆状病毒可根据包涵体的形态特征分为2类:多角体病毒(Nucleopolyhedrovirus,NPV)和颗粒体病毒(Granulovirus,GV)[7]。NPV和GV形态存在明显差异,NPV包涵体包埋多个病毒粒子,呈不规则多角体形状,而 GV仅仅包埋1个病毒粒子,呈圆形或卵圆形。其中,NPV根据病毒粒子囊膜内核衣壳的数目又划分为单粒包埋型核型多角体病毒(SNPV)和多粒包埋型核型多角体病毒(MNPV)。感染鳞翅目昆虫的NPV又根据BV中是否含有GP64蛋白分为2类:Group Ⅰ和Group Ⅱ[8]。Group Ⅰ的NPV利用GP64作为BV的融合蛋白, 而Group Ⅱ的NPV由于缺少gp64基因,由F蛋白代替作为BV的融合蛋白。2006年Jehle等[9]基于基因组特征将杆状病毒分为4个属:α杆状病毒属(Alphabaculovirus,感染鳞翅目昆虫的NPV)、β杆状病毒属(Betabaculovirus,感染鳞翅目昆虫的GV)、γ杆状病毒属(Gammabaculovirus,感染膜翅目昆虫的NPV)、δ杆状病毒属(Deltabaculovirus,感染双翅目昆虫的NPV)。
杆状病毒杀虫剂与传统农药相比,有着宿主专一性强、环境兼容性好、对人畜无害、同时在环境中存活时间长等优势,是未来农药理想的发展方向[10]。除了在生物农药中的应用,昆虫杆状病毒表达系统已经被广泛应用于外源基因的表达,相对于原核表达系统和真核表达系统具有产物后加工好、成本低廉等优点,因而广泛应用于商业领域如生物医药、疫苗研发等方面。杆状病毒除了以上2个方面的应用,还可以应用于哺乳动物基因转移载体、表面展示系统以及病毒样颗粒疫苗制备。鉴于此,综述了杆状病毒基因组学研究进展,以促进对杆状病毒结构和功能的了解,为更好地开发和利用杆状病毒提供借鉴。
1 杆状病毒基因组
1.1 基因组特征
自从1994年Ayres等[11]报道苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicamultiple nucleopolyhedrovirus, AcMNPV)C6株的全基因组序列以来,随着分子生物学技术手段的飞速发展,已有73种杆状病毒全基因组被测定,包括45种α杆状病毒、22种β杆状病毒、1种δ杆状病毒、3种γ杆状病毒和2种未分类病毒(表1)。通过对不同杆状病毒基因组比较发现,其基因组大小介于80~180 kb,G+C含量在29%~58%,全长大于50个氨基酸的ORF有89~181个。这些ORF几乎均匀地分布在基因组DNA的2条链上,转录方向没有偏好性,基因之间的基因间序列非常短,甚至基因之间有重叠。非编码区占10%左右,主要由基因启动子序列、基因上游或下游非编码区和同源重复区(Homologous regions,hrs)组成。

表1 GenBank数据库中已注册的杆状病毒基因组信息

续表1 GenBank数据库中已注册的杆状病毒基因组信息
注:所有数据均来自https://www.ncbi.nlm.nih.gov/genomes/GenomesGroup.cgi? taxid =10442。
1.2 核心基因
尽管不同种杆状病毒基因组存在基因组成的多样性,但研究发现,有1套相对保守的基因存在于目前已测序的杆状病毒基因组中。2012年Garavaglia等[12]研究发现37个杆状病毒核心基因。2017年Javed等[13]报道了第38个核心基因pif7 (ac110)。目前,杆状病毒的核心基因数目为38个,具体分类和名称见表2。按照核心基因的功能可以分为五大类:复制,转录,包装、装配和释放,口服感染,与宿主细胞相互作用。在核心基因编码产物中,大约1/2是参与衣壳和ODV囊膜组成以及感染幼虫所必须的蛋白质。其他大部分参与DNA的复制或加工,或者与晚期或极晚期转录有关。这些核心基因因其重要性在长期进化中得以保留,并成为杆状病毒的重要标志[14]。随着研究的深入也许会发现更多的核心基因,因为病毒许多共有的基因在进化过程中发生了突变而没有被分析出来。

表2 杆状病毒核心基因及分类
2 杆状病毒功能基因组学
2.1 RNA转录相关基因
杆状病毒基因组的转录表达是按时序进行的。根据杆状病毒基因在病毒复制过程中的表达时间可分为极早期、早期、晚期和极晚期[15]。早期基因的合成依赖宿主RNA聚合酶Ⅱ识别和转录,而晚期基因则是病毒编码的RNA聚合酶转录[16]。
转录活化因子IE-1与杆状病毒基因组中的hrs相互作用形成二聚体,该二聚体可与宿主的转录系统相互作用从而促进早期基因的转录。杆状病毒晚期基因利用的RNA聚合酶,由4个转录晚期和极晚期基因的亚基构成(LEF-4、LEF-8、LEF-9和P47)[16]。LEF-4是一种参与RNA加帽的酶。在LEF-8的C端发现很多物种RNA聚合酶的保守基序,它编码RNA聚合酶的催化位点[17]。LEF-9存在与RNA聚合酶β亚基同源的基序,编码酶活化中心Mg2+结合位点[18]。P47是RNA聚合酶中较小的亚基,与其他RNA聚合酶没有同源性[19]。LEF-5和VLF-1也和晚期基因的转录相关。研究发现,LEF-5可与自身相互作用且C端含有一段与RNA聚合酶Ⅱ延长因子TFIIS类似的结构域。通过对LEF-5进行纯化分析表明,LEF-5的功能是起始转录,而非延伸因子[20]。VLF-1与多角体蛋白和P10的转录相关。VLF-1与多角体和P10基因启动子下游的“爆发序列”结合引发它们的大量表达[21]。其他与晚期基因表达有关的基因为lef-6、lef-10、lef-12和39k。此外,甲基转移酶(Ac69)、ADP-核糖焦磷酸水解酶、LEF-2和PK1也可能参与了晚期基因的表达。
2.2 DNA复制相关基因
病毒DNA复制相关基因在病毒生命周期中起着关键的作用。杆状病毒DNA的复制是由顺式作用元件、反式作用因子及其宿主细胞提供的复制因子共同作用而完成的。顺式作用元件是指病毒DNA复制起点,它包括同源重复序列和非同源重复序列2类。反式作用因子是病毒表达产物,该产物是病毒DNA复制所必需的。瞬时复制试验证明,dna-pol、helicase(p143)、ie-1、lef-1、lef-2和lef-3是DNA复制的必需基因。IE-1是一种多功能调节蛋白,它能够反式激活多个早期基因和晚期基因的启动子,且其酸性激活区是病毒DNA复制所必需的[22]。LEF-1具有DNA引物酶活性,可与LEF-2相互作用[23]。LEF-2是一种DNA引物酶协助因子,也是DNA复制所必需的[24]。LEF-3是一种单链结合蛋白(SSB),也可运送病毒DNA解旋酶进入宿主细胞核中[25]。P143是病毒编码的DNA解旋酶,具有ATP酶和解旋酶的活性。dna-pol编码了病毒的DNA聚合酶,具有3′—5′外切核酸酶活性。P35、IE-2、PE38、LEF-7、VLF-1作为激活因子刺激病毒DNA的复制。AN具有5′—3′核酸外切酶和核酸内切酶的活性,参与DNA的重组[26]。
2.3 主要结构蛋白基因
将杆状病毒DNA转染至相应细胞可以正常产生有感染性的子代病毒,病毒的复制和增殖并不受影响。因此,推测病毒结构蛋白对早期基因转录和病毒DNA复制并不是必需的[27]。杆状病毒结构蛋白组成的复杂结构相当于一个将病毒基因组转入宿主细胞中的运载系统,是通过对宿主昆虫的长期适应进化演变而成的。有些结构蛋白还具有其他酶活性,能够促进和帮助病毒在细胞内的复制。杆状病毒产生的2种不同类型的病毒粒子BV和ODV,具有相同的核衣壳结构但囊膜组分不同(图1)。表3详细列出了杆状病毒的主要结构蛋白基因,其主要编码包涵体蛋白、BV和ODV的囊膜蛋白及核衣壳相关蛋白组分,其中后者大部分是BV和ODV共有的。
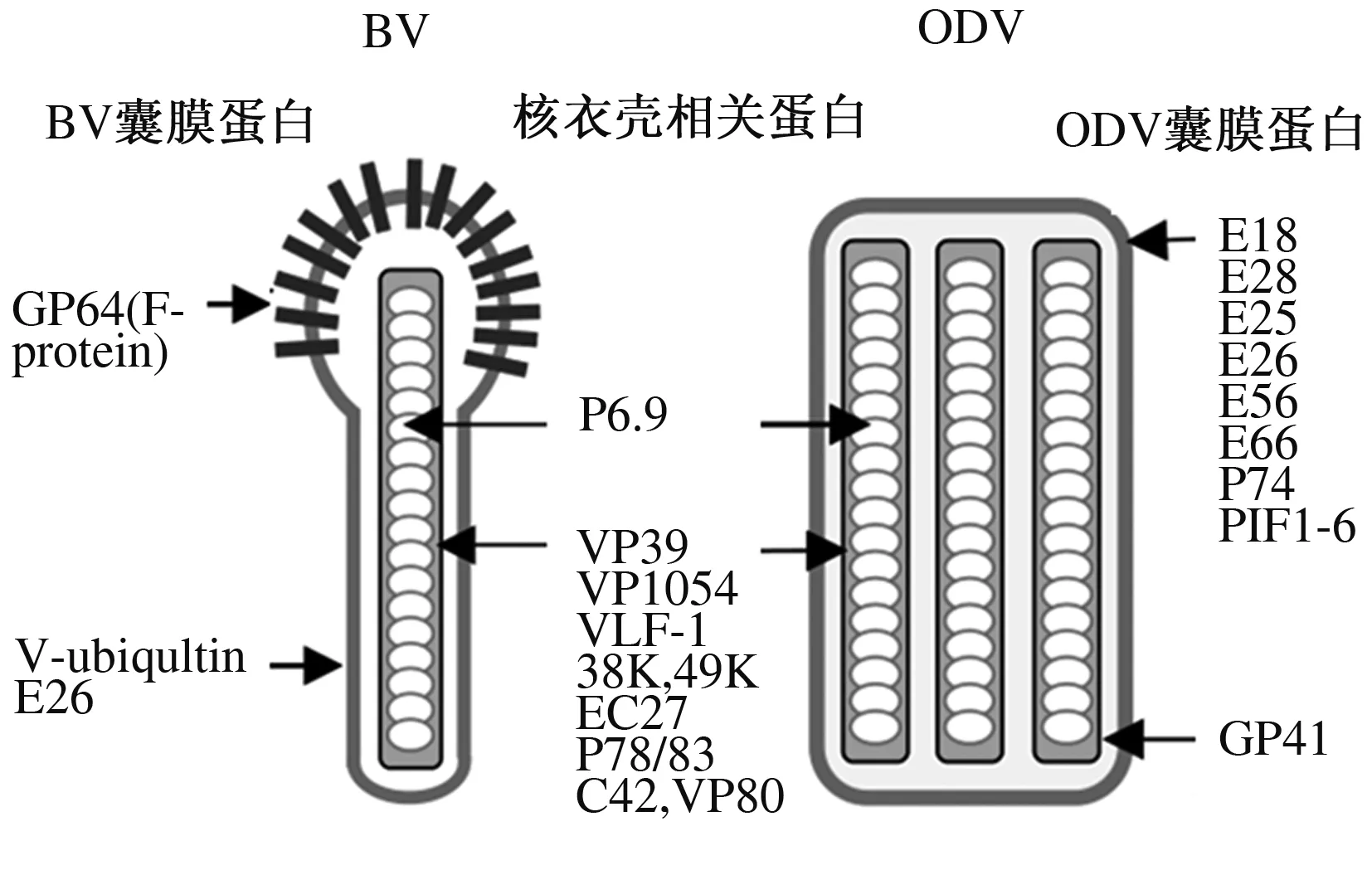
图1 BV和ODV的结构与主要蛋白质构成

蛋白质分类基因名称敲除后的影响包涵体蛋白polyhedrin可稳定存在pe可稳定存在enhancin可稳定存在P10可稳定存在alkaline proteasesBV囊膜蛋白gp64无法稳定存在F-Protein可稳定存在,但杀死幼虫的时间延长V-ubiquitin可稳定存在,但BV产量减少e26可稳定存在ODV囊膜蛋白e26可稳定存在e25无法稳定存在ec43无法稳定存在e18无法稳定存在e66可稳定存在vp91可稳定存在ac145可稳定存在,但经口感染能力降低p74可稳定存在,没有经口感染能力pif-1可稳定存在,没有经口感染能力pif-2可稳定存在,没有经口感染能力pif-3可稳定存在,没有经口感染能力pif-4可稳定存在,没有经口感染能力pif-5可稳定存在,没有经口感染能力pif-6可稳定存在,没有经口感染能力核衣壳相关蛋白p6.9无法稳定存在vp39无法稳定存在gp41无法稳定存在38k无法稳定存在p49无法稳定存在ec27无法稳定存在ac66受到严重影响 p33无法稳定存在vp1054无法稳定存在vlf-1无法稳定存在vp80无法稳定存在pp78/83无法稳定存在p24可稳定存在
3 杆状病毒的应用
杆状病毒的分子生物学研究促进了对病毒组装及感染周期的认识,具有重要的理论意义,同时也具有重要的实践意义。目前,杆状病毒已广泛用作生物杀虫剂和外源蛋白表达载体。此外,杆状病毒作为基因治疗载体也越来越受到重视。
3.1 杀虫剂
昆虫杆状病毒杀虫剂的研究始于19世纪。目前,已在20多个国家登记、生产和应用了近40种病毒杀虫剂[28]。野生型杆状病毒杀虫剂具有对人畜和天敌无害、宿主特异性高、无化学残留、对环境安全、可自然传播等优点。然而,杆状病毒的杀虫速度慢、杀虫谱窄等缺点限制了其推广。为了克服杆状病毒的缺点,科学家开始尝试用各种分子生物学手段进行改造以获得重组杆状病毒。近年来,该方面的研究主要集中在以下几个方面:(1)缺失内源基因增加杀虫效果。如将AcMNPV中的egt基因缺失,重组病毒会减少昆虫的摄食,从而提高感染昆虫的死亡率[29]。(2)插入外源基因提高杀虫速度、降低害虫对病毒的抗性。如插入昆虫专性神经毒素基因、昆虫保幼激素酯酶基因、增效蛋白基因、蛋白酶基因、利尿激素基因等构建的重组病毒,大大缩短了害虫的发病时间。(3)内源基因过量表达。如过量表达vfgf基因的重组AcMNPV明显加速了寄主死亡[30]。(4)对宿主范围基因操作来拓宽杆状病毒宿主域。如将源自舞毒蛾核型多角体病毒(Lymantriadisparmultiple nucleopolyhedrovirus, LdMNPV)的hrf-1基因插入AcMNPV中,重组AcMNPV病毒可以在舞毒蛾细胞中复制[31]。随着对重组病毒的深入研究,克服了杆状病毒的缺点,也为增强病毒的杀虫功能提供了可能。
3.2 表达载体
昆虫杆状病毒表达载体系统(Baculovirus expression system,BEVS)是基因工程四大表达系统之一,目前市场上商业化的杆状病毒载体有Ac-Bacmid(来源于苜蓿银纹夜蛾核型多角体病毒基因组)和Bm-Bacmid(来源于家蚕核型多角体病毒基因组)[32-33]。它们在实际应用过程中具有产物表达水平高,表达产物可进行翻译后加工,外源蛋白的免疫原性、抗原性和功能等生物活性与天然蛋白质相似,大规模生产基因工程产品成本低等优点。自1983年人们利用该表达系统首次成功表达人干扰素-β后,相继成功表达了人生长因子、人2,6-唾液酸转移酶、人粒-巨噬细胞集落刺激因子和人抗白蛋白免疫蛋白G1等蛋白[34-37]。目前,美国FDA(食品和药物管理局)已经授权上市9种BEVS来源的产品,其中Cervarix®、Provenge®、Glybera®和Flublok®疫苗分别用于预防和治疗子宫颈癌、前列腺癌、脂蛋白酶缺乏遗传病和流感;Porcilis®Pesti、BAYOVAC CSF E2®、Circumvent®PCV、Ingelvac CircoFLEX®和Porcilis®PVC主要用于预防猪疫病[38]。昆虫杆状病毒表达载体系统可广泛应用于生物学、医学、农业等不同领域表达蛋白质,为人类服务。
3.3 基因治疗
基因治疗是一种通过基因转移载体将外源正常基因导入靶细胞以纠正基因的缺陷或者发挥治疗作用,从而达到治疗疾病目的的生物医学技术。杆状病毒相比于其他病毒转移载体具以下优点:(1)基因容量大,可容纳1个或多个外源基因。(2)安全性高。由于杆状病毒的天然宿主昆虫是节肢动物,与人及其他哺乳动物的亲缘关系较远,即使它进入哺乳动物细胞,其基因组也不能在细胞中复制。(3)表达蛋白质效率高。杆状病毒表达载体可同时携带多个启动子,这些启动子能各自驱动下游基因的高水平表达。(4)翻译后修饰能力与哺乳动物细胞相似。因此,杆状病毒在基因治疗中具有广阔的应用前景,开辟了杆状病毒应用的新领域。目前杆状病毒可用于治疗多种疾病,包括癌症、感染性疾病、遗传性疾病、心血管疾病和自身免疫性疾病等,其中癌症治疗是该技术的主要研究和应用领域[39]。
4 小结
随着生态环保概念深入人心,昆虫杆状病毒将具有更大的发展前景,不仅为农林生产提供新的生物农药,而且为研究宿主功能基因提供重要的基因工程载体[40]。杆状病毒作为杀虫剂,杀虫速度慢和宿主域窄是其缺点,同时也是其优点。杀虫速度慢是因为病毒是一种简单生命,要在虫体内完成其复制周期,害虫难以对其产生抗性;正是因为宿主域窄,所以它们对非靶标生物是安全的。在应用基础研究上,可以针对具体情况构建重组型病毒或者添加杀虫增效剂[41]。作为表达系统,其外源蛋白表达量低和蛋白质表达后修饰存在差异,也可以通过优化表达系统进行完善。越来越多杆状病毒基因组测序和功能基因研究的完成,为病毒杀虫剂的开发提供了理论支持,也为深入了解杆状病毒的侵染机制、分子进化和病毒与宿主的特异性互作关系提供重要的理论依据。
