猪传染性胃肠炎病毒双抗体夹心ELISA检测方法的建立
2013-08-30屈月葛俊伟唐丽杰乔薪瑗姜艳平尹光昕李一经
屈月,葛俊伟,唐丽杰,乔薪瑗,姜艳平,尹光昕,李一经
(东北农业大学动物医学学院,黑龙江哈尔滨 150030)
猪传染性胃肠炎(Transmissible gastroenteritis,TGE)是由冠状病毒科、冠状病毒属的TGE病毒(TGEV)引起猪的一种以呕吐、严重水样腹泻和脱水为特征的急性、高度接触性传染病[1]。TGE常与其他腹泻性疾病发生混合感染,并且在临床不易与其他腹泻病相区别。因此,对TGE进行准确的诊断与鉴别诊断对防制该病具有重要意义。
目前,对TGE病原检测技术主要有病毒分离、免疫荧光、ELISA和病毒核酸检测等[2]。其中,分离与鉴定病毒为直观而且经典的检测方法,而其缺点是检测周期长;免疫荧光技术与PCR探针技术虽然检测灵敏度高、检测周期短,但易出现假阳性[3-4]。因此,对于该病的诊断需要几种检测方法相互补充以达到正确诊断的目的。
ELISA检测方法具有敏感性高、特异性强、操作简便和样本检测量大等特点,是一种广泛用于病原和血清抗体检测的免疫学技术。本实验以TGEV核蛋白(N)单克隆抗体(MAb)及其多克隆抗体(PcAb)为检测抗体,通过各种条件的优化,建立了检测TGEV的双抗体夹心ELISA方法,为TGEV快速检测和疾病的实验室诊断奠定了基础。
1 材料和方法
1.1 细胞、病毒株及实验动物 PK细胞、抗TGEV N蛋白MAb杂交瘤细胞株[5]、表达TGEV N蛋白pProExHTb载体的大肠杆菌DH5α[6]以及TGEV、猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)、轮状病毒(RV)、猪瘟病毒(CSFV)、伪狂犬病病毒(PRV)均由本实验室保存;待检猪粪样品22份,采自黑龙江省、内蒙古自治区各地发生腹泻的猪场;家兔和清洁级BALB/c小鼠,6周龄~8周龄,购自哈尔滨兽医研究所实验动物中心。
1.2 主要试剂 弗氏完全佐剂、弗氏不完全佐剂和小牛血清白蛋白(BSA)、辣根过氧化物酶标记羊抗鼠IgG(IgG-HRP)和羊抗兔IgG(IgG-HRP)购自Sigma公司;酶标板(Costar)购自JET BIOFIL公司;辛酸购自上海凌峰公司;TGEV抗原检测卡购自Anigen公司;蛋白A亲和树脂购自GE Healthcare公司。
1.3 TGEV N蛋白MAb的大量制备 按照文献[5]方法制备TGEV N蛋白的MAb。
1.4 兔抗TGEV N蛋白PcAb的制备及动物免疫将表达TGEV N蛋白的pProExHTb/DH5α在LB培养基中震荡培养,并经IPTG诱导表达后,提取包涵体进行SDS-PAGE电泳,将目的蛋白切胶纯化,并将含TGEV N蛋白的胶条与等体积弗氏佐剂混合。初次免疫用弗氏完全佐剂乳化,加强免疫用弗氏不完全佐剂乳化,皮下背部分6点接种家兔,2 mg/只,每隔两周加强免疫一次,最后一次免疫2周后以ELISA测定血清抗体效价,并采血、分离血清。
1.5 MAb腹水与PcAb的纯化 采用辛酸-饱和硫酸铵法[7]对腹水MAb和PcAb进行粗提后,采用蛋白A亲和层析方法[8]对粗提的MAb和PcAb进行纯化,纯化的抗体在50×0.01 MpH7.0 PB溶液中4℃搅拌透析过夜。
1.6 样品处理
1.6.1 粪便样品处理以2种方法处理粪便样品:①采用pH7.0 PBS按200mg/mL的比例稀释成悬液,微型旋涡振荡2 min,3 000 r/min 4℃离心10 min后取上清液100μL。②粪便样品与pH7.4 PBS 1∶4混合,微型旋涡振荡5min,4℃过夜,将其反复冻融 3次,每次 10 Min,差速离心(3 000 r/m in、6 000 r/min、12 000 r/min分别离心10min),收集上清。通过实验比较确定最佳的粪便中病毒提取方法。
1.6.2 病毒N蛋白的提取采用PK细胞按常规方法培养TGEV,细胞培养物反复冻融3次后,离心收取病毒。将收集的细胞毒、粪便毒分别与蛋白裂解液[9](含 SDS、Tris-Hcl、Trixon-100、EDTA,pH7.4)和韩国蛋白裂解液(TGEV抗原检测卡)混合,4℃静置30 Min,加入 0.03 g/mL KCl,4℃静置 1 h,然后12 000 r/m in离心10 Min取上清,通过实验比较2种蛋白裂解液裂解效果。
1.7 双抗体夹心ELISA方法的建立
1.7.1 操作程序以pH 9.6的碳酸盐缓冲液稀释纯化的抗TGEV N蛋白MAb包被酶标板,100μL/孔,4℃过夜;以含5%脱脂乳PBS为封闭液37℃封闭1 h;加入裂解后的病毒作为待检样品,100μL/孔,37℃孵育1 h;以纯化的兔抗TGEV高免血清为一抗,37℃反应1 h;以羊抗兔IgG-HRP为二抗,37℃孵育1 h;底物溶液37℃避光显色15m in;在每次更换反应液前采用PBST洗涤板3次,最后以2 mol/L硫酸终止反应,测定OD490nm值。计算P/N值,P/N值=样品OD490nm值/阴性样品OD490nm值。
1.7.2 最佳反应条件的选择在不同的反应条件下,对抗TGEV N蛋白MAb包被浓度(0.05μg/mL~6.4μg/mL)、兔抗TGEV N蛋白 IgG工作浓度(0.9μg/mL~3.5μg/mL)、样品孵育时间(40 Min~120 min)进行ELISA方阵试验,采用已知TGEV细胞毒、PK细胞培养液作为阳性和阴性样品,测定OD490nm值,并计算P/N值,确定抗TGEV N蛋白IgG最佳包被浓度、兔抗TGEV N蛋白IgG最佳工作浓度和样品反应时间。
1.8 ELISA判定标准的确定 采用建立的ELISA方法对30份经RT-PCR鉴定为阴性的粪便样品进行检测,计算OD490nm平均值(X)和标准差(SD),阳性临界值=阴性样品X+3SD。检测时,当样品OD490nm>阳性临界值,并且阳性对照/阴性对照>2时,判定为阳性。
1.9 特异性试验
1.9.1 阻断试验将4份TGEV阳性样品分别与抗TGEV N蛋白MAb、兔抗TGEV N蛋白IgG、阴性猪血清、阴性兔血清混合,37℃作用1 h,离心取上清作为待检样品,每份样品重复3次,用已知TGEV细胞毒、PK细胞培养液作为阳性和阴性对照,进行ELISA试验,当阻断结果>50%,则表明有阻断效果[10]。
1.9.2 交叉反应试验采用双抗体夹心ELISA对PEDV、PPV、RV、CSFV、PRV细胞培养物进行检测,用已知TGEV细胞毒、PK细胞培养液作为阳性和阴性对照,以评价该方法的特异性。
1.10 重复性试验相同的条件下,在同一个酶标板内检测3个不同代次TGEV培养物,每个样品重复4孔;选取3块不同酶标板,用同一批制备的抗体包被,加入3个不同代次的TGEV培养物,按最佳条件进行ELISA,分别计算样品的板内和板间变异系数(CV)。
1.11 灵敏性试验将TGEV细胞培养物(10-6.5TCID50)按 1∶50、1∶100、1∶200、1∶400 倍比稀释,各取 100 μL进行ELISA检测,确定最低的检出浓度。
1.12 双抗体夹心ELISA检测方法与RT-PCR试验的比较将22份猪粪便样品处理后各取100μL的上清液,按照本实验建立的ELISA检测方法与RT-PCR[11]同时检测,并将这两种方法的检测结果进行比较,确定该方法的特异性、敏感性和符合率。
2 结果
2.1 MAb腹水与PcAb的纯化 将抗体效价为1.28×107的 MAb腹水和抗体效价为 1.024×106的PcAb经辛酸-硫酸铵法、亲和层析法提纯,提纯后取样进行SDS-PAGE分析,结果表明经辛酸-硫酸铵法粗纯的抗体电泳区IgG重链和轻链区带明显。进一步亲和层析法纯化无杂蛋白区带,重链和轻链大小分别为55 ku和22 ku。经蛋白分光光度计测定,纯化后MAb腹水和PcAb的蛋白浓度分别为2.779 mg/mL和3.531 mg/mL,间接ELISA方法测定,纯化后MAb腹水和PcAb效价分别为1.28×106和 5.12×105。
2.2 双抗体夹心ELISA方法的建立
2.2.1 最佳反应条件的确定通过ELISA方阵试验确定了主要的工作条件:当纯化抗TGEV N蛋白MAb包被浓度为0.4μg/mL,兔抗TGEV N蛋白PcAb工作浓度为3.5μg/mL,酶标二抗的工作浓度为 1∶5 000,阳性血清 OD490nm值接近1.0,P/N值最大,同时当P/N值最大时选择样品最佳孵育时间为37℃ 60m in。
2.2.2 ELISA判定标准的确定采用建立的ELISA方法检测已知30份阴性粪便样品,结果表明当30份阴性样品的X为0.202,SD为0.038,根据公式计算阳性临界值=X+3SD=0.316,确定当P/N>2,同时OD490nm值≥0.316时,则判为阳性;否则为阴性(图 1)。
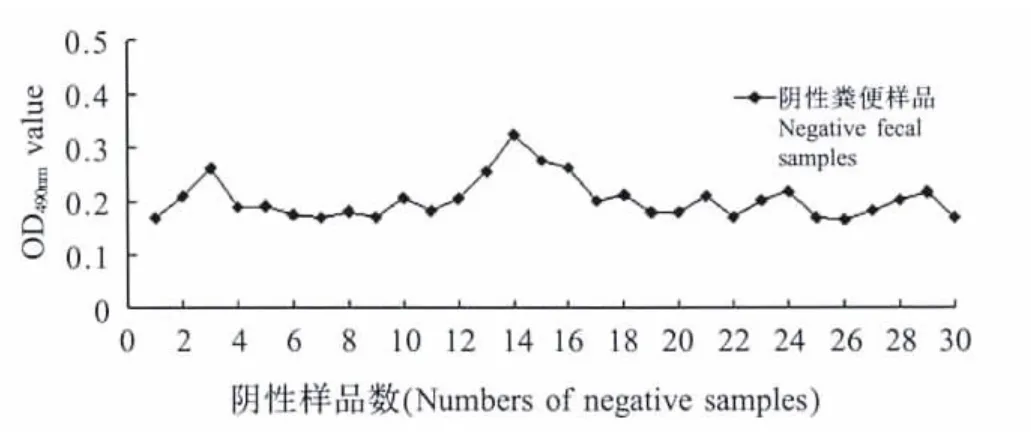
图1 阴性样品试验结果Fig.1 Results of negative sample test
2.2.3 不同裂解液和不同粪便样品处理方法的比较结果将粪便样品作为待检样,采用2种不同的裂解液和2种不同处理方法进行处理,同时按最佳ELISA条件进行反应,结果表明,在相同裂解液处理后,将粪便样品与pH7.4 PBS混合,4℃过夜后差速离心处理方法释放出的病毒N蛋白更多,同时在相同的粪便样品处理下,分别加入等体积的自制蛋白裂解液与快速检测试剂盒中裂解液,采用建立的ELISA方法检测,结果表明自制裂解液与快速检测试剂盒中的裂解液裂解效果一致。
2.3 特异性试验 将4份TGEV阳性样品分别与抗TGEV N蛋白MAb、兔抗TGEV N蛋白IgG、阴性猪血清、阴性兔血清混合,37℃作用1 h,离心取上清作为待检样品,采用建立的ELISA方法检测,结果显示,TGEV阳性样品可以被猪抗TGEV N蛋白IgG、兔抗TGEV N蛋白IgG阻断,而不被阴性猪血清、阴性兔血清阻断。
同时该方法与PEDV、PPV、RV、CSFV、PRV反应,以细胞上清液作为阴性对照,TGEV细胞毒作为阳性对照,按照最佳ELISA反应条件进行,结果表明该方法只与TGEV反应,与其他猪病毒均无交叉反应(表1),显示该方法具有很好的特异性。
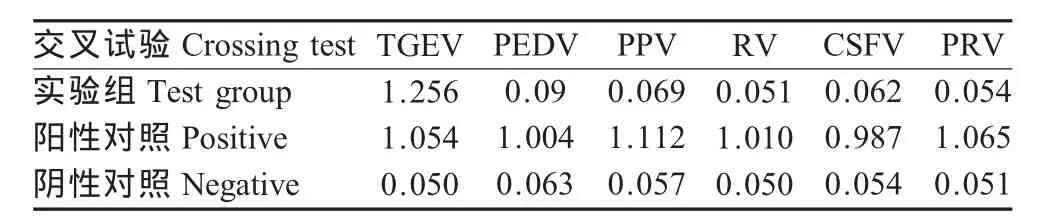
表1 交叉试验结果Table 1 Crossing test of the experimental results
2.4 灵敏性试验 将TGEV细胞培养物以不同倍数稀释,同时设立阴性、阳性作对照,采用建立的ELISA方法检测,结果表明,随着病毒含量的降低,其OD490nm值呈线性下降,当病毒1∶200稀释时,结果为阳性(OD490nm值为 0.356),而稀释度为 1∶400时,结果为阴性(OD490nm值为0.132),表明该方法在1:200稀释,即0.5×10-8.5TCID50时效果最好。
2.5 重复性试验 在同一个酶标板内检测3个不同代次TGEV培养物或同一批制备的抗体包被,加入3个不同代次的TGEV培养物,采用建立的ELISA进行检测,每份样品重复3次,重复性分析结果显示板内变异系数为4.5%~6.99%,变异程度很小。板间变异系数为3.3%~7.25%,均小于10%(表2),表明该方法具有较好的重复性。
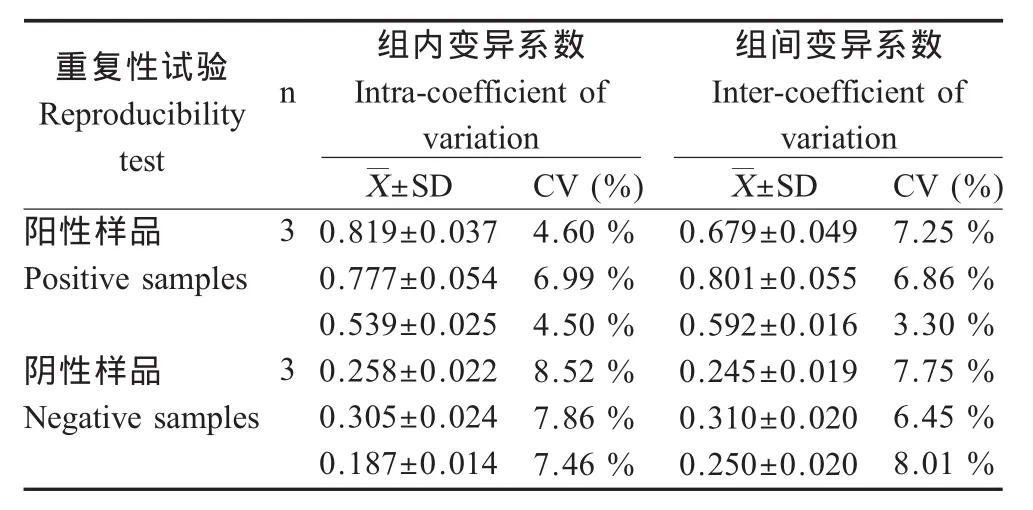
表2 组内、组间重复性试验结果Table 2 Intra-and inter-assay of CI-ELISA reproducibility
2.6 双抗体夹心ELISA检测方法与RT-PCR试验的比较结果 采用本实验建立的双抗体夹心ELISA诊断方法与RT-PCR试验同时检测22份猪粪便样品,检测结果显示:本实验建立的ELISA方法共检出阳性样品5份,阳性率为22.7%(5/22),而TGEV RT-PCR方法检测出阳性样品7份,阳性率为31.8%(7/22)(表3),两方法的符合率为81.8%(18/22),经x2检验,两方法的检测结果无显著性差异(p>0.05),表明建立的双抗体夹心ELISA方法可以用于TGEV检测。

表3 临床样品检测结果Table 3 Clinical sample test results
3 讨 论
目前国内已有检测TGEV S蛋白和M蛋白的免疫学方法[12-13],由于S蛋白和M蛋白存在于病毒表面而冠状病毒囊膜又极易脱落导致其丢失,该种蛋白的易丢失性影响了TGEV检测的敏感性和准确性。而N蛋白位于病毒内部属于核蛋白,不易丢失而且具有保守性。目前,国内尚未见用N蛋白建立的ELISA检测方法,经实验研究该方法具有较好的稳定性和准确性。
本实验首先需要裂解释放病毒中的N蛋白,而如何裂解释放出N蛋白是本实验的重点。因为不同的裂解液的浓度、组成成分均会直接影响N蛋白的释放,甚至会破坏N蛋白,所以本实验使用不同裂解剂及裂解方法,对病毒进行裂解,最终研究显示,在裂解液中加入少量的SDS可以使细胞完全破裂,释放更多的病毒,Triton-100可以很好的保留蛋白活性,Tris-HCl可以起到缓冲pH环境的作用,经试验证明自制裂解液能将病毒囊膜蛋白去除并较好的暴露出N蛋白,与TGEV抗原检测试剂卡中蛋白裂解液比较,裂解效果一致,由于其制备简单、储存方便和操作简便可以将自制裂解液作为裂解TGEV的常用裂解液。
在双抗体检测方法中抗体的纯度越高,非特异性反应越低,从而保证了较强的特异性。在包被抗体的选择上,MAb与PcAb相比,MAb的抗原位点专一而且具有高度的特异性,由此选作包被抗体。除此之外,在研究中表明PcAb作为包被抗体,MAb作为检测抗体时,无法检测出阳性样品。据此推测PcAb作为包被抗体时其先与病毒的N蛋白发生特异性结合,完全占据了N蛋白的抗原位点,以致MAb的位点被PcAb竞争性抑制,无法与N蛋白发生特异性结合。
对于ELISA方法结果的判定至今尚无统一的判定标准[14],而结果的判定直接影响其敏感性和特异性,由于临界值受其主观因素影响较大,易造成试验判定出现偏差。因此,本实验选取双重判定标准来降低偏差以保证实验结果的可靠性。双重判定标准结合P/N>2.1判定为阳性临界值和阳性临界值>阴性样品X+3SD这两种方法,通过两种方法的结合可以更好地减少误差和增加结果的可靠性。本研究通过方阵滴定试验确定了抗体包被浓度和反应浓度,并优化相关反应条件降低了非特异性而提高了检测的敏感性。但由于本实验采用的并不是纯化后的病毒,所以病毒粒子含量低,导致相应的灵敏度不高。经过与几种猪病毒的交叉反应试验验证出该检测方法特异性强,表明本实验建立的检测方法可以用于TGEV的鉴别诊断。
[1]V aughn E M,Halbur P G,Paul P S.Use of non radioactive cDNA probes to differentiate porcine respiratory corona virus and transm issible gastroenteritis virus[J].J Vet Diagn Invest,1996,8(2):241-244.
[2]殷震,刘景华.动物病毒学[M].第2版,北京:科学出版社,1997,681-688.
[3]杨群,何孔旺,陆承平.应用多重RT PCR方法检测158例猪粪样中的两种冠状病毒[J].中国预防兽医学报,2006,(4):431-435.
[4]陈芳,刘惠莉,孙红立,等.多重RT-PCR检测猪传染性胃肠炎病毒和猪流行性腹泻病毒[J].中国兽医学报,2005,25(1):9-12.
[5]姜骞,李一经.抗猪传染性胃肠炎病毒重组N蛋白单克隆抗体的制备及其部分特性鉴定[J].中国预防兽医学报,2005,27(2):103-104.
[6]姜骞,唐丽杰,李一经.猪传染性胃肠炎病毒重组核蛋白的纯化与Dot_ELISA抗体检测方法的建立[J].中国兽医科技,2002,32(7):22-23.
[7]侯美如,侯喜林,高俊峰,等.牛轮状病毒ELISA检测方法的建立[J].黑龙江八一农垦大学学报,2011,23(3):19-20.
[8]辛普森R J.蛋白质纯化实验指南[M].北京:科学出版社,2004.
[9]王志武,卢日峰,范洪学.流感病毒的裂解、纯化及抗原性研究[J].中国生物制品学杂志,2002,15(3):159-160.
[10]黄小波,徐璐,曹三杰,等.猪轮状病毒双抗体夹心ELISA诊断方法的建立[J].中国兽医科学,2009,39(08):723-727.
[11]Kim S H,Kim I J,Pyo H M,et al.Multiplex real time RT-PCR for thesimultaneous detection and quantification of transm issible gastroenteritis virus and porcine epidemic diarrhea virus[J].Virol Methods,2007,146(1/2):172-177.
[12]Liu C,Kokuho T,Kubota T,et al.A serodiagnostic ELISA using recombinant antigen of sw ine transm issible gastroenteritis virus nucleoprotein[J].J Vet Med Sci,2001,63(11):1253-1256.
[13]Carman S,Josephson G,M cEwen B,et al.Field validation of commercial blocking ELISA to differentiate antibody to transm issible gastroenteritis virus(TGEV)and porcine respiratory coronavirus and to identify TGEV-infected sw ine herds[J].J Vet Diagn Invest,2002,14(2):97-105.
[14]吴宝成,荆汝顶.确定ELISA试验阳性临界值的探讨[J].中国动物检疫,1994,11(5):15-16.
