桃柁酚对金黄色葡萄球菌生物膜形成及cidA表达的影响
2013-08-30王晓红熊凌锌史祺云宋晓平
王晓红,于 录,周 泐,熊凌锌,史祺云,宋晓平*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.吉林大学人兽共患病研究教育部重点实验室/吉林大学人兽共患病研究所/畜牧兽医学院,吉林长春 130062)
金黄色葡萄球菌(Staphylococcus aureus)是一种重要的人兽共患病病原菌,属于毒力最强的化脓性条件致病菌,能够引起败血症、伤口感染、肺炎甚至脉管炎[1],常危及人和动物的生命。S.aureus的一个重要特性是可以在感染部位形成生物膜。生物膜能够抵抗多种不同抗菌药物,逃避宿主免疫系统的杀灭作用并且难以被感染宿主清除[2]。生物膜内的细菌在抗生素停用后还可以不断生长并释放进入血液,造成慢性感染和感染复发,导致疾病迁延不愈[3]。因此,研究药物抗菌机制和开发新型抗菌药物在兽医和公共卫生方面都具有重要意义。
桃柁酚是从新西兰桃柁罗汉松中提取出来的天然活性产品,富含芳香二萜,具有显著的抗菌活性和高效的抗氧化活性,能够抑制油脂的过氧化反应并清除活性氧[4]。桃柁酚对S.aureus的抑制作用已有研究[5],但其对S.aureus生物膜的抑制作用及其机制研究未见相关报道。S.aureus体内外研究显示cidA基因的超表达可以促进胞壁质水解酶活性,导致菌体自溶并释放胞外DNA(eDNA),从而促使生物膜形成。而cidA基因的缺失降低了细胞裂解,减少了eDNA释放,同时导致生物膜量的减少[6],表明eDNA在生物膜的形成过程中发挥着重要作用。
本研究通过结晶紫半定量法和激光共聚焦显微镜检测桃柁酚对S.aureus生物膜的抗菌活性,利用实时定量RT-PCR分析桃柁酚对cidA及其调控基因的作用,并测定了桃柁酚对eDNA释放的作用。
1 材料和方法
1.1 菌株及主要试剂S.aureusSA113(ATCC35556)由德国蒂宾根大学GoTZ教授惠赠,具有较强产生物膜能力;S.aureusATCC29213标准菌株购自中国医学微生物菌种保存中心(CMCC);胰蛋白大豆培养基(TSB)购自BD公司;桃柁酚购自CMCC公司;用于配制不同桃柁酚浓度贮存液的DMSO购自Sigma-Aldrich公司;RNeasy Midi kit购自Qiagen公司。
1.2 桃柁酚对生物膜形成的影响 桃柁酚抑制S.aureus形成生物膜的半定量粘附试验根据Tetz等的方法[7]进行并稍作改动。将S.aureus在含有0.25%葡萄糖的TSB培养基(TSBg)中过夜培养并作200倍稀释,按每孔200μL加入96孔板,37℃培养24 h。PBS洗去浮游菌,加入Bouin's固定液固定 1 h,PBS洗3次,加入1%结晶紫染色30 Min,用自来水洗去浮色,待膜干后,每孔用200μL乙醇:丙酮=80∶20(v/v)溶解,于570 nm波长下检测。
1.3 RNA提取及实时定量RT-PCR 用0.5mg/mL溶葡萄球菌素37℃作用于细菌15min,根据RNeasy Midi kit试剂盒说明书提取细菌RNA。所提取RNA用DNAse I(10 U/40 mg)37℃处理20 Min以除去基因组DNA。以16S rRNA基因为内参,用表1中引物对相关基因进行实时荧光定量RT-PCR检测。反应条件为:95℃ 5 min;95℃ 5 s、60℃ 30 s、共40个循环。各引物由上海生工生物工程技术服务有限公司合成。
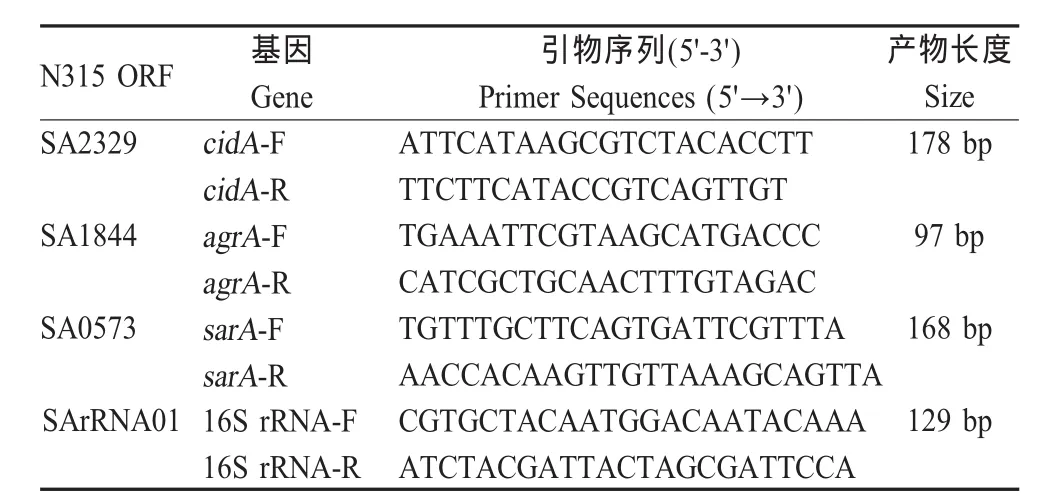
表1 实时定量RT-PCR引物Table 1 The primers used for real-time RT-PCR amplification
1.4 eDNA提取及检测 将S.aureusSA113在TSBg培养基中过夜培养并200倍稀释,将含有不同药物浓度的的菌液加入6孔板,37℃培养24 h,测定细菌OD600nm值。按Rice等[6]的方法提取eDNA,用分光光度计检测A260/A280的吸光度比,eDNA的相对释放量用eDNA的含量/OD600nm表示。
1.5 激光共聚焦显微镜 取4 ML不同药物浓度的菌液加于含有玻片的6孔板各孔中,37℃分别培养3 h、6 h和24 h,弃去药液,用SYTO-9和PI按说明书进行染色。用激光共聚焦显微镜40倍物镜采集图像。SYTO-9用488 nm激发光和520 nm发射光检测,PI用543 nm激发光和572 nm发射光检测。
1.6 细胞毒性试验 用细胞培养液将对数生长期的HaCaT细胞配成浓度为104个/mL细胞悬浮液,每孔100μL接种于96孔培养板,于37℃,5%CO2中过夜培养,加入不同浓度的桃柁酚,作用24 h,用CCK-8于480 nm下检测细胞生长状况。
2 结果
2.1 桃柁酚对生物膜形成的影响 实验室前期研究表明,桃柁酚对S.aureusATCC29213的M IC为2μg/mL,对SA113的M IC为1μg/mL。图1显示,当桃柁酚浓度达到其M IC时,生物膜量急剧减少(p<0.01),其中,与对照组相比,ATCC29213生物膜形成量降低了20倍,桃柁酚浓度为亚抑菌浓度时,细菌生物膜形成量差异不显著,而桃柁酚浓度为1/8×M IC时,诱导了生物膜的形成,使其产膜量增加。
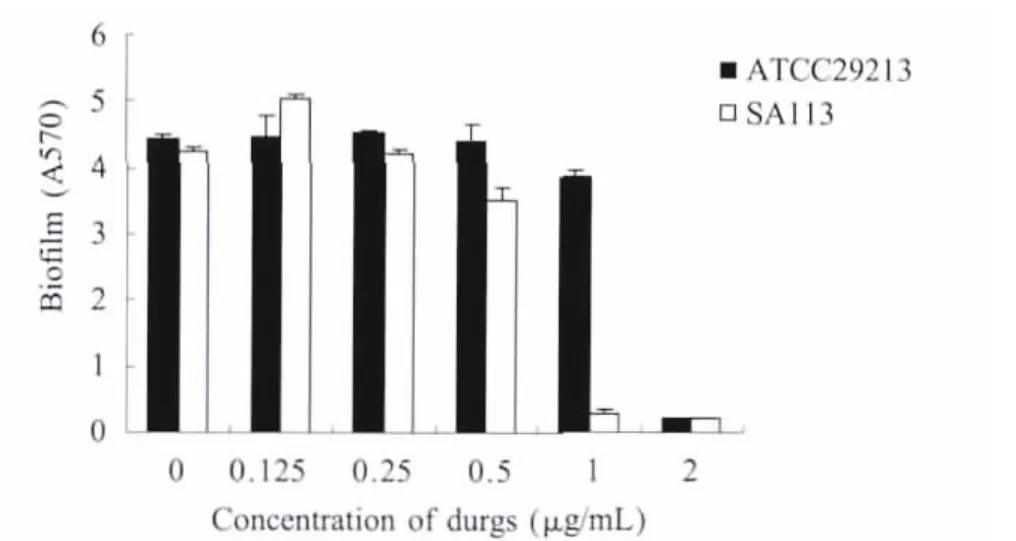
图1 结晶紫半定量法测定不同浓度的桃柁酚对S.aureus生物膜形成的影响Fig.1 Inhibition effect of totarol on S.aureus biofilm formation determ ined by crystal violet staining
2.2 桃柁酚对eDNA及其基因表达的影响 应用实时定量RT-PCR检测桃柁酚对cidA基因及其调控基因agrA和sarA的表达水平。结果显示,与空白相比,亚抑菌浓度时,agrA基因的表达逐渐受到抑制,并且成剂量依赖性。其中,1/2×M IC浓度时,agrA基因的表达约被抑制2.5倍,与对照组相比抑制效果明显(p<0.01)。cidA和sarA基因的表达随药物浓度的升高先被诱导后被抑制(图2)。
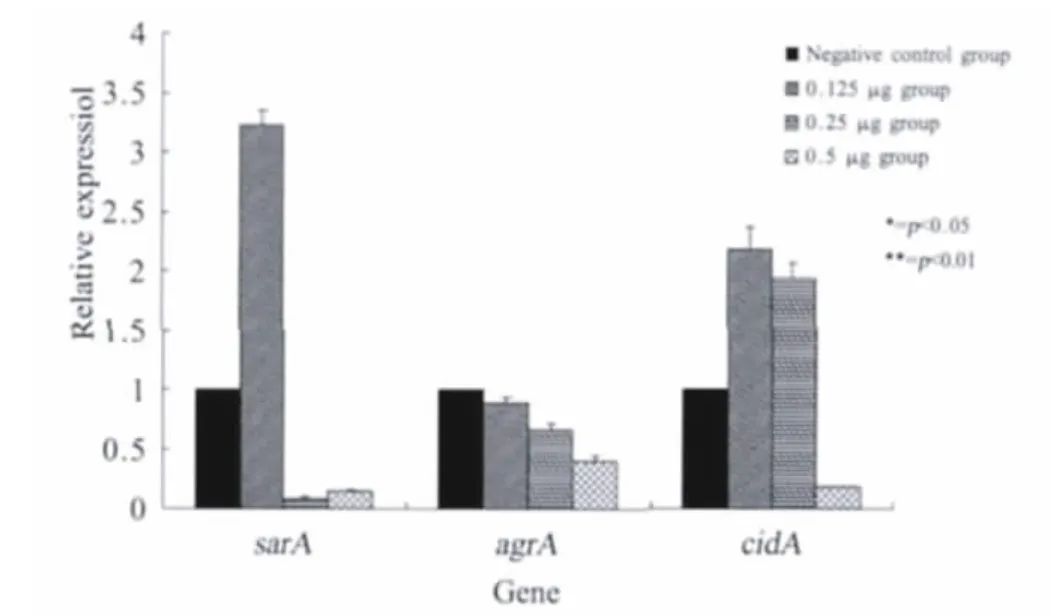
图2 不同浓度的桃柁酚对S.aureus SA113 cidA,sarA,agrA基因的表达影响Fig.2 Expression of biofilm-related genes in SA113 in response to different concentrations of totarol
细菌eDNA的释放方面,药物浓度达到M IC浓度时,eDNA释放量明显受到抑制(p<0.01),而在其亚抑菌浓度时,随着药物浓度升高,eDNA分泌先受诱导后受抑制(图3),与cidA基因表达水平变化趋势相同。
2.3 细胞毒性试验 不同药物浓度对HaCaT细胞的细胞毒性检测结果见图4,当桃柁酚浓度小于4μg/mL时(p<0.05),对细胞无毒害作用。
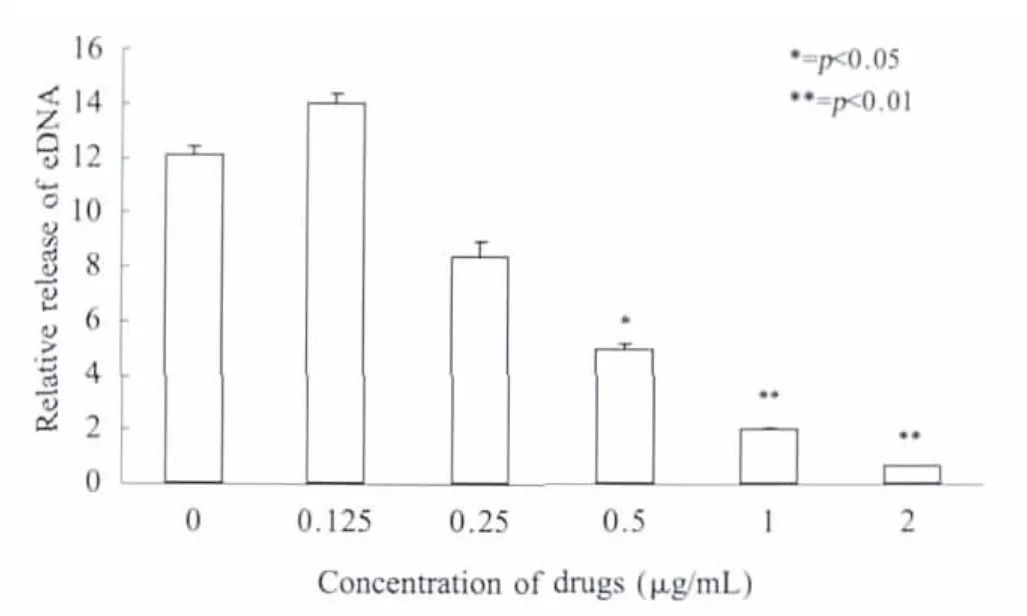
图3 不同浓度桃柁酚对S.aureus SA113生物膜中eDNA释放量的影响Fig.3 Inhibition of totarol at different concentrations on eDNA release of SA113 biofilms
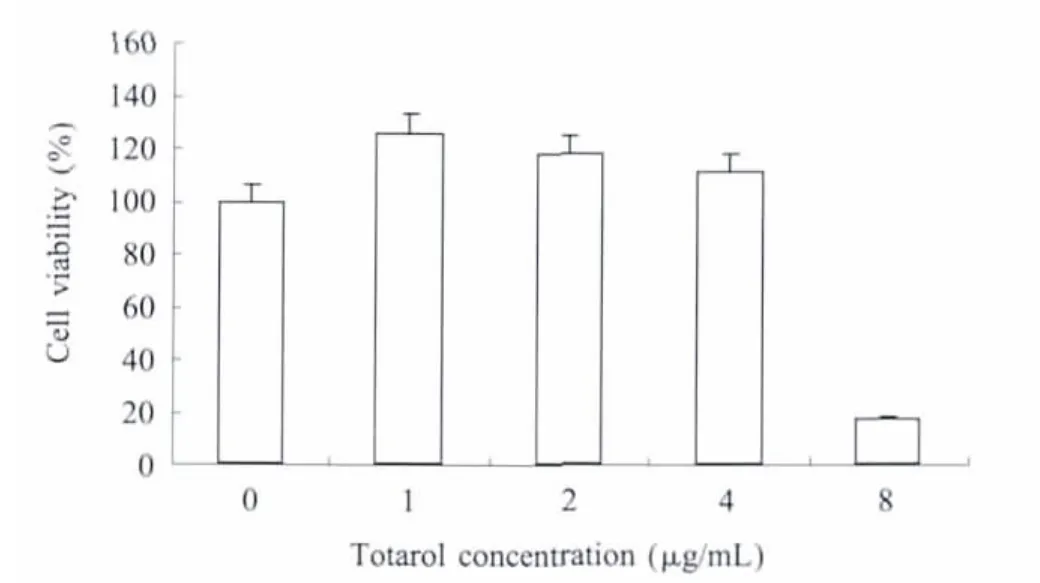
图4 不同药物浓度对HaCaT细胞的细胞毒性检测Fig.4 Toxicity of different concentrations of totarol to HaCaT cells
2.4 激光共聚焦显微镜 利用激光共聚焦显微镜观察亚抑菌浓度(1/8×M IC)下桃柁酚对生物膜的诱导作用和最小抑菌浓度(M IC)下桃柁酚对生物膜的抑制作用(图5)。由图中可见,3 h时,细菌开始粘附,此时1/8×M IC浓度的桃柁酚对生物膜无明显诱导作用,6 h与24 h时,与对照组相比,1/8×M IC药物浓度的桃柁酚明显诱导了生物膜的形成;而M IC浓度的桃柁酚在3 h和6 h时可以完全抑制细菌粘附,24 h时,生物膜的形成量也明显少于对照组。
3 讨 论
本研究检测了桃柁酚对S.aureus生物膜形成过程中对cidA基因及其表达产物的抑制作用,结果表明,桃柁酚可以有效抑制S.aureus生物膜的形成。通过生物膜的结晶紫半定量试验和激光共聚焦显微镜可知,亚抑菌浓度下(1/8×M IC)的桃柁酚不仅不能起到抑菌作用,反而诱导了生物膜的表达。国外学者前期研究表明,某些潜在毒性条件(如高渗透压,去污剂,尿素,乙醇,氧化应激,某些药物的亚抑菌浓度)可以诱导细菌生物膜的形成[8-10]。因此,临床上应严格谨慎使用抗菌药物。
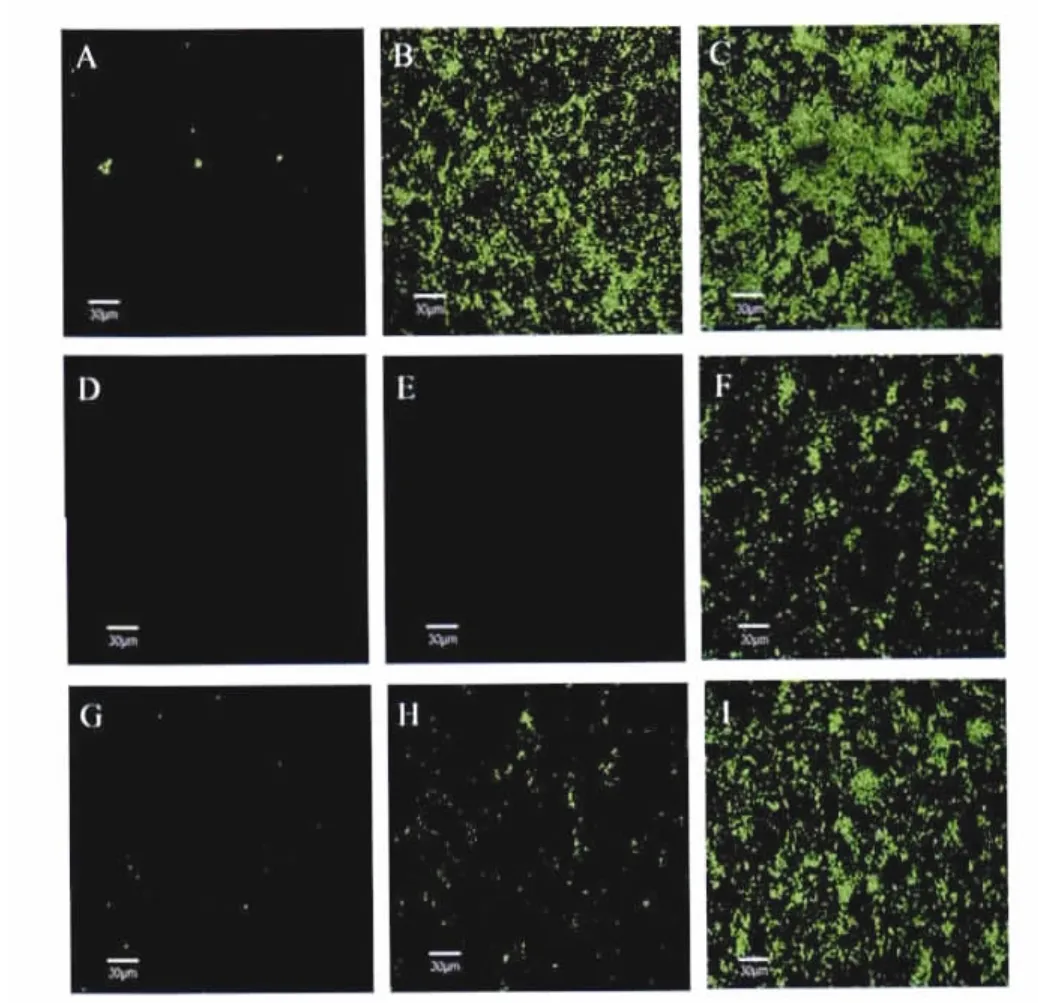
Biofilm formation of SA113 in the absence(G,H and I)or presence of totarol at concentration of 1/8×M IC(A,B and C)and MIC(D,E and F)at time points of 3 h(A,D and G),6 h(B,E and H),and 24 h(C,F and I)
生物膜中超过90%的成份为胞外多聚物基质(Extracellular polymeric substance matrix,EPS),EPS主要由一些胞外多糖、蛋白质、DNA以及一些其它的大分子组成[11]。目前,eDNA作为一种必要的基质分子对细菌生物膜形成的作用在很多细菌中均有报道,包括绿脓杆菌、铜绿假单胞菌、链球菌、表皮葡萄球菌和金黄色葡萄球菌[12-13]。在本研究中,通过检测eDNA表明,经亚抑菌浓度的桃柁酚作用后,eDNA的释放量随药物浓度的增加先被诱导后被抑制,并且随药物浓度增高抑制程度明显增强,呈剂量依赖性。eDNA的释放有着复杂的机制,因细菌种属不同而不同,有的通过细胞自溶作用释放DNA,有的通过III或Ⅳ型释放系统释放DNA,或通过群体感应系统(Quorum sensing)调节DNA的释放,也可以通过多种途径相结合发挥作用[14-15]。
本研究利用实时定量RT-PCR技术检测了促进菌体自溶的cidA基因及agr(accessory gene regulator)二元调控系统和sar(staphylococcal accessory regulator)调控系统中的主要基因agrA和sarA的表达量。结果显示,随药物浓度增加,cidA基因表达趋势与eDNA释放量的趋势相同,均为先诱导后抑制,但在药物浓度为1/4×M IC时cidA基因的表达即受到诱导,表明还有其他途径参与eDNA释放的调控。sarA基因的表达趋势与cidA基因的表达趋势相同,agrA基因的表达随药物浓度的增加逐渐受到抑制。Renzoni等研究表明sarA和agrA可以通过调控cid操纵子的表达来影响细胞自溶作用[16]。另有研究显示,sarA可以通过激活agr调控系统中P2和P3启动子区域,增加RNAIII的转录水平发挥效应,也可以独立于agr系统发挥作用[17]。因此,桃柁酚可能通过影响sarA的转录,进而调控agr系统,最终调控cid操纵子的表达;也可能是通过抑制sarA的转录,直接作用于cid操纵子,进而影响细胞自溶作用。
总之,桃柁酚可能通过调控与S.aureus自溶相关基因而影响eDNA释放,进而影响生物膜的形成。而且,桃柁酚对已形成的生物膜也具有有效的杀灭和清除作用,并且细胞毒性实验显示,4×M IC浓度的桃柁酚对细胞无毒害作用。本研究可以为S.aureus感染的治疗提供新方法,并为进一步研究桃柁酚的作用机制奠定了基础。
[1]K levens R M,Gorwitz R J,Collins A S.Methicillin-resistantStaphylococcus aureus:a primer for dentists[J].J Am Dent Assoc,2008,139(10):1328-1337.
[2]Mah T F,O'Toole G A.Mechanisms of biofilm resistance to antimicrobial agents[J].Trends Microbiol,2001,9(1):34-39.
[3]Beenken K E,Dunman P M,M cA leese F,et al.Global gene expression inStaphlococcus aureusbiofilms[J].J Bacteriol,2004,186(14):4665-4684.
[4]Haraguchi H,Ishikawa H,Kubo I.Antioxidative action of diterpenoids fromPodocarpus nagi[J].Plant Med,1997,63(3):213-215.
[5]Sm ith E C,Kaatz G W,Seo SM,et al.The phenolic diterpene totarol inhibitsmultidrug efflux pump activity inStaphylococcus aureus[J].Antim icrob Agents Chemother,2007,51(12):4480-4483.
[6]Rice K C,Mann E E,Endres J L,et al.ThecidAmurein hydrolase regulator contributes to DNA release and biofilm development inStaphylococcus aureus[J].PNAS USA,2007,104(19):8113-8118.
[7]Tetz G V,Artemenko N K,Tetz V V.Effect of DNase and Antibiotics on Biofilm Characteristics[J].Antim icrob Agents Chemother,2009,53(3):1204-1209.
[8]Cram ton S E,Ulrich M,Gotz F,et al.Anaerobic conditions induce expression of polysaccharide intercellular adhesin inStaphylococcus aureusandStaphylococcus epiderm idis[J].Infect Immun,2001,69(6):4079-4085.
[9]Knobloch J K,Horstkotte MA,Rohde H,et al.A lcoholic ingredients in skin disinfectants increase biofilm expression ofStaphylococcus epidermidis[J].JAntimicrob Chemother,2002,49(4):683-687.
[10]Rachid S,Ohlsen K,W itte W,et al.Effect of subinhibitory antibiotic concentration on polysaccharide intercellular adhesin expression in biofilm-form ingStaphylococcus epiderm idis[J].Antim icrob Agents Chemother,2000,44(12):3357-3363.
[11]Costerton JW,Stewart P S,Greenberg E P.Bacterial biofilms:a common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[12]Whitchurch C B,Tolker-Nielsen T,Ragas PC,et al.Extracellular DNA required for bacterial biofilm formation[J].Science,2002,295(5559):1487.
[13]Loo C Y,Corliss D A,Ganeshkumar N.Streptococcus gordoniibiofilm formation;identification of genes that code for biofilm phenotypes[J].JBacteriol,2000,182(5):1374-1382.
[14]Molin S,Tolker-Nielsen T.Gene trasfer occurs w ith enhanced efficiency in biofilms and induces enhanced stabilisation of the biofilm structure[J].Curr Opin Biotechnol,2003,14(3):255-261.
[15]Allesen-Holm M,Barken K B,Liang Yang,et al.A characterization of DNA release inPseudomonas aeruginosacultures and biofilms[J].Mol Microbiol,2006,59(4):1114-1128.
[16]Renzoni A,Barras C,Francois P,et al.Transcriptom ic and functional analysis of an autolysis-deficient teicoplanin-resistant derivative of Methicillin-resistantStaphylococcus aureus[J].Antim icrob Agents Chemother,2006,50(9):3048-3061.
[17]Cheung A L,Zhang Gong-yi.Global regulation of virulence d eterminants inStaphylococcus aureusby the SarA protein family[J].Front Biosci,2002,7:d1825-1842.
