鲢病原嗜水气单胞菌分离鉴定及检测方法的建立
2013-08-30梁利国叶诗尧
梁利国,谢 骏*,叶诗尧,2
(1.中国水产科学研究院淡水渔业研究中心农业部淡水渔业和种质资源利用重点实验室,江苏无锡 214081;2.上海海洋大学水产与生命学院,上海 201306)
鲢(Hypophthalmichthys molitrix)又名鲢子、白鲢、水鲢、边鱼等,属鲤形目,鲤科,鲢亚科,鲢属,具有生长快及抗病力强等特点,广泛分布于亚洲东部,为我国著名的淡水养殖动物之一。近年来随着养殖规模的扩大,加之养殖环境的恶化,各种病害不断出现,给鲢养殖业造成不同程度的危害。
2011年10月江苏高邮某养殖场混养的鲢和银鲫出现死亡,病鱼主要症状为鳃丝贫血发白,鳍基处充血,解剖显示肠道充血,部分濒死鱼腹腔内有淡黄色粘稠积液。通过相关检测排除真菌及寄生虫感染。本研究利用从濒死鲢体内分离得到的优势菌株对健康鲢进行人工感染试验以确定其致病性。采用常规的细菌表型特征及生理、生化特性的测定,结合分子生物学16S rRNA和gyrB基因的系统发育学分析等方法对病原菌进行鉴定,分离菌为嗜水气单胞菌(Aeromonas hydrophila);另外,本研究针对A.hydrophila的主要毒力因子aerA基因进行检测,并建立PCR检测方法,同时对病原菌进行耐药性试验,为鲢病原多样性研究及进一步查清其发病机理、传播途径及有效的防治提供参考。
1 材料和方法
1.1 病料样品、实验动物及主要试剂 病鲢样品取自高邮某发病塘口,规格体长30 cm~35 cm,体质量1 300 g±20 g;小剂量细菌基因组提取试剂盒购自上海生工生物工程技术服务有限公司;健康鲢取自高邮某未发病养殖池,体质量100 g±5 g,暂养于实验室玻璃缸水槽中;药敏纸片及细菌生化反应管购自杭州天和微生物试剂有限公司;药敏纸片购自杭州天和微生物有限公司。
1.2 细菌的分离纯化
1.2.1 细菌的分离分别取患病鲢肝脏、腹腔积液,接种于LB琼脂培养基,28℃培养18 h进行细菌分离。选取分离的优势单菌落划线纯化培养至获得纯培养的菌株,并于LB琼脂斜面4℃保存。共获得5株纯培养菌,依次编号为GY-1~GY-5。选取GY-1株进行检测。
1.3 人工感染试验 将分离株GY-1接种于普通营养肉汤中,28℃恒温培养18 h,制成菌悬液。并分别稀释至 5×108cfu/mL、5×107cfu/mL、5×106cfu/mL、5×105cfu/mL、5×104cfu/mL。将暂养 1周的健康鲢随机分组,每稀释度菌液接种10尾鱼,每尾0.3m L;同时设立接种同剂量、同批无菌营养肉汤作为对照,试验鱼均隔离养殖于试验水族箱中。记录发病与死亡情况,并根据Reed-Muench方法[1]计算出分离菌的LD50,同时对感染发病鲢进行细菌再分离培养,以引起试验鲢发病死亡并能重新分离到原感染菌作为分离菌致病性的判定标准。
1.4 细菌形态特征观察和理化特性检查 取纯培养菌GY-1进行革兰氏染色镜检,同时将供试菌株接种于TSA、R.S、血平板及TCBS等琼脂培养基中,置28℃培养24 h观察生长情况。将供试菌株接种于细菌理化特性反应管中,进行细菌各项生理生化指标的测定。
1.5 细菌的分子鉴定
1.5.1 模板的制备按照细菌基因组DNA提取试剂盒方法提取供试菌株GY-1,温和气单胞菌(Aeromonas sobria)、河流弧菌(Vibrio fluvialis)、维氏气单胞菌(Aeromonas veronii)等基因组DNA。
1.5.2 16S rRNA与gyrB基因序列的PCR扩增、测序及同源性分析16S rRNA基因PCR扩增引物分别 为 27F: 5'-AGAGTTTGATC(C/A)TGGCTCAG-3';1492r: 5'-GGTTACCTTGTTACGACTT-3'[2];gyrB基因PCR扩增引物分别为:UP1:5'-GAAGTCATCA TGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3'、UP2r:5'-AGCAGGGTACGGATGTGCGAGCCRTCNA CRTCNGCRTCNGTCAT-3'[3]。PCR反应条件为:95℃5m in;94℃ 1min、54℃ 40 s、72℃ 1min,30个循环;72℃10 Min。扩增产物由上海生工生物工程技术服务有限公司进行测序。将分离菌的16S rRNA和gyrB基因序列通过NCBI的Blast检索系统进行序列同源性分析,并使用ClusterX1.8软件与从GenBank数据库中获得的核酸序列相似性较高的菌株序列进行多序列比对,再使用MAGA4.1软件采用邻接法构建系统发育树。
1.6 分离株的种属分类鉴定 综合分离菌的形态特征、培养特性以及理化特性的测定,并结合其16S rRNA和gyrB基因序列同源性分析的结果,对分离菌进行种属的分类判定。
1.7 毒力基因检测 根据GenBank中登录的气溶素(aerA)基因设计检测引物,序列为F:5'-TCCAGC GCATTCA-3';R:5'-TCCAGCCTTCGGCAAACG-3',反应体系为20μL:灭菌双蒸水15μL,10×PCR缓冲液 2μL,1.5 mmol/L MgCl22μL,dNTP混合液0.5μL,引物各 0.2μL,5 U/μL的TaqDNA 聚合酶0.3μL,模板1.5μL。PCR反应条件为:95℃5 Min;94℃ 45 s、58℃ 1min、72℃ 1m in,30个循环;72℃10 Min;产物经1.5%琼脂糖凝胶电泳分析。
1.8 基于aerA基因的PCR检测方法的建立 将供试菌株GY-1接种到营养肉汤中过夜培养后测定其菌液浓度,10倍稀释为3×108cfu/mL~3×100cfu/mL,取各梯度菌液1 ML提取DNA作为模板进行aerA基因PCR扩增。
1.9 病原菌耐药性试验 采用常规琼脂扩散(纸片)法对经鉴定的菌株进行37种常用抗生素的耐药性检测。于28℃培养24 h后观察并记录抑菌结果,根据抑菌圈的大小判断病原菌对药物的敏感程度[4]。
2 结果
2.1 病原菌菌落和形态观察及其培养特性 分离菌为革兰氏阴性、杆状,在TSA培养基上菌落特征为:圆形、表面光滑、边缘整齐、中央隆起、不透明、灰白色,培养24 h菌落直径约2 mm;在R.S培养基上为橙黄色;在血平板上呈β溶血;TCBS培养基上不生长。在普通营养肉汤中28℃过夜培养24 h,呈均匀混浊生长,试管底有点状菌体沉淀(摇动后呈线状上升易消散)。
2.2 分离菌的致病性结果
2.2.1 对鲢的致病性健康鲢在人工感染供试菌株后,不同接种菌液梯度出现程度不一的死亡情况,而对照组鲢在实验观察期内均正常存活未出现死亡(表1)。取感染死亡的鲢进行细菌学检查,并作革兰氏染色镜检,结果显示在形态特征上与原感染菌相同,而且在死亡鲢内脏组织及血中再次分离到原感染菌,再分离的细菌经细菌学特征鉴定,其性状与原菌株一致。
2.3 病原菌生理生化特性检测 菌株GY-1生理生化特性为:氧化酶阴性、接触酶阳性;MR、VP反应阳性;发酵葡萄糖产酸产气;具有运动性;还原硝酸盐;分解赖氨酸脱羧酶、精氨酸双水解酶,利用葡萄糖、麦芽糖、甘露糖、甘露醇、枸橼酸盐、蕈糖、海藻糖等20种(糖醇苷),不利用蜜二糖、棉子糖、山梨醇、山梨糖、苦杏仁苷、鼠李糖等。
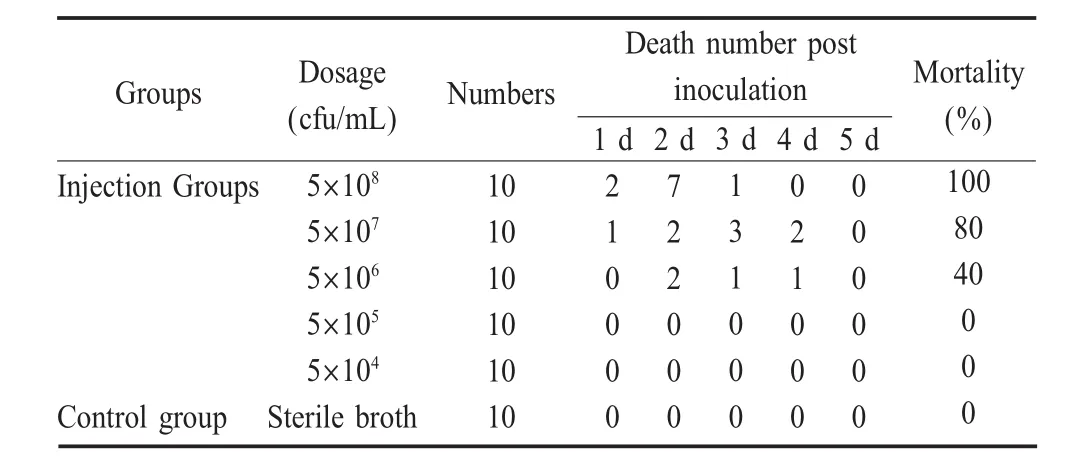
表1 GY-1菌株对健康鲢的感染试验Table 1 Pathogenic test in Hypophthalm ichthysmolitrix w ith isolate strain GY-1
2.4 16S rRNA基因同源性分析 分离菌(GY-1)所扩增的16S rRNA基因序列长度为1 460 bp,已录入GenBank中(JQ686621)。将其通过NCBI的Blastn检索系统(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性分析,结果均与气单胞菌属细菌的16S rRNA基因序列自然聚类,GY-1菌株与在检索出的嗜水气单胞菌(JN400042)聚为一支,相似性最近为99%(图 1)。

分离菌GY-1所扩增的gyrB基因序列长度为1 171 bp,登录号为(JX177432)。将分离菌的gyrB基因序列通过NCBI的Blastn检索系统分析结果均与气单胞菌属细菌的gyrB基因序列自然聚类,GY-1菌株与在检索出的A.hydrophila(GU205202)聚为一支,相似性最近为99%(图2)。
综合供试菌株的表型特征、理化特性及16S rRNA和gyrB基因序列的系统发育分析结果,判定分离菌为气单胞菌属(Aeromonas)的A.hydrophila。

图2 分离菌GY-1 gyrB基因序列发育进化树Fig.2 The phylogenetic analysis based on gyrB gene sequence of GY-1
2.5 药敏试验 采用37种抗生素对致病菌株进行耐药性试验,结果显示:分离菌GY-1对供试的氨曲南、氟苯尼考、庆大霉素等12种抗生素敏感,对萘啶酸、羧苄青霉素、四环素等10种药物敏感中介,而对青霉素G、氨苄青霉素、林克霉素等15种药物耐药(表2)。
2.6aerA基因检测结果 PCR扩增结果显示(图3),本研究分离株GY-1可扩增出一条大小约280 bp的条带,表明分离菌具有aerA毒力因子。其他3种水产动物病原菌未检测到相应毒力基因。
2.7 灵敏性检测结果 对PCR体系进行灵敏性检测,结果表明:在20μL反应体系中,模板DNA 2μL,菌体菌落数自 3×106cfu/mL~3×108cfu/mL均可扩增出清晰条带,菌体菌落数为3×104cfu/mL~3×105cfu/mL扩增条带较暗,而菌落数为3×100cfu/mL~3×103cfu/mL未扩增出条带,表明本实验建立的PCR方法检测A.hydrophlia菌体灵敏度为3×104cfu/mL(图 4)。
3 讨 论
A.hydrophlia普遍存在于自然环境中,为人兽条件性致病菌,并能够引起多种淡水鱼类的发病和死亡[4-11]。近年来江苏高邮地区水产养殖不断遭受各种病害的冲击,病因复杂多样,其中病原微生物引起的疾病占主导,给广大养殖户造成了严重的经济损失。本研究对发生于江苏高邮地区某异育银鲫养殖场混养的濒死鲢进行病原学研究,从濒死鲢腹腔积液、肝脏等组织分离到大量优势细菌,经细菌学鉴定分离菌为同一种细菌。致病性试验表明供试代表菌株在菌液为108和107两个梯度时对健康鲢具有较强的致病性,而且从被感染死亡的鲢体内可回收分离到单一的原感染菌,由此可表明分离菌为鲢的致病菌。结合常规的细菌学及16S rRNA和gyrB基因序列分析,鉴定本次分离细菌为气单胞菌属的A.hydrophlia。同时也进一步表明了A.hydrophlia对水产养殖动物的广泛致病作用。通过本次较系统地对病原A.hydrophlia的鉴定,丰富了该菌在形态特征、理化特性等表型生物学及16S rRNA和gyrB基因序列与系统发育学发面的内容,为该菌的有效检验提供了参考依据。

表2 分离菌株GY-1的药敏试验结果(抑菌圈mm)Table 2 Drug Sensitivity Test of the isolate GY-1(inhibition zone diameter:mm)

图3 aerA基因的扩增Fig.3 aerA gene amplified by PCR

图4 嗜水气单胞菌PCR敏感性检测结果Fig.4 Sensitivity of the PCR for detection of A.hydrophlia dilution
药物敏感性试验检测结果显示,A.hydrophlia对氨曲南、氟苯尼考、链霉素、复方新诺明等15种常用抗生素敏感,该结果与张晓君等报道基本相一致,而对青霉素G、氨苄西林、苯唑西林等9种抗生素耐药[12]。在实际选用抗生素时应结合耐药性试验结果,有针对性的筛选适合的药物来治疗由A.hydrophlia引发的鲢鱼出血病,避免滥用、乱用渔药而导致耐药性等副作用的发生,同时还应考虑到养殖动物对抗生素的耐受能力,合理的安排用药量以达到高效、低残留的目的。
近年来分子生物学技术发展迅速,PCR技术凭借其特异性强、灵敏度高、操作方便快捷等诸多优势已应用于病原微生物的检测中,因此本研究针对A.hydrophlia毒力因子aerA设计一组引物对分离菌进行aerA基因片段的检测,得到280 bp的阳性扩增片段,而同时使用该引物检测的河流弧菌、温和气单胞菌均未扩增出条带,表明该引物特异性良好;灵敏度检测结果显示,对A.hydrophlia菌液检出极限为3×104cfu/mL,该方法能满足实践中养殖水体及鱼体内病原A.hydrophlia检测的要求。
[1]Reed L J,Muench H.A simple method of estimating fifty percent end points[J].Am JHygiene,1938,27:493-497.
[2]Martin F P,Collen MC.Bias in template to product ratios in multitemplate PCR[J].Appl Environ Microbiol,1998,64(10):3724-3730.
[3]Yamamoto S,Harayama S.PCR amplification and direct sequencing of gyrB genes w ith universal primers and their application to the detection and taxomonic analysis ofPseudomonas putidastrains[J].Appl Environ Microbiol,1995,61(3):1104-1109.
[4]刘堂水,汪成竹,陈昌福.斑点叉尾鮰细菌性病原的分离与鉴定[J].华中农业大学学报,2006,25(5):550-554.
[5]阿哈提,黄嘉驷,苏艳,等.鲢暴发性疾病的病原分离与鉴定[J].中国兽医科技,2002,32(5):39.
[6]孟彦,肖汉兵,张林,等.施氏鲟出血性败血症病原菌的分离和鉴定[J].华中农业大学学报,2007,26(6):822-826.
[7]秦国民,张晓君,陈翠珍,等.鲤嗜水气单胞菌感染症及其病原生物学特性[J].水生态学杂志,2008,1(2):53-57.
[8]沈锦玉,尹文林,钱冬,等.中华绒螯蟹“腹水病”及“抖抖病”并发病病原的研究[J].中国水产科学,2000,7(3):89-92.
[9]文祝友,刘晓燕,金燮理,等.三角帆蚌嗜水气单胞菌病的病理研究[J].湖南农业大学学报,2001,27(1):56-59.
[10]张林,艾晓辉,袁科平,等.中华鳖嗜水气单胞菌的生物学特性[J].河南科技大学学报,2009,30(6):75-78.
[11]周飞,刘娟,黎德兵.黄鳝嗜水气单胞菌的分离鉴定及中药体外抑菌效果研究[J].中国畜牧兽医,2010,37(2):135-137.
[12]张晓君,陈翠珍,房海,等.鲢鱼白皮病致病菌特性研究[J].河北农业技术师范学院学报,1998,12(3):40-44.
