海南罗非鱼无乳链球菌血清型及耐药性研究
2013-08-30霍欢欢可小丽卢迈新李庆勇高风英朱华平黄樟翰
霍欢欢,可小丽,卢迈新*,李庆勇,高风英,朱华平,黄樟翰
(1.中国水产科学研究院珠江水产研究所农业部热带亚热带水产资源利用与养殖重点实验室,广东广州 510380;2.上海海洋大学水产与生命学院,上海 201306)
近年来,链球菌病(Streptococcosis)的大范围流行,对我国罗非鱼的健康养殖造成了严重威胁[1]。2009年广东、海南、福建和广西地区养殖罗非鱼的链球病发病率为20%~50%,死亡率达50%~70%[2]。2010年本实验室通过研究鉴定,确定引发南方罗非鱼主产区爆发大规模流行病的病原为无乳链球菌(S.agalactiae)[3]。无乳链球菌血清型较多,目前已经鉴定出10种不同的荚膜类型(Ⅰa、Ⅰb、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅸ)[4]。由于无乳链球菌存在不同的血清型以及耐药因子,化学药物对无乳链球菌防控效果在不同地区存在差异。
本研究对2010年~2011年海南省不同时间不同地区分离到的24株罗非鱼无乳链球菌,进行血清分型和药敏检测,并初步明确两者之间是否有关联性,为罗非鱼无乳链球菌耐药性监测、血清分型及综合防控提供了实验依据。
1 材料和方法
1.1 病鱼的采集及病原菌的分离纯化 2010年7株菌和2011年17株菌均采自海南省不同的罗非鱼养殖场,患病鱼的主要症状与卢迈新等[2]描述的相似。选取发病或濒死罗非鱼鱼体,无菌条件下将其脑、眼、肝、肾等组织划线于血平板培养基上,28℃培养24 h~48 h,常规方法分离、纯化,纯化后的菌株保存于-80℃;标准无乳链球菌(CVCC1887)购自中国兽医药品监察所。
1.2 病原菌形态和生理生化鉴定 将纯化的细菌分离株进行革兰染色鉴定。并参照无乳链球菌常规的鉴定方法和指标[3]以及采用法国Biomerieux公司的Rapid ID 32 Strep鉴定系统进行鉴定,同时测定其最适生长温度和pH值。
1.3 基于16S rRNA基因的分子鉴定 根据文献[5]合成1对细菌16S rRNA通用引物,27F:5'-AGA GTTTGATCCTGGCTCAG-3'和 1492R:5'-TACGGCT ACCTTGTTACGACTT-3',引物由上海生工生物工程技术服务有限公司合成。PCR反应条件为:94℃5 Min;94℃ 1 min、53℃ 1 min、72℃ 1 min,31个循环;72℃5 min。产物经1.0%的琼脂糖凝胶电泳检测,16S rRNA基因预期扩增片段约1 500 bp。回收扩增片段克隆于pMD19-T中,由上海英潍捷基贸易有限公司进行测序。采用Vector NTI suite 8.0软件和BLAST程序进行序列同源性分析。
1.4 血清分型鉴定 荚膜多糖抗原基因簇的引物cpsES1(F)、 cpsGA1(R)和 Ⅰ acpsHS1(F)、 Ⅲ cpsHS(R)、cpsIa(R)根据Ye等[6]设计,由上海生工生物科技公司合成。40μL反应体系内含有10×PCR buffer 4.0μL,dNTP 0.8μL(每份 2.5mM),引物各 0.8 μL(20μM),1.0μL DNA模板,TaqDNA聚合酶0.5μL(5.0 U/μL),以 ddH2O 补加反应体积至 40μL。回收扩增片段经克隆后由上海英潍捷基贸易有限公司进行测序。所有产物克隆测序后都经过DNA Vector NIT Suit 8.0和BLAST程序进行序列同源性分析。
1.5 药敏试验 用BHI液体培养基28℃培养纯化后的病原菌24 h,用电子比浊仪(M 007230)测定并用PBS缓冲液稀释菌液浓度到0.5个麦氏浓度,取150μL以涂布法均匀的涂于血琼脂平板上(直径:90 mm),稍晾干,贴药敏纸片(直径6 mm),28℃培养24 h后用电子游标卡尺(SF2000)测抑菌圈直径,按产品说明书判定各菌株对药物的敏感度。药敏纸片购自杭州天和微生物试剂有限公司。
2 结果
2.1 菌株形态和生理生化鉴定 患病鱼各组织分离的菌落比较均一,菌落形态、颜色及大小相近。纯化的菌株血平板培养结果显示,各菌株均为白色圆形小菌落、表面润滑、微隆起、边缘整齐,并呈现α或β溶血环。革兰染色阳性,菌体为球形或卵形,直径0.5μm~2.0μm,菌体多为短链状。在相同培养条件下,不同菌株均表现为pH6.5时和37℃时达到最佳生长丰度(图1,图2)。各分离菌株与无乳链球菌标准株的生理生化特性相似性很高,并且分离的24株病原菌大部分生化反应项目结果相同,仅在焦谷氨酸芳胺酶、丙氨酸苯丙氨酸脯氨酸芳胺酶和β-半乳糖苷酶这3个生理生化指标上存在差异。除马尿酸盐、精氨酸双水解酶、碱性磷酸酶、VP试验、d-海藻糖、β葡萄糖醛酸酶和d-麦芽糖为阳性外,其余均为阴性。Rapid ID32 Strep鉴定结果显示所分离的24个菌株均为无乳链球菌。
2.2 16S rRNA基因鉴定 采用16S rRNA引物进行PCR扩增,所有菌株均可得到约1 500 bp的片段,与预期扩增片段(1 471 bp)相符(图3)。测序结果显示,24个分离菌株之间以及与GenBank中已登录的无乳链球菌(GU217531、JQ990156等)的 16S rRNA基因同源性均为99.9%~100%。其中有3株分离菌为G517A差异,另有4个分离株菌为C1011T差异。因此,进一步确定了分离的24株菌均为无乳链球菌。
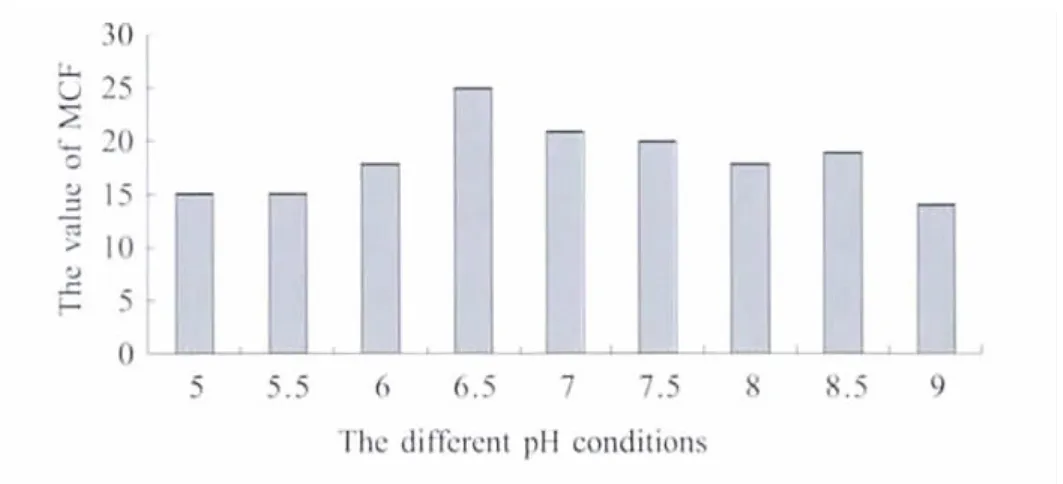
图1 不同pH值下的生长情况Fig.1 The growth situation in different pH
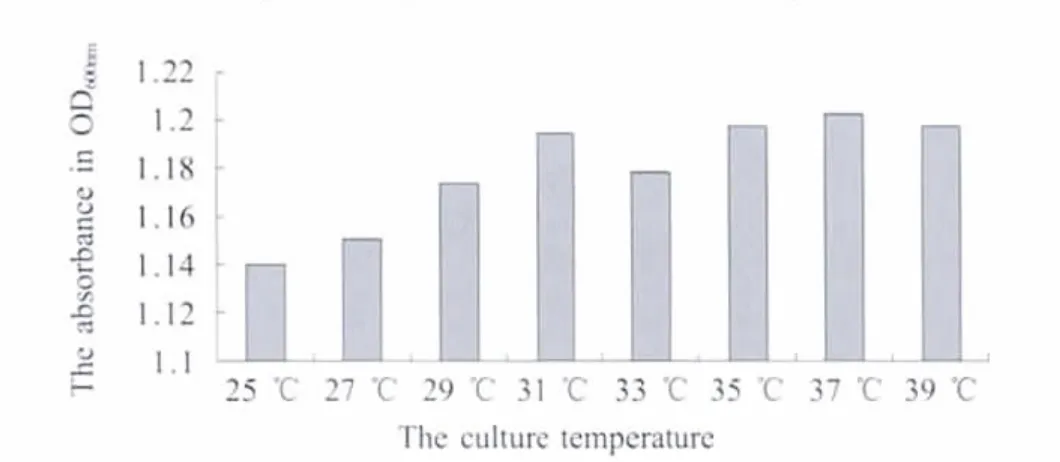
图2 不同温度下的生长情况Fig.2 The growth situation in different temperature

图3 16S rRNA基因的PCR扩增Fig.3 PCR amplification of 16S rRNA gene
2.3 血清型鉴定 采用引物cpsES1和cpsGA1扩增24株分离菌的cpsE-G基因,均可以得到818 bp产物(图4A)。将得到的24条序列分别进行BLAST比对,结果表明与GenBank中登录的无乳链球菌(GU217534.1、AF332894.1等)cps基因的同源性为99.6%~100%。将24条序列与无乳链球菌(AF332908)序列比对,所有的分离菌株均出现T1413C和A1527T,按照Ye等无乳链球菌的血清型分类标准[6],所有的分离菌株的血清型属于Ⅰa或Ⅲ-3。
通过扩增cps基因簇的cpsH-I基因可以将血清型Ⅰa和Ⅲ分开。引物ⅠacpsHS1和cpsIa只能在Ⅰa血清型菌中扩增出来条带,而引物ⅠacpsHS1和ⅢcpsHS扩增条带为Ⅲ血清型特异扩增(图4B)。本实验通过PCR扩增显示,所有菌株均可以用引物ⅠacpsHS1和cpsIA扩增出条带,而引物ⅠacpsHS1和ⅢcpsHS没有扩增出条带,表明分离菌株的血清型均应为Ⅰa型。所有分离菌株用引物ⅠacpsHS1和cpsIa扩增出354 bp产物(图4B)与GenBank中Ⅰa血清型无乳链球菌(CP000114.1,AF332914等)对应序列同源性为99.9%~100%,因此24株分离株的血清型应为Ⅰa型。

图4 荚膜多糖基因扩增图Fig.4 Capsular polysaccharide gene for serotype identification
2.4 药敏试验结果 2010年和2011年无乳链球菌菌株对31种常见抗生素的药敏试验结果显示:分离菌株对大环内酯类乙酰螺旋霉素和罗红霉素均不敏感,两者耐药比率在2010年均达到86%,到2011年耐药性则分别增至100%和96%。对于同类别的麦迪霉素,两年份菌株敏感和耐药菌株比例相当(表1),但总体而言敏感菌株两年期间下降(43%~23%),而耐药菌株增多(43%~47%)。
对于β-内酰胺类头孢曲松、头孢噻吩、苯唑青霉素、青霉素和氨苄青霉素,2010年菌株耐药比率分别为0、43%、28%、28%和28%,2011年菌株的耐药比率分别为94%、71%、100%、52%和71%,耐药率明显有增加的趋势。然而对于头孢唑林和阿莫西林耐药率反而有所降低(28%~12%,43%~0)。对于其他β-内酰胺类抗生素,两年份菌株具有相似的耐药谱。
对于环素类米诺四环素、四环素和强力霉素,菌株敏感率降低(72%~42%、28%~0、100%~82%)。分离菌株对强力霉素最为敏感,仅2011年菌株中有1株对强力霉素表现为耐药,其他的菌株均表现为敏感或中度敏感。对于喹诺酮类,两年份菌株除对氧氟沙星敏感率相对较高外(分别为72%和59%),对其他喹诺酮类抗生素敏感率都很低。对诺氟沙星、恩诺沙星、萘啶酮酸、美洛沙星、依诺沙星和氟罗沙星,2010年菌株敏感率低于44%,2011年菌株敏感率更是低于20%。对于氨基糖苷类抗生素,两年份菌株耐药率均较高,2010年菌株耐药率在72%~86%之间,2011年菌株耐药率高达82%~100%。对于万古霉素和林可霉素,基本上完全耐药,仅2010年1株菌对林可霉素中度敏感,2011年1株菌对万古霉素敏感,其余菌株均表现为耐药(表 1)。
3 讨 论
本研究对2010年和2011年海南省罗非鱼主养区爆发病进行了跟踪调查分析,从发病罗非鱼中分离到24株病原菌,经鉴定均为无乳链球菌。这表明影响我国海南罗非鱼养殖的主要为无乳链球菌。对于鱼源无乳链球菌血清型,已报道的大多为Ⅰa和Ⅲ(Ⅲ-4)型,只有一例Ⅰb型[7]。在泰国,通过基于多重PCR的线性杂交分析(mPCR/RLB)在罗非鱼上分离到血清型Ⅰa和Ⅲ(Ⅲ-4)的无乳链球菌[8]。Bachrach等从实验结果中得出一种假设,认为当使用一种疫苗防制病原菌时,疫苗诱导产生的选择性压力导致另一种血清型菌株取代原来的血清型菌株,从而逃避由疫苗产生的保护反应[9]。因此,确定无乳链球菌血清型将有助于疫苗的研制。本研究对海南省罗非鱼产区2010年和2011年患病罗非鱼分离菌株进行血清型鉴定,显示分离到的菌株均为Ⅰa型,这与Ye等和郭玉娟等对罗非鱼无乳链球菌血清型鉴定结果相一致[6,10]。表明我国不同年份采集的鱼源无乳链球菌未发生遗传变异。
在实际生产上主要是使用抗生素来进行预防和治疗链球菌病,然而实验表明罗非鱼无乳链球菌对多种抗生素不敏感,并且耐药性有逐年增加的趋势。本研究中罗非鱼无乳链球菌主要对氨基糖苷类和喹诺酮类敏感性不高,对头孢唑啉和强力霉素较为敏感,对其他抗生素敏感性不同的菌株存在一定的差异。与其他文献[5,11-12]中罗非鱼无乳链球菌的耐药谱相比,壮观霉素、洛美沙星、乙酰螺旋霉素和青霉素等多种抗生素都有耐药性增加的趋势。
董一山等对肺炎链球菌的研究表明,优势血清型菌株对青霉素的耐药率明显高于其他血清型[13]。本研究通过对比分析血清型及耐药变化表明,海南罗非鱼源无乳链球菌的血清型均为Ⅰa型,但同一血清型抗菌谱具有较大差异,而且耐药菌株呈逐年增加的趋势。这表明罗非鱼无乳链球菌血清型与耐药性之间无直接相关性。为加强无乳链球菌病防治技术研究,避免大面积出现多重耐药菌株,降低我国罗非鱼养殖风险,亟待开展无乳链球菌的耐药基因、中草药的抑菌作用以及疫苗候选株筛选等研究工作,为罗非鱼链球菌病害防控奠定基础。
[1]柴家前,丁巧玲,王振龙,等.罗非鱼链球菌的分离鉴定[J].中国预防兽医学报,2002,24(1):18-20.
[2]卢迈新.罗非鱼链球菌病研究进展[J].南方水产,2010,6(1):75-78.
[3]卢迈新,黎炯,叶星,等.广东与海南养殖罗非鱼无乳链球菌的分离、鉴定与特性分析[J].微生物学通报,2010,37(5):766-774.
[4]汪开毓,付希,肖丹,等.罗非鱼源无乳链球菌cps E基因的克隆和分子特性分析[J].水产学报,2011,35(5):660-666.
[5]可小丽,卢迈新,黎炯,等.罗非鱼绿色气球菌的鉴定及致病性研究[J].水生生物学报,2011,35(5):796-802.
[6]Ye xing,Li jiong,Lu Mai-xin,et al.Identification and molecular typing ofStreptococcus agalactiaeisolated from pond-cultured tilapia in China[J].Fish Sci,2011,77(4):623-632.
[7]Vandamme P,Devriese L A,Pot B,et al.Streptococcus difficileis a nonhemolytic group B,type IbStreptococcus[J].Int JSyst Bacteriol,1997,47(1):81-85.
[8]Suanyuk N,Kong F,Ko D,et al.Occurrence of rare genotypes ofStreptococcus agalactiaein cultured red tilapiaOreochrom issp.and Nile tilapiaO.niloticusin Thailand-relationship to human isolates[J].Aquaculture,2008,284:35-40.
[9]Bachrach G,Zlotkin A,Hurvitz A,et al.Recovery ofStreptococcus iniaefrom diseased fish previously vaccinated w ith astreptococcusvaccine[J].Appl Envir Microbiol,2001,67(8):3756-3758.
[10]郭玉娟,张德峰,樊海平,等.中国南方地区罗非鱼无乳链球菌的分子流行病学研究[J].水产学报,2012,36(3):399-408.
[11]柯剑,赵飞,罗理,等.广东省罗非鱼主养区无乳链球菌的分离、鉴定与致病性[J].广东海洋大学报,2010,30(3):22-27.
[12]谭晶晶,陈昌福,高宇,等.奥尼罗非鱼无乳链球菌的鉴定、致病性及药物敏感性研究[J].华中农业大学学报,2010,29(6):745-751.
[13]董一山,黄文祥,章成,等.重庆地区临床分离肺炎链球菌血清型及耐药分析基因多态性[J].中国抗生素杂志,2010,35(1):59-64.
