犬干扰素-γ的可溶表达及其产物的活性鉴定
2013-08-30郝志超王文飞赵景壮吴云舟叶贤龙任桂萍李德山
韩 阳,郝志超,王 琪,王文飞,赵景壮,郭 茉,吴云舟,叶贤龙,任桂萍,李德山
(东北农业大学生命科学学院生物制药教研室,黑龙江哈尔滨 150030)
犬细胞因子特别是干扰素(IFN)的抗病毒和免疫调节活性等作用在犬病治疗中引起广泛关注。DevosK等克隆了犬 IFN-γ(CaIFN-γ)基因[1],杨琪等克隆了CaIFN-γcDNA,并用pRC/CMV2表达载体在鼠骨髓瘤细胞中进行表达[2],但真核表达产量很低,陈忠广等探索了以包涵体形式表达的CaIFN-γ蛋白的稀释复性的条件[3],但包涵体需经过重新折叠复性才能够获得其原有的生物活性,这使犬CaIFN-γ不能大量地应用于临床试验,所以获得高产量并且具有活性的CaIFN-γ蛋白是目前急需解决的关键问题。本实验利用SUMO(Small ubiquitin-like modifier-1)表达系统高效表达了可溶性的CaIFN-γ蛋白,SUMO可以作为分子伴侣来增加外源蛋白的稳定性和可溶性,其作用机理可能是SUMO蛋白作为一个高度疏水的核心,为目的蛋白的折叠提供成核位点,促进蛋白间的相互作用并使其正确折叠,最终增强了融合蛋白的可溶性[4]。本研究通过引入伴侣分子SUMO,实现CaIFN-γ蛋白的可溶性表达,并获得具有高生物学活性的IFN-γ蛋白,从而解决IFN-γ包涵体蛋白复性效率低,并且生物学活性差的问题。
1 材料和方法
1.1 载体、细胞株及菌株 pMD18-T载体购自TaKaRa公司;pSUMO expression质粒由本实验室保存;犬肾(Madin-Darby canine kidney,MDCK)细胞由东北农业大学动物传染病教研室提供;E.coliDH5α、E.coliRosetta(DE3)pLysS由本实验室保存。
1.2 主要试剂 TRIzol试剂购自Invitrogen公司;M-MuLV反转录酶购自Promega公司;蛋白分子质量标准购自Fermentas公司;T4 DNA连接酶、限制性内切酶购自NEB公司;SUMO ProteaseⅠ由本实验室表达纯化;Real time PCR试剂盒购自TaKaRa公司。
1.3 引物设计与合成 根据GenBank中登录的CaIFN-γ (NM_001003174.1)设计引物。
CaIFN-γ-f: 5'-GGTCTCAAGGTCAGGCCATGT TTTTTAAAGAAATAG-3'(BsaⅠ ); CaIFN-γ-r: 5'-C GCGGATCCTTATTTCGATGCTCTGCGGCCTCGAA ACAGAT-3'(BamHⅠ)
P53-f: 5'-TTGCCAGCTGGCGAAGACCTG-3';P53-r:5'-ACCTCGGGTGGCTCATAAGGCA-3'
GAPDH-f:5'-TGCCGCCTGGAGAAAGCTGC-3';GAPDH-r:5'-TCCCAGGAAATGAGCTTGAC-3'
1.4 目的基因的克隆与序列测定 取人工感染犬瘟热病毒(CDV)的成年犬脾脏,采用淋巴细胞分离液分离白细胞,提取其总RNA。以其为模板,Oligo(dT)18为引物,反转录合成cDNA。以cDNA为模板,PCR扩增CaIFN-γ基因。PCR产物经琼脂糖凝胶电检测。采用凝胶回收试剂盒回收并纯化目的DNA,连入pMD18-T载体中构建重组质粒pMDCaIFN-γ,并由上海英骏生物技术有限公司进行序列测定。采用凝胶回收试剂盒回收并纯化目的DNA,连入pSUMO载体中构建重组表达质粒pSUMOCaIFN-γ。
1.5 目的基因的诱导表达 将pSUMO-CaIFN-γ转化Rosetta(DE3)pLysS感受态细胞,37℃培养至OD600nm达0.3~0.4时,加IPTG至终浓度为0.25mmol/L诱导目的蛋白的表达。将不同诱导时间的诱导菌经超声仪破碎菌体,分离上清及沉淀,分别进行SDSPAGE分析表达蛋白的可溶性。
1.6 重组蛋白的纯化 诱导表达后的菌体离心后用裂解缓冲液悬浮,超声裂解离心,将上清液通过0.45μm滤膜过滤后,按AKTA purifier 100-纯化系统操作说明书的方法纯化融合蛋白,加入SUMO ProteaseI和终浓度为2 mmol/L的DTT,4℃过夜消化,切除SUMO融合标签。酶切产物再通过His TrapTMFF crude column亲和层析柱分离纯化,收集紫外吸收峰处的流穿液,即为成熟蛋白并进行SDS-PAGE检测。
1.7 Ca IFN-γ蛋白对MDCK细胞生长的抑制试验将纯化后的CaIFN-γ(0.1 mg/mL)蛋白按1∶5倍比稀释后加入于96孔细胞培养板经24 h培养的MDCK单层细胞各孔中,共设5个梯度,每个浓度梯度设5个复孔,设空白对照(不加CaIFN-γ蛋白)及阴性对照(加入CaIFN-γ蛋白缓冲液)。于37℃、5%CO2条件下培养48 h、72 h后,每孔加20μL MTT(5 mg/L),继续培养4 h后弃去培养液,向每孔加入150μL二甲基亚砜(DMSO),振荡10 Min,酶标仪检测OD490nm值,以系统空白组(只加DMSO组)的平均值调零,按以下公式计算抑制率:
细胞生长抑制率(%)=(1-实验组平均OD值/对照组平均OD值)×100%
1.8 实时荧光定量PCR检测内源p53的表达 将处于对数生长期的MDCK犬肾细胞,1×106/mL接种于六孔板,用纯化后的CaIFN-γ蛋白进行刺激,分别将蛋白(0.1 mg/mL)进行10倍、100倍、1 000倍稀释,刺激4 h,real time PCR检测CaIFN-γ刺激下,p53表达情况;同时将CaIFN-γ蛋白100倍稀释后,与MDCK细胞分别作用2 h、4 h、6 h,检测p53表达情况。以GAPDH作为内参,以未加CaIFN-γ蛋白刺激的空白细胞作为对照。
1.9 统计学分析 用SPSS 10.0统计学软件分析所得到的数据进行样本的t检验。
2 结 果
2.1 Ca IFN-γ基因扩增及序列分析 CaIFN-γ基因PCR产物经1.5%琼脂糖凝胶电泳分析,在约400 bp处可见特异性DNA片段,大小与预期相符(图1)。测序结果与GenBank中登录的CaIFN-γ基因序列的同源性达100%。pSUMO-CaIFN-γ经PCR及双酶切鉴定,产物经1.5%琼脂糖凝胶电泳分析,在约400 bp处均可见特异性DNA片段,大小与预期相符(432 bp)。

图1 PCR扩增CaIFN-γ基因Fig.1 Amplification of CaIFN-γgene by PCR
2.2 重组成熟Ca IFN-γ蛋白的制备 采用SUMO系统表达SUMO-CaIFN-γ融合蛋白,将表达蛋白进行SDS-PAGE分析,并且取不同诱导时间的诱导菌进行SDS-PAGE分析。灰度分析结果显示,上清中CaIFN-γ蛋白总量占菌体蛋白总量的70%,目的蛋白为可溶性表达(图2),诱导后6 h,目的蛋白表达量达到高峰。利用SUMO系统表达外源蛋白时,融合蛋白N端含有6×His标签,可以利用Ni-NTA层析柱进行纯化。表达菌破碎后取上清经亲和层析得到唯一的洗脱峰即为SUMO-CaIFN-γ融合蛋白。融合蛋白经SUMO ProteaseⅠ酶切纯化后获得成熟CaIFN-γ 蛋白(图 3)。

图2 CaIFN-γ在SUMO表达系统中表达蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of SUMO-CaIFN-γfusion protein expression in E.coli
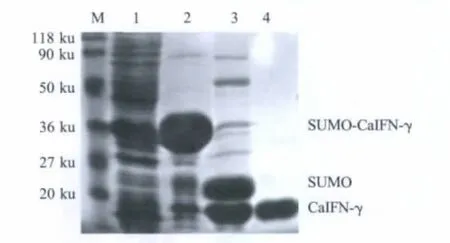
图3 CaIFN-γ纯化蛋白SDS-PAGE结果Fig.3 SDS-PAGE analysis of the purified CaIFN-γ
2.3 重组Ca IFN-γ蛋白对MDCK增殖的抑制作用将纯化后的重组CaIFN-γ蛋白按1∶5倍比稀释后加入各孔。测定吸光度并计算细胞生长抑制率,以各孔所加CaIFN-γ蛋白浓度为横坐标,以细胞生长抑制率为纵坐标作图。结果显示,与蛋白缓冲液对照组相比纯化后的重组CaIFN-γ对MDCK细胞生长存在明显的抑制作用(p<0.05),随着CaIFN-γ浓度增加,对MDCK细胞抑制率逐渐增加,当蛋白浓度为6 250 ng/mL时,达到最大抑制率72%,并且72 h后的抑制率明显大于48 h(p<0.05)(图4)。
2.4 Ca IFN-γ上调MDCK细胞p53 mRNA转录水平 在CaIFN-γ蛋白的刺激下,MDCK内源的p53的表达水平在4 h达到最高并且是对照组的399倍(图5);并且随着IFN-γ剂量的不断增加,p53的mRNA水平也具有逐渐增加的趋势,呈剂量依赖性关系,差异显著(p<0.05)(图6)。

图4 CaIFN-γ对MDCK细胞增殖的抑制作用Fig.4 The inhibition of proliferation of MDCK cells by CaIFN-γ

图5 CaIFN-γ刺激p53表达的时间依赖性Fig.5 Time-dependent expression of p53 in MDCK cells after stimulation with CaIFN-γ
3 讨 论
原核系统表达的INF多以包涵体形成存在,需要通过变性复性后才能恢复其生物活性。虽然陈忠广等建立较好的CaIFN-γ蛋白包涵体复性方法,但包涵体复性终究是一个费时、费力的过程,而且容易使溶解后的蛋白质失去某些生物功能或全部失活,影响对CaIFN-γ的进一步研究及应用。因此,采用一个合适的原核表达系统对提高CaIFN-γ的可溶性表达尤为重要。本研究可溶性表达目的蛋白,获得具有生物活性的CaIFN-γ。近年来,研究表明SUMO可以作为重组蛋白表达的融合标签和分子伴侣,具有抗蛋白酶水解、显著增加重组蛋白表达量以及促进靶蛋白正确折叠、提高可溶性等功能[5]。本研究采用SUMO可溶系统高效稳定的表达了可溶的CaIFN-γ蛋白,IPTG诱导后收集菌体,破碎后SDS-PAGE分析蛋白表达量,上清中蛋白含量占菌体蛋白总量的70%,这与以往利用其它表达载体表达CaIFN-γ相比,大大提高了蛋白的可溶性表达,为CaIFN-γ的研究及大规模发酵生产奠定了基础。

图6 CaIFN-γ刺激p53表达剂量依赖性Fig.6 Dose-dependent expression of p53 in MDCK cells after stimulation with CaIFN-γ
IFN对肿瘤细胞和正常细胞的分裂均有明显的抑制作用[6-7]。如IFN-α抑制碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)诱导的内皮细胞增殖,而IFN-α和IFN-γ均可以直接抑制人表皮微血管内皮细胞和人毛细血管内皮细胞的增殖[8]。因此,我们采用MTT方法以不同浓度,不同作用时间检测INF-γ对永生化的细胞MDCK的增殖抑制作用,结果表明CaIFN-γ蛋白显著抑制该细胞的增殖。
Moiseeva等人研究表明IFN-β作用于人的成纤维细胞,可以通过DNA损伤和激活p53信号通路来诱导细胞衰老[9],Akinori等人研究表明,IFN-α作用于鼠胚胎成纤维细胞,IFN诱导生成的ISGF3可以与p53的ISRE结合,诱导p53上调表达,并且p53的表达量与时间和剂量呈依赖性关系[10]。Kim等人研究表明IFN-γ通过p53信号通路在诱导细胞衰老过程中起重要作用[11]。以上研究表明p53信号通路在IFN抑制细胞增殖并引起细胞衰老的过程中起重要作用。本文采用CaIFN-γ蛋白刺激MDCK细胞,结果表明MDCK细胞所表达的p53水平与INF-γ呈剂量依赖性,并且差异显著,表明采用SUMO原核表达系统获得的INF-γ具有生物活性。
综上所述,本研究采用SUMO表达系统,高效稳定的表达了可溶性的CaIFN-γ蛋白,解决了包涵体变性复性影响蛋白活性和减少蛋白产量的瓶颈问题。通过MTT法检测CaIFN-γ蛋白对MDCK细胞增殖的抑制作用,并通过real-time PCR检测CaIFN-γ蛋白刺激后MDCK细胞内源p53 mRNA表达量上调来鉴定CaIFN-γ的生物活性,建立了安全、快速、灵敏的INF活性检测平台,为高表达具有高活性的犬INF-γ,发掘其药物价值和临床价值奠定基础。
[1]Devos K,Duerinck F,Van Audenhove K et al.Cloning and expression of the canine interferon-gamma gene[J].J Interferon Res,1992,12(2):95-102.
[2]杨琪,夏春,赵德明,等.犬干扰素-γcDNA的克隆及其在鼠骨髓瘤细胞(SP2/0)中表达[J].生物工程学报,2002,(3):365-368.
[3]陈忠广,张桂红,夏春丽,等.犬干扰素-γ的稀释复性及活力测定[J].东北农业大学学报,2008,39(9):82-86.
[4]姜媛媛,刘铭瑶,任桂萍,等.高效可溶性重组蛋白表达载体的构建[J].生物工程学报,2010,25;26(1):121-129.
[5]曲栗,尹杰超,李宁,等.利用SUMO表达系统高效可溶性表达鸡传染性法氏囊病病毒VP3基因[J].中国预防兽医学报,2011,33(3):199-202.
[6]Jiang Hong-ping,Lin Jiao-jiao,Tao Jing,et al.Suppression of human ribosomal protein L23A expression during cell growth inhibition by interferon-beta[J].Oncogene,1997,14:473-480.
[7]Lengyel P.Tumor-suppressor genes:news about the interferon connection[J].Proc Natl Acad Sci USA,1993,90:5893-5895.
[8]Izawa J I,Sweeney P,Perrotte P,et al.Inhibition of tumorigenicity and metastasis of human bladder cancer grow ing in athym ic Mice by interferon-beta gene therapy results partially from various antiangiogenic effects including endothelial cell apoptosis[J].Clin Cancer Res,2002,8:1258-1270.
[9]Moiseeva O,Mallette F A,Mukhopadhyay U K,et al.DNA damage signaling and p53-dependent senescence after prolonged beta interferon stimulation[J].Mol Biol Cell,2006,17:1583-1592.
[10]Takaoka A,Hayakawa S,Yanai H,et al.Integration of interferon alpha/beta signaling to p53 responses in tumor suppression and antiviral defence[J].Nature,2003,424:516-523.
[11]KimK S,Kang K W,Seu Y B,et al.Interferon-gamma induces cellular senescence through p53-dependent DNA damage signaling in human endothelial cells[J].Mech Ageing Dev,2009,130(3):179-188.
