ALV-J gp85重组蛋白与免疫佐剂联合接种雏鸡诱导免疫保护的研究
2013-08-30窦文文李宏梅成子强刘建柱刘海港井维芳崔治中郭慧君
窦文文,李宏梅,成子强,刘建柱,刘海港,井维芳,崔治中,郭慧君
(山东农业大学动物科技学院山东省生物工程与疫病防治重点实验室,山东泰安 271018)
J亚群禽白血病病毒(Subgroup J avian leukosis virus,ALV-J)是上个世纪90年代从肉鸡中鉴定的一种新亚型白血病病毒,它引起骨髓细胞瘤病。中国首次在1999年从白羽肉鸡中分离到ALV-J[1],近年来,ALV-J已传播到中国不同地区的某地方品系鸡[2-4]及蛋用型鸡[5-6]中。ALV-J的感染已在中国鸡群中广泛流行,给中国养鸡业造成严重的损失。
为控制ALV-J在中国地方种鸡中的流行,需要对我国地方种鸡实施净化。由于我国种鸡品系和种群数量大、饲养不规范和饲养密集等特点,可能需要较长时间的净化才能达到感染率非常低的防控要求;此外,还需要借助其他的防制方法降低鸡群的ALV-J感染率,以达到加快净化的目的[5]。使用疫苗预防是一有效的可选择方法,但对ALV-J至今尚未有有效的疫苗在生产中加以应用。
本研究通过原核表达ALV-J的gp85囊膜蛋白并采用不同免疫佐剂和免疫程序对雏鸡进行免疫接种,对其免疫保护作用进行研究,为开发有效的ALV-J亚单位疫苗提供实验依据。
1 材料和方法
1.1 病毒、细胞及实验动物 ALV-JNX0101株和单克隆抗体(MAb)JE9及DF-1细胞由本实验室保存;海兰褐1日龄雏鸡购自泰安市东岳种禽场,试验前进行ALV感染检测,全部为阴性者进行动物免疫接种试验。
1.2 质粒与菌株 pMD18-T simple vector试剂盒购自TaKaRa公司;pET-32a(+)载体购自Invitrogen公司;大肠杆菌(E.coli)DH5α和BL21(DE3)菌株均由本实验室保存。
1.3 主要试剂 常用核酸和蛋白等分子试剂购自TaKaRa公司;胶回收试剂盒购自天根生化科技(北京)有限公司;质粒提取试剂盒购自OMEGA公司;免疫佐剂包括F佐剂和C佐剂,前者购自北京博奥生物有限公司,后者被设计后由宝生物工程(大连)有限公司合成;ALV-J抗原P27 ELISA检测试剂盒(批号:99-09254)和抗体ELISA检测试剂盒(批号:99-09268)均购自美国IDEXX公司。
1.4 A LV-J gp85蛋白免疫抗原的制备 根据GenBank登录的NX0101株env序列(AY897227)设计引物:5'-CGCGGATCCGGAGTTCATCTGTTGCAAC AACCA-3'(BamHⅠ)和 5'-CCCAAGCTTGGCGCCTG CTACGGCGGTG-3'(HindⅢ),以 NX0101 DNA为模板,按照TaKaRa公司的高保真TaqDNA聚合酶说明书进行PCR扩增,PCR产物经1.0%琼脂糖凝胶电泳分析。
PCR产物克隆于pMD18-T载体中,经双酶切、胶回收后亚克隆于pET-32a(+)表达载体中,由北京六合华大基因科技股份有限公司进行测序,并命名为pET32a(+)-gp85。将其转化E.coliBL21(DE3),用1 mmol/L IPTG 37℃诱导表达,按照分子克隆实验指南介绍方法纯化His-Jgp85蛋白。以J亚群囊膜糖蛋白特异性MAb JE9通过western blot方法检测重组蛋白的抗原特异性。
1.5 动物免疫保护试验
1.5.1 试验设计7日龄海兰褐公鸡60只随机分为:gp85组,gp85+F组,gp85+F+C组,每组至少10只鸡,并设空白质粒表达蛋白免疫组6只鸡(pET32a组)。每只鸡分别腿部肌肉注射0.2 ML(100μg)重组蛋白。gp85组接种免疫蛋白稀释液,gp85+F组接种免疫蛋白与F佐剂的乳化液,gp85+F+C组接种免疫蛋白、F和C佐剂的混合乳化液,对照组接种灭菌PBS缓冲液,pET32a组每只鸡注射同等剂量的表达的空质粒蛋白。一免后第3周每组部分鸡进行二次加强免疫,免疫方法和剂量同前;二免后第5周进行ALV-JNX0101毒株攻毒保护试验,除对照组6只鸡外其余鸡只腹腔注射攻毒,剂量为102.2TCID50/只鸡,攻毒后连续两周进行病毒血症检测和致病性观察。在首次接种后第1周~第11周每周采集血清,-20℃储存用于抗体水平检测。
1.5.2 血清ALV-J抗体检测用IDEXX公司的ALV-J抗体ELISA检测试剂盒检测抗体水平,具体方法见试剂盒说明书。酶标仪检测样品OD450nm值,比较各组的抗体水平。
1.5.3 病毒血症检测方法参照文献[6]中相关步骤进行。取接种细胞上清经冻融后使用ALV P27抗原ELISA检测试剂盒按使用说明检测,并判断病毒血症的阴性和阳性。
1.5.4 攻毒后致病性检测记录攻毒后3周内各试验组鸡只体重变化和剖检后脾脏、法氏囊等组织重量变化,计算增重和器官发育指数;脾脏一部分液氮保存,一部分用于制作组织切片和ALV-JMAb JE9介导的免疫荧光(IFA)检测。
器官发育指数=器官重/体重×100%
1.6 数据处理 所有统计数据以平均值±标准误(X±SD)表示,组间差异性用ANOVA软件分析,p<0.05表示差异显著,p<0.01表示差异极显著。
2 结 果
2.1 重组表达质粒的鉴定 利用设计的引物,对ALV-Jgp85基因进行扩增,构建重组质粒pET32a-NX0101-Jgp85,对该重组质粒进行扩增,产物经1%琼脂糖凝胶电泳分析,得到一条约为900 bp的特异性片段(图1A)。该重组质粒经BamHⅠ和HindⅢ双酶切后,经凝胶电泳分析表明在5.9 kb的载体pET-32a(+)处有一清晰条带,与预期大小一致;经测序后分析表明得到目的基因大小为909 bp,与预期结果相符。证明gp85目的基因已插入表达载体中。
2.2 gp85的诱导表达、纯化与免疫原性分析 将重组质粒pET32a-NX0101-Jgp85转化至受体菌BL21(DE3),经IPTG诱导后进行SDS-PAGE分析,目的蛋白得到高效表达,均为包涵体形式,表达蛋白的相对分子质量约为53 ku;使用Ni-NTA纯化表达蛋白,经纯化后得到纯度较高的his-gp85重组蛋白(图1B);该蛋白经western blot分析表明在53 ku相应的位置出现一条清晰的免疫反应带,表明E.coli表达的gp85重组蛋白与ALV-J亚群MAb JE9[7]发生特异性结合(图1C)。
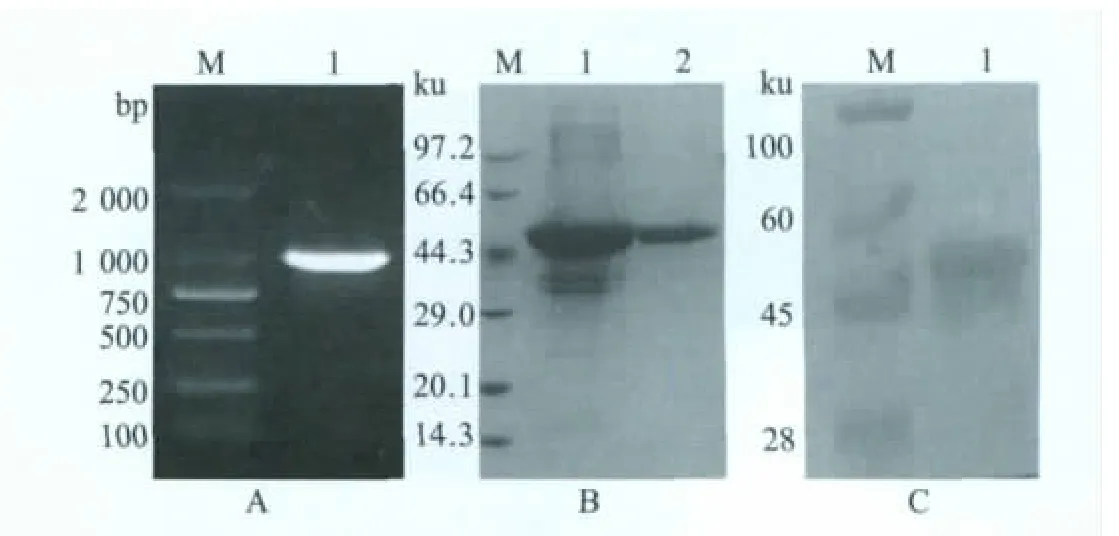
图1 pET32a-NX0101-Jgp85重组质粒的PCR扩增(A)及其重组蛋白的纯化(B)和western blot分析(C)Fig.1 PCR amplification(A),purification(B)and specificity analysis(C)of recombinant protein
2.3 不同免疫佐剂和免疫次数对gp85重组蛋白诱导生成抗体的作用 使用ALV-J抗体试剂盒检测接种后鸡只生成抗体变化的结果(图2)。

图2 不同免疫佐剂和免疫次数对gp85重组蛋白诱导抗体的影响Fig.2 Effect of different adjutants and inoculated numbers on the antibodies induced by the recombinant protein of gp85
图中显示gp85+F组和gp85+F+C组在一免和二免后ALV-J阳性血清抗体显著高于gp85重组蛋白免疫组,gp85免疫组在一次免疫后阳性血清仅维持大约7 d时间;二次加强免疫后阳性血清抗体维持约28 d,并且最高效价较低。gp85+F组免疫后,一免后抗体从第7 d开始上升,第14 d达到最高,随后下降,至第56 d;二免后能够维持并继续促进抗体生成至第42 d达到最高,随后下降至第77 d试验观察结束仍有较高的抗体。gp85+F+C组抗体具有相似的变化规律,所不同的是抗体下降速度慢,抗体效价总体高于gp85+F组。另外,二次免疫也进一步促进抗体的生成,并维持时间进一步延长。
2.4 不同免疫佐剂和免疫次数对gp85重组蛋白诱导抗体阳性鸡只比例的变化 经一免后的鸡只,gp85组抗体阳性率较低,最高仅有50%;gp85+F组从第14 d开始全部产生抗体,直到第49 d,随后降低;gp85+F+C组从第21 d全部鸡只产生抗体,到攻毒时第56 d有80%的鸡只有阳性血清抗体。经二免后,gp85免疫组,抗体阳性率有所升高,在28 d~42 d期间达到80%以上;gp85+F组可以在免疫后第14 d至第63 d全部产生抗体,而gp85+F+C组可以在第28 d至第77 d全部产生抗体。试验结果显示二次免疫和所用两种免疫佐剂可以增强鸡只对重组蛋白免疫的免疫原性。
2.5 不同免疫的鸡只攻毒后病毒血症的变化 使用CEF和DF1细胞对攻毒后鸡只的血浆进行病毒分离,检测病毒阳性比例;并统计不同鸡只抗体存在情况(表1)。未免疫攻毒组病毒血症阳性率为87.5%,gp85免疫组为66.7%;gp85+F组为46.2%,gp85+F+C组为33.3%;以上3个免疫接种组免疫保护率分别为33.3%、53.8%和66.7%。其中所免疫保护鸡只中抗体阳性比例为16/19(84.2%),抗体阴性比例为3/19(15.8%);未被保护的鸡只中抗体阴性比例为 12/18(66.7%)。

表1 攻毒后第2周不同病毒血症和抗体鸡只的比例(率)Table 1 The ratios of chickensw ith different viremia and antibody at the second week after challenge by ALV-J
2.6 不同免疫的鸡只攻毒后健康状况检测 表2显示各试验组在攻毒后3周时间内体重变化、脾脏和法氏囊发育变化,由于组间个体差异较大,体重变化和增重变化没有显著差异,但使用gp85+F+C组鸡增重比未免疫未攻毒组增长69%,比未免疫攻毒组增长107%;其它免疫组均比未免疫攻毒组有所升高,但比未免疫未攻毒组降低。未免疫攻毒处理的鸡只脾脏和法氏囊净重和发育指数比未攻毒组鸡只有所下降,gp85免疫组脾脏净重和发育指数进一步降低,使用免疫佐剂联合免疫的鸡只升高;gp85+F+C组法氏囊净重和发育指数比攻毒组升高,但仍低于未攻毒对照组。

表2 攻毒后3周体重和主要免疫器官发育指数的变化Table 2 Changes of body weight and main immune organs during 3 weeks after challenge by ALV-J
在攻毒后3周内,未免疫未攻毒组鸡只没有死亡,剖检未见明显肿瘤变化;未免疫攻毒组死亡一只,其余均出现消瘦、冠苍白、采食量下降等症状;gp85组在攻毒后死亡4只;gp85+F+C组死亡4只;gp85+F+C组死亡2只。经ALV-JMAb介导的IFA检测以上死亡鸡只和未免疫攻毒鸡只的脾脏组织显示有大量特异性荧光出现;而免疫处理组未死亡的鸡只精神状态较好,未见发育异常,脾脏组织切片经IFA检测未见特异性荧光。
3 讨 论
本研究利用ALV-J囊膜蛋白gp85基因经原核表达制备其重组蛋白,利用该表达蛋白作为免疫原,对雏鸡免疫能够产生一定的抗体,但维持时间短、抗体效价低。这与先前报道中所遇到的问题是相同的[8],而利用F佐剂与gp85表达蛋白制备成免疫乳化剂后免疫提高了ALV-J抗体滴度和维持时间;同时使用二次加强免疫可以进一步促进ALV-J抗体的产生,高效价抗体可维持到第9周。
C佐剂是一种核酸佐剂,可以激活Toll样受体,诱导机体产生非特异性免疫反应[9]。近年来一些文献有关该佐剂促进亚单位疫苗和DNA疫苗诱导鸡体产生体液免疫反应的报道较多[10-11];但在ALV-J方面的研究还未见报道。本研究利用该佐剂与F佐剂制备成乳化佐剂,与gp85联合免疫能够进一步促进gp85基因表达产物免疫鸡产生高效价抗体,维持时间在F佐剂基础上又进一步延长,抗体下降速度减缓;二次加强免疫后,高效价抗体可以维持到11周。本研究再次证明了该佐剂具有促进原核表达蛋白免疫原性的作用,是一种极具潜力的免疫佐剂。
使用病毒株ALV-JNX0101攻毒,观察免疫接种后免疫保护作用。可以看出一定剂量的ALVJNX0101对60日龄的鸡只也产生一定的免疫抑制和免疫器官发育障碍、甚至死亡等致病性。接种后的鸡只产生不同保护力,特别是利用佐剂免疫的鸡只,病毒血症鸡只减少,免疫器官发育得到改善;所被保护的鸡只gp85抗体阳性率达84.2%,而病毒血症为阳性的个体中抗体为阴性却占66.7%,表明所产生的免疫保护作用与针对gp85抗体有直接的关系。值得注意的是本研究表明病毒血症为阳性的个体,其血清中也具有较高gp85蛋白的抗体,产生这种现象的原因上值得进一步研究。
[1]徐镔蕊,董卫星,余春明,等.用ALV-Jgp85单克隆抗体证明蛋鸡存在J亚群禽白血病[J].畜牧兽医学报,2005,36(3):269-271.
[2]王辉,崔治中.蛋鸡J亚群白血病病毒的分离鉴定及序列分析[J].病毒学报,2008,24:369-375.
[3]成子强,张利,刘思当,等.中国麻鸡中发现禽J亚群白血病[J].微生物学报,2005,45(4):584-587.
[4]Sun Shu-hong,Cui Zhi-zhong.Epidemiological and pathological studies of subgroup J avian leukosis virus infectious in Chinese local"yellow"chicken[J].Avian Pathol,2007,36:221-226.
[5]崔治中,郭慧君,孙淑红.鸡白血病的流行现状和防制对策[J].中国兽药杂志,2009,43(10):37-41.
[6]孙贝贝,崔治中,张青婵,等.ALV-J人工感染鸡病毒血症和抗体反应动态[J].中国农业科学,2009,42(11):4069-4076.
[7]秦爱建,崔治中,Lee L,等.抗J亚群禽白血病病毒囊膜糖蛋白特异性单克隆抗体的研制及其特性[J].畜牧兽医学报,2001,32(6):556-562.
[8]胡建,王青,杭柏林.禽流感病毒新型疫苗的研究进展[J].生物技术通报,2010,(8):35-39.
[9]V leugels B,Ververken C,Goddeeris B M.Stimulatory effect of CpG sequences on humoral response in chickens[J].Poult Sci,2002,81(9):1317-1321.
[10]Wang Yi-m ing,Shan Chun-qiao,M ing Shuang-xi,et al.Immunoadjuvant effects of bacterial genom ic DNA and CpG oligodeoxynucleotides on avian influenza virus subtype H5N1 inactivated oil emulsion vaccine in chicken[J].Res Vet Sci,2009,86(3):399-405.
[11]Dalloul R A,Lillehoj H S,Klinman D M,et al.In ovo administration of CpG oligodeoxynucleotides and the recombinant microneme protein MIC2 protects against Eimeria infections[J].Vaccine,2005,23:3108-3113.
