抗HSV-2单链抗体和碱性磷酸酶融合蛋白的制备
2014-08-24,,
,,
(浙江工业大学 药学院,浙江 杭州 310032)
生殖器疱疹(GH)是一种常见的性传播疾病,主要通过水平性接触传播,也能垂直感染胎儿及新生儿,导致流产及新生儿死亡.GH主要由单纯疱疹病毒II型(HSV-2)感染所致[1].近年来的流行病学调查表明:HSV-2感染与宫颈癌的发生有关[2-3],还会增加人类免疫缺陷病毒(HIV)感染的风险[4-5].Looker KJ等根据全球12个地区的汇总数据估计,2003年全球15~49岁人群中,HSV-2感染的患病率约为16.2%,发病率约为0.7%,仅2003年全球新增HSV-2感染者约2 360万人[6].因此,建立一种简便、快速和低成本的HSV-2初筛方法,对GH的辅助诊断和控制传播具有重要的意义.本研究为了探索前期筛选到的高特异性抗HSV-2糖蛋白B的单链抗体在GH诊断中的应用价值,构建了抗HSV-2单链抗体和碱性磷酸酶的融合表达载体,并进行了包涵体的复性研究.
1 材料与方法
1.1 材 料
1.1.1 菌株及质粒
大肠杆菌BL21(DE3)和DH5α由本实验室保存,质粒pLac-duet-1-AKP和pCANTAB5E-H3由杭州远方生物科技有限公司提供.
1.1.2 酶及主要试剂
限制性内切酶NotI、NcoI和T4 DNA连接酶购自TaKaRa公司,DNA和蛋白购自Fermentas公司,DNA凝胶回收试剂盒、质粒小量抽提试剂盒和碱性磷酸酶检测试剂盒购自碧云天公司,Ni2+-NTA基质购自QIAGEN公司.
1.2 方 法
1.2.1 融合表达载体pLac-H3-AKP的构建
质粒pLac-duet-1-AKP是将pETduet-1(Novagen公司)质粒中T7启动子用大肠杆菌Lac启动子替代,并插入了一个进化后酶活性提高30倍左右的大肠杆菌碱性磷酸酶基因片段;pCANTAB5E-H3是从本室早先构建的噬菌体抗体库中筛选到的针对单纯疱疹病毒糖蛋白B抗原的N端特异性中和抗体,这个抗体识别抗原的立体结构,能有效封闭病毒与相应细胞受体的结合位点从而阻断病毒侵入细胞.分别用限制性内切酶NotI和NcoI双酶切,产物经1%琼脂糖凝胶电泳目标条带用凝胶回收试剂盒回收后用T4 DNA连接酶连接,产物转化大肠杆菌DH5α感受态细胞,涂布含氨苄青霉素的LB培养平板37 ℃培养过夜,次日挑取单菌落培养,抽提质粒用NotI和NcoI双酶切鉴定克隆是否含有目标载体,含预期大小基因片段的克隆送上海生工测序,测序正确的克隆命名为pLac-H3-AKP.
1.2.2 融合蛋白的表达及包涵体的制备
将表达载体pLac-H3-AKP转化大肠杆菌BL21(DE3)感受态细胞,涂布含氨苄青霉素的LB培养平板37 ℃培养过夜,次日挑取单菌落接种于含氨苄青霉素的LB培养基中37 ℃培养,再次抽提质粒双酶切确认是否含有目标载体.将确认后的克隆接种至含氨苄青霉素的LB培养基中培养过夜,次日按1:100比例接种于1 L新鲜的含氨苄青霉素的LB培养基中,37 ℃摇床振荡培养至OD600为0.8左右,加入终浓度为1 mmol/L的IPTG,继续37 ℃摇床振荡诱导培养4 h.4 ℃,4 000 r/m收集菌体15 min,每克湿菌体用10 mL PBS洗涤两次,再以相同比例的含有0.5 mol/L NaCl的预冷PBS重悬细菌,反复冻融三次后,放冰水浴中超声至菌体完全裂解,12 000 r/m离心15 min,收集包涵体沉淀.
设置无质粒和空白质粒转化对照组,并设计了各组未诱导全菌、诱导全菌、破菌后上清和沉淀进行12%SDS-PAGE电泳以确定表达产物的定位.
1.2.3 包涵体的纯化
每克包涵体用5 mL洗涤缓冲液(50 mmol/L Tris-HCl,2 mol/L尿素,1% Triton X-100,pH 8.0)洗涤包涵体3次.洗涤后的包涵体复性前采用两步变性法处理:每300 mg包涵体用1 mL裂解缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,6 mol/L盐酸胍,pH 8.0)重悬后室温摇床振荡过夜以溶解包涵体,次日12 000 r/m离心15 min,弃去沉淀,上清用40倍体积超纯水迅速稀释,使蛋白重新聚集沉淀过夜,12 000 r/m离心30 min,保留沉淀,用变性缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,8 mol/L尿素,pH 8.0)重新溶解沉淀,12 000 r/m离心15 min,上清过0.45 μm滤膜备用.
按制造商推荐的方法用10倍柱体积的平衡缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,8 mol/L尿素,20 mmol/L咪唑,pH 8.0)平衡镍离子螯合介质.将尿素变性溶解的包涵体溶液与平衡好的螯合介质混匀,室温温和混匀30 min使之充分结合,用10倍柱体积的洗涤缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,8 mol/L尿素,40 mmol/L咪唑,pH 8.0)充分洗涤镍离子螯合介质.从低到高以不同浓度梯度的咪唑洗脱缓冲液竞争性洗脱目的蛋白,每个浓度2个柱体积洗脱.12% SDS-PAGE电泳分析目的蛋白有效洗脱浓度和纯度.洗脱液中加入终浓度为10 mmol/L DTT打开二硫键.用含有50 mmol/L Tris-HCl,0.5 mol/L NaCl,8 mol/L尿素的pH为8.0的缓冲液低温透析除去咪唑和DTT,用Bradford法测定蛋白浓度.
1.2.4 包涵体的复性
复性缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L β-巯基乙醇,0.5 mol/L尿素,0.5 mol/L精氨酸,1 mmol/L GSSG和1 mmol/L GSH,pH 8.0),蛋白的初始复性质量浓度为0.1 mg/mL,放4 ℃冰箱中复性24 h.
1) 不同pH值对复性效果的影响
将透析好的变性蛋白逐滴加入到预冷的不同pH值的复性缓冲液中,pH值分别为7.0,7.5,8.0,8.5,9.0,蛋白的初始复性质量浓度为0.1 mg/mL.放4 ℃冰箱中复性24 h,12 000 r/m离心15 min,测定上清中AKP比活.
2) 不同初始复性蛋白质量浓度对复性效果的影响
将透析好的变性蛋白逐滴加入到预冷的复性缓冲液中,初始的复性蛋白质量浓度分别为0.05,0.1,0.15,0.2,0.25 mg/mL.放4 ℃冰箱中复性24 h,12 000 r/m离心15 min,测定上清中AKP比活.
3) 不同浓度比例的GSSG和GSH对复性效果的影响
将透析好的变性蛋白逐滴加入到预冷的不同浓度比例的复性缓冲液中,GSSG终浓度为1 mmol/L,GSH终浓度分别为0.5,1,2,3,4 mmol/L,蛋白的初始复性质量浓度为0.1 mg/mL.放4 ℃冰箱中复性24 h,12 000 r/m离心15 min,测定上清中AKP比活.
4) 不同时间对复性效果的影响
将透析好的变性蛋白逐滴加入到预冷的复性缓冲液中,蛋白的初始复性质量浓度为0.1 mg/mL.放4 ℃冰箱中分别复性12,24,36,48,60 h,12 000 r/m离心15 min,测定上清中AKP比活.
1.2.5 复性后融合蛋白的分析鉴定
进行8% SDS-PAGE和抗原结合活性鉴定:用包被缓冲液稀释HSV-2糖蛋白B抗原至1 μg/mL,取100 μL加入96孔板4 ℃包被过夜,空白对照孔加等量包被液.次日移去包被液,用含0.05% Tween-20的PBS洗3次,1% BSA 37 ℃封闭1 h,移去封闭液,用含0.05% Tween-20的PBS洗3次,加入100 μL复性后的融合蛋白(1 μg/mL)37 ℃反应1 h,PBS洗3次,然后分别加入50 μL碱性磷酸酶试剂盒中溶液I和溶液II,37 ℃显色15 min,再加入50 μL碱性磷酸酶试剂盒中溶液III,与空白对照对比观察颜色变化.
2 结果与分析
2.1 融合表达载体pLac-H3-AKP的构建
重组质粒经双酶切消化后进行1%琼脂糖凝胶电泳可见一条大小约5 200 bp的条带和一条大小约750 bp的条带,理论上重组质粒应该由一个大小约5 200 bp的载体片段和一个大小约750 bp的单链抗体基因片段组成,可见电泳显示的两个条带大小均与理论值相符(图1),表明成功地构建了融合表达载体pLac-H3-AKP.该载体含Lac启动子,可用IPTG诱导表达,同时在碱性磷酸酶的羧基端设计有编码6个组氨酸的密码子序列使表达的融合蛋白含有6个组氨酸,便于金属螯合层析纯化.
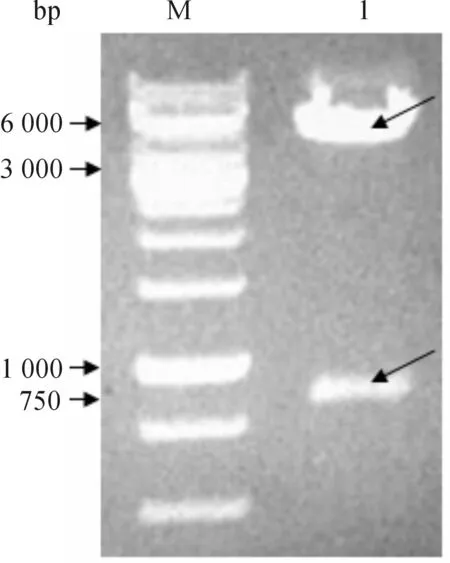
M-1 kb DNA Ladder; 1-重组质粒双酶切产物
2.2 融合蛋白的表达及包涵体的制备
对比未经IPTG诱导的全菌蛋白,可见诱导后的全菌蛋白及破菌沉淀在SDS-PAGE电泳中均出现约75 kD大小的条带(图2),而经诱导后的破菌上清中未见明显差异条带,表明融合蛋白在大肠杆菌中成功表达且主要以包涵体形式存在.
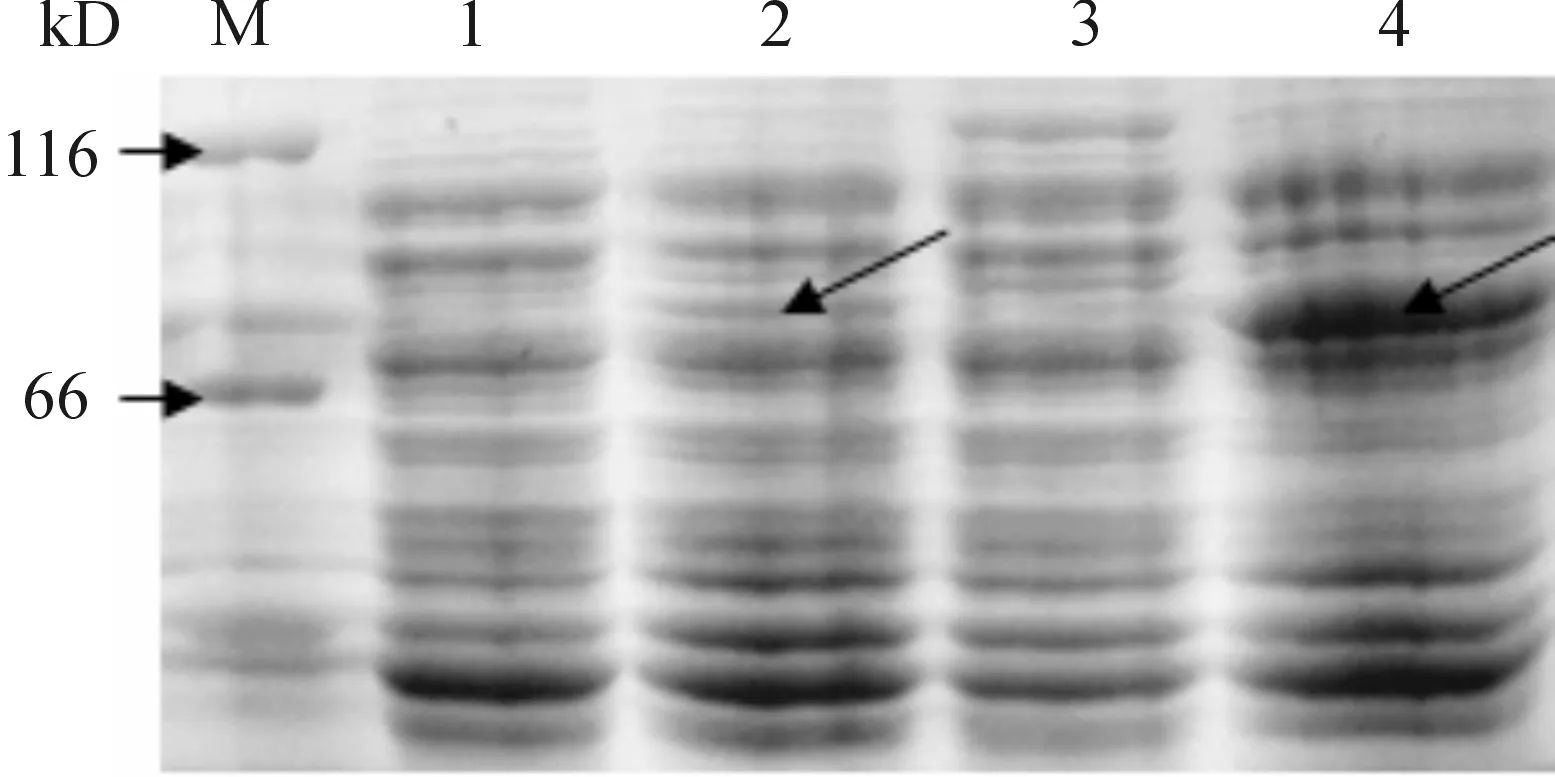
M-Protein Marker;1-未诱导全菌;2-诱导全菌;3-诱导后破菌上清;4-诱导后破菌沉淀
2.3 包涵体的纯化
12% SDS-PAGE电泳显示,纯化后的包涵体蛋白能被适当浓度的咪唑有效洗脱,在200 mmol/L咪唑洗脱时纯度达到75%左右(图3).

1-未纯化包涵体;2-100 mmol/L咪唑洗脱;3-150 mmol/L咪唑洗脱;4-200 mmol/L咪唑洗脱;5-250 mmol/L咪唑洗脱
2.4 包涵体的复性
1) 不同pH值对复性效果的影响
通常来说,复性缓冲液的pH值需要大于7.0,用来防止自由硫醇的质子化作用影响二硫键的正确配对,实验结果表明:当复性缓冲液pH值为7.5左右时(图4),离心上清中的复性蛋白比活最高.

图4 不同pH值对复性效果的影响曲线
2) 不同初始复性蛋白质量浓度对复性效果的影响
采用稀释法复性,需要确定最佳初始蛋白质量浓度,蛋白质量浓度过高会增加分子间相互碰撞的几率,使蛋白更容易发生聚集.实验结果表明:当初始复性蛋白质量浓度为0.1~0.15 mg/mL左右时(图5),离心上清中的复性蛋白比活最高.
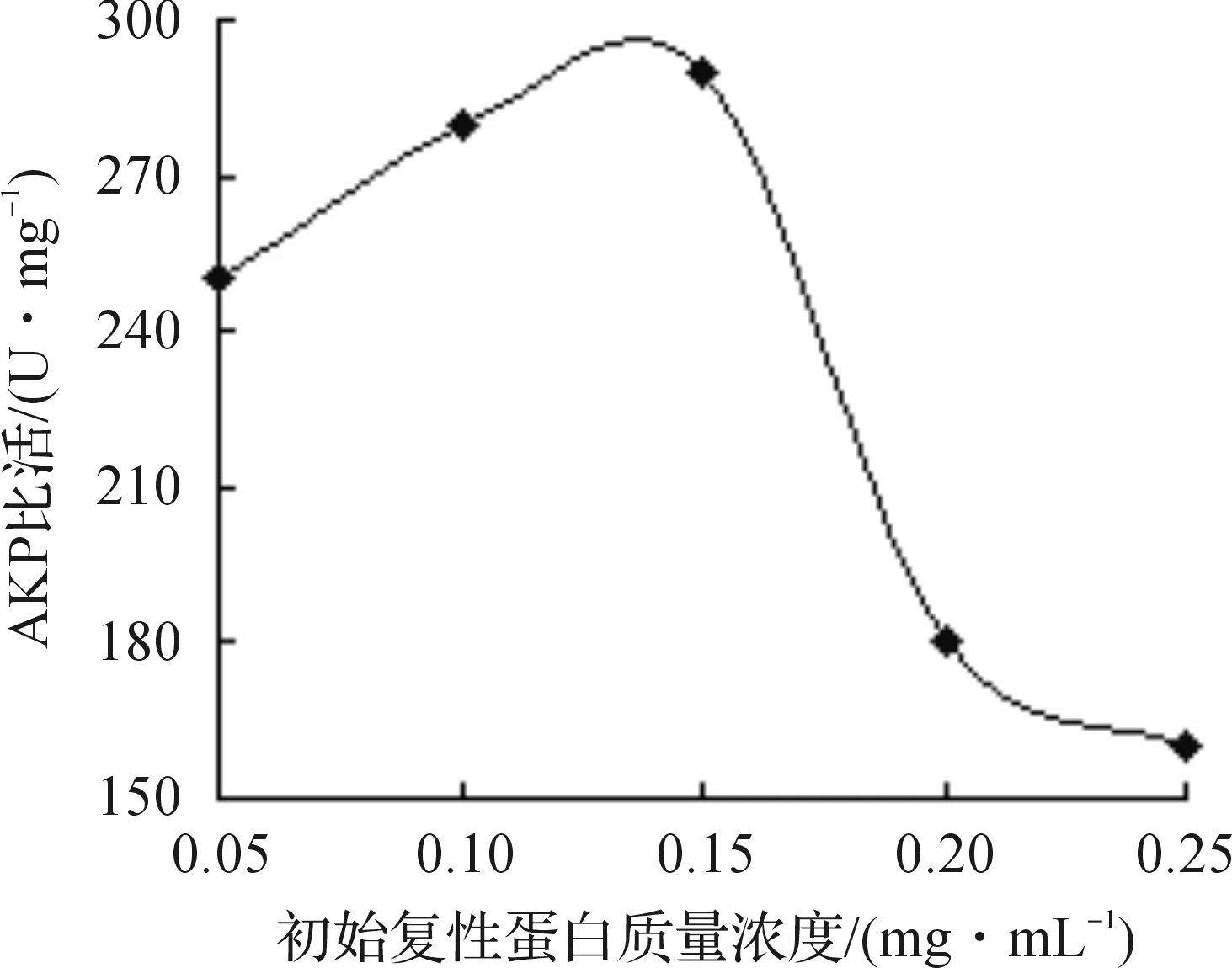
图5 不同初始复性蛋白质量浓度对复性效果的影响曲线
3) 不同浓度比例的GSSG和GSH对复性效果的影响
包涵体变性时,蛋白中的二硫键被DTT完全打开,复性时,需要一定的氧化剂将其重新氧化,同时还需要一定的还原剂对错配的和不稳定的二硫键重新还原,这两个过程的有机结合才能得到较好的复性效果.本实验采用适当比例的GSSG和GSH来提供所需的氧化还原环境,最终确定复性液中GSSG浓度为1 mmol/L,GSH浓度为3 mmol/L最为合适(图6),离心上清中的复性蛋白比活最高.

图6 不同浓度比例的GSSG和GSH对复性效果的影响曲线
4) 不同时间对复性效果的影响
蛋白复性是一个缓慢的过程,需要充足的时间做保证,实验结果表明:融合蛋白在复性24 h后,复性率趋于不变(图7).
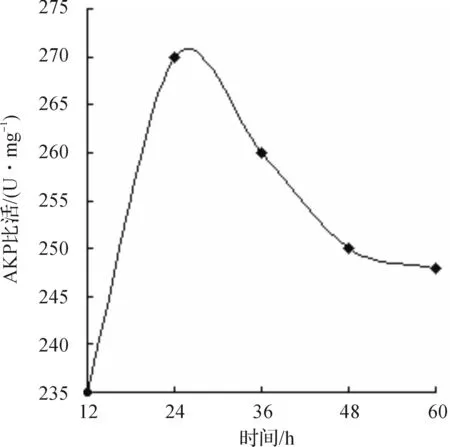
图7 不同时间对复性效果的影响曲线
5) 复性后融合蛋白的分析鉴定
确定最佳复性条件为复性缓冲液(50 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L β-巯基乙醇,0.5 mol/L尿素,0.5 mol/L精氨酸,1 mmol/L GSSG和3 mmol/L GSH,pH 7.5),蛋白的初始复性质量浓度为0.13 mg/mL,4 ℃复性24 h.
8% SDS-PAGE电泳显示复性后融合蛋白约为75 kD大小(图8).
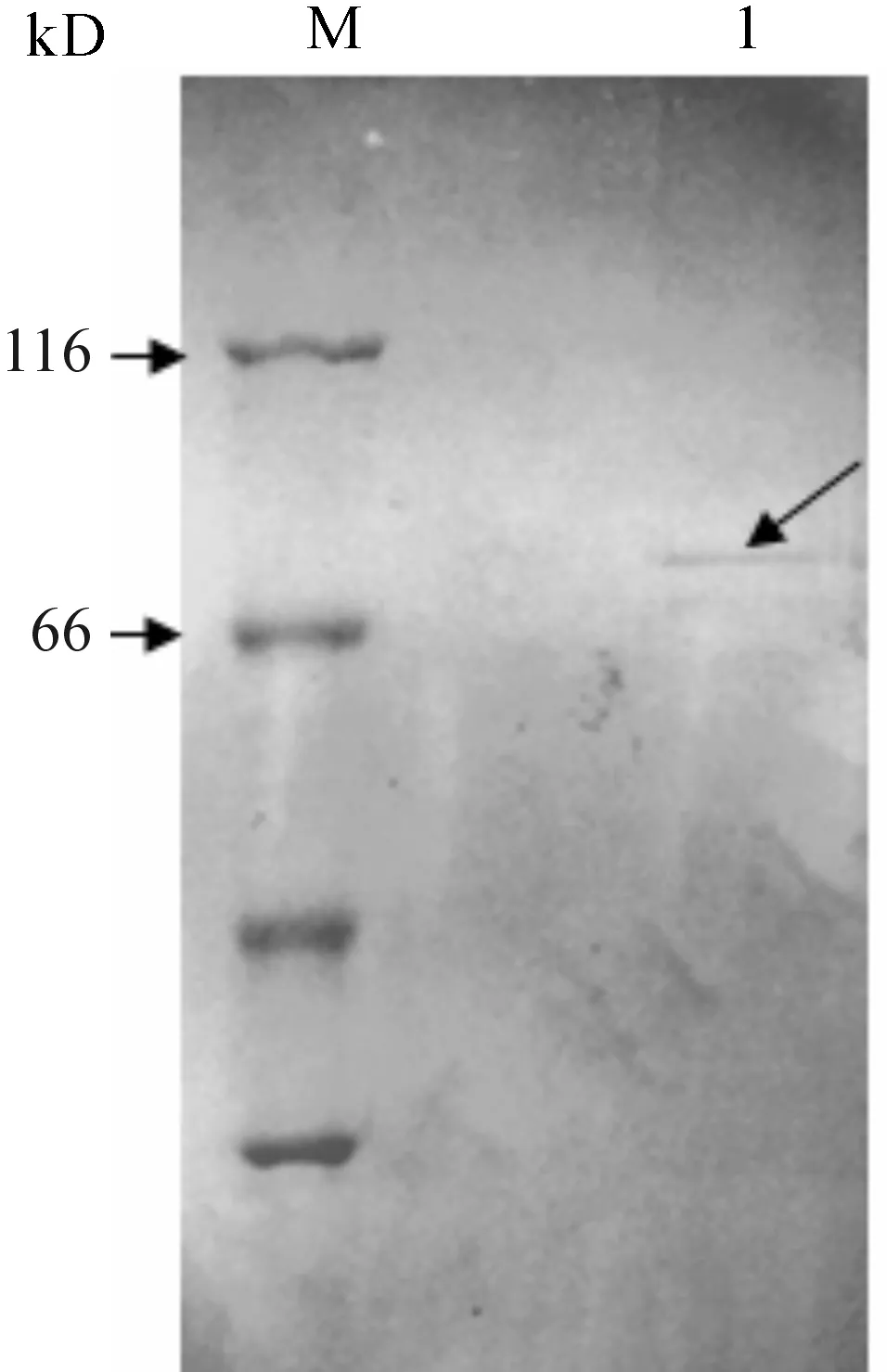
M-Protein Marker;1-复性后融合蛋白
为了验证复性后的融合蛋白是否具有HSV-2抗原结合活性,本实验用直接ELISA法鉴定复性液检测抗原的活性.结果表明:复性后的融合蛋白不仅能识别特异性抗原还能有效显示酶活性,证明了该融合蛋白具有融合前两个分子的双重功能.ELISA结果见图9.

1-空白对照;2,3,4-三组平行ELISA
3 结 论
单链抗体分子量小,结构简单,易于与各种分子融合形成多重功能的融合蛋白.碱性磷酸酶是广泛应用于生物技术中的一种标记酶.常规的酶标二抗采用化学交联方法制备,存在步骤繁琐、标记率低、成本高的弊端.使用基因工程技术将识别单元和显示单元融合表达制备出具有双重功能活性的融合蛋白,这不仅省略了酶标抗体的制备过程,而且还可以使检测过程更加简单快速[7-8].我们构建了含有抗HSV-2单链抗体基因和碱性磷酸酶基因的融合表达载体并在大肠杆菌中获得了包涵体形式为主的融合蛋白表达,包涵体经过两步变性法[9]变性,再用镍离子金属螯合层析纯化,最后初步探索了影响这种融合蛋白复性的因素,为今后产业化生产相关诊断试剂打下了一定的基础.实验结果证明:大肠杆菌可以有效地表达单链抗体和碱性磷酸酶融合蛋白,这种融合蛋白经过复性可以恢复原有两个蛋白的各自生物学活性.碱性磷酸酶还可以作为复性的指示剂,通过检测它的活性可以评估其融合伴侣是否也得以复性.该双重功能活性的融合蛋白可应用于快速免疫筛查,使ELISA不再需要酶标二抗,简化了ELISA步骤、缩短了检测的时间、省下了常规化学交联制备酶标二抗的成本,具有一定的应用前景.
参考文献:
[1]JONSSON M K, WAHREN B. Sexually transmitted herpes simplex viruses[J]. Scandinavian Journal of Infectious Diseases,2004,36(2):93-101.
[2]TEVELDE E R, THE T H. Herpes simplex virus type 2 and cervix cancer[J]. Ned Tijdschr Geneeskd,1978,122(33):1226-1230.
[3]KUNKEL M, OBERENDER H. Herpes simplex virus type 2 infection, Etiology, clinical aspects, diagnosis, therapy, HSV-2 and cervix cancer[J]. Zentralbl Gynakol,1985,107(24):1473-1478.
[4]HAGAN H, JENNESS S M, WENDEL T, et al. Herpes simplex virus type 2 associated with HIV infection among New York heterosexuals living in high-risk areas[J]. Int J STD AIDS,2010,21(8):580-583.
[5]ZARIFFARD M R, SAIFUDDIN M, FINNEGAN A, et al. HSV type 2 infection increases HIV DNA detection in vaginal tissue of mice expressing human CD4 and CCR5[J]. AIDS Research and Human Retroviruses,2009,25(11):1157-1164.
[6]LOOKER K J, GARNETT G P, SCHMID G P. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection[J]. Bulletin of the World Health Organization,2008,86(10):805-812.
[7]XU Zhen-lin, DONG Jie-xian, WANG Hong, et al. Production and characterization of a single-chain variable fragment linked alkaline phosphatase fusion protein for detection of o, o-diethyl organophosphorus pesticides in a one-step enzyme-linked immunosorbent assay[J]. Journal of Agricultural and Food Chemistry,2012,60(20):5076-5083.
[8]LIU Xi-xia, WANG Hong, LIANG Yan, et al. Production and characterization of a single-chain Fv antibody-alkaline phosphatase fusion protein specific for clenbuterol[J]. Molecular Biotechnology,2010,45(1):56-64.
