含T细胞表位的猪细小病毒VP2基因核酸疫苗的构建及其在小鼠中的免疫原性分析
2013-08-30孙彦欣左玉柱李建辉范京惠裴丽华王晨枫
孙彦欣,左玉柱,李建辉,范京惠,裴丽华,杨 震,王晨枫
(河北农业大学动物科技学院,河北保定 071001)
猪细小病毒(Porcine parvovirus,PPV)主要引起初产母猪的繁殖障碍。PPV除单独感染猪外,该病毒与猪圆环病毒(Porcine circovirus type 2,PCV2)的混合感染更为普遍,给养猪业造成了严重的经济损失。核衣壳蛋白VP2是PPV的主要保护性抗原,而且具有保守性[1-4]。
PCV2是目前发现最小的动物病毒。Stevenson等研究表明,位于ORF1内201位~220位氨基酸的多肽P21为免疫优势T细胞表位,免疫动物后,动物体内的淋巴细胞明显增多,而且免疫动物血清中PCV2特异的抗体水平亦明显升高[5]。Mahe等研究结果显示,位于ORF1内185位~211位氨基酸的多肽P4(与P21共享201位~211位氨基酸)内存在一个B细胞表位[6]。以上结果提示,多肽P21内存在PCV2特异的优势抗原表位,为研制抗原表位疫苗的优势目标表位。本实验通过在PPV主要保护性抗原VP2基因上游插入PCV2多肽P21基因并构建真核重组质粒,免疫小鼠后观察PPV VP2基因疫苗免疫效力,为研制高效、新型核酸疫苗提供依据。
1 材料和方法
1.1 主要实验材料 HEK293T细胞购自中国细胞典型培养物中心;6周龄~8周龄雌性BALB/c小鼠购自河北医科大学实验动物中心;TaqDNA聚合酶、T4 DNA连接酶、限制性内切酶、pMD18-T载体、DL2000 DNA Marker等均购自TaKaRa公司;预染蛋白Marker购自北京全式金生物技术有限公司;DNA胶回收试剂盒、质粒提取试剂盒为天根生化科技有限公司产品;HRP标记的羊抗鼠IgG(HRP-IgG)购自Promega公司;感受态E.coliDH5α、pcDNA3.1(+)载体由本实验室保存;PPV、PCV2株由本实验室从河北省部分地区患猪体内分离获得。
1.2 VP2基因引物的设计与片段扩增 采用引物YVP2:5'-TCTGGATCCATGAGTGAAAATGTGGAA C-3'(BamHⅠ)和 ZVP2:5'-AGTCTCGAGTGATTAA CCAAGTAACTGA-3'(XhoⅠ)扩增VP2基因,反应条件为:95℃ 5 min;94℃ 1 min、52℃ 1 Min、72℃2 Min,30个循环;72℃10 Min,产物用1%琼脂糖凝胶电泳检测。采用小量凝胶回收试剂盒进行回收纯化,并克隆于pMD18-T载体中,采用小量质粒提取试剂盒提取重组质粒DNA,进行酶切鉴定,并命名为pMD-VP2。
1.2.1 P21基因引物的设计与片段扩增采用引物P1:5'-GGTACCATGGATGGATATCATGGAGAAG AAGTTGTTGTTGTTTTGGAGGA-3'(KpnⅠ)和 P2:5'-GGATCCCCAAGGTAACCAGCCATAAAAATCAT CCAAAACAACAA-3'(BamHⅠ)扩增 P21基因,反应条件为:70℃ 5 Min;23℃或室温退火 5 Min,37℃ 30 min、70℃ 10 Min;产物用1%琼脂糖凝胶电泳检测,小量凝胶回收试剂盒进行纯化回收。
1.2.2 pcDNA-p21-vp2真核表达重组质粒的构建将PPV的VP2基因克隆至pcDNA3.1的BamHⅠ和XhoⅠ之间的多克隆位点,并在VP2基因的5'端插入PCV2的T细胞表位基因P21(GATGGATATC ATGGAGAAGAAGTTGTTGTTTTGGATGATTTTTAT GGCTGGTTACCTTGG)。构建 pcDNA-p21-vp2真核表达重组质粒,并由上海生工生物工程技术服务有限公司测序。
1.2.3 pcDNA-p21-vp2的细胞转染与表达产物鉴定采用质粒抽提试剂盒制备pcDNA-P21-VP2,磷酸钙转染法转染HEK293T细胞,48 h后收集细胞进行裂解。将细胞裂解物SDS-PAGE凝胶电泳后,转印到硝酸纤维膜上,分别以鼠抗PCV2抗体或鼠抗PPV抗体为一抗,以羊抗鼠HRP-IgG为二抗,DNB显色,进行western blot鉴定。
1.3 动物试验 将6周龄~8周龄雌性BALB/c小鼠20只随机分成4组,每组5只。实验组Ⅰ肌肉注射pcDNA-P21-VP2,10μg/只;实验组Ⅱ肌肉注射质粒pcDNA-3.1(+),10μg/只;实验组Ⅲ肌肉注射PPV灭活疫苗100μL/只;实验组Ⅳ肌肉注射PBS溶液100μL/只作为对照组。免疫分3次进行,每次免疫时间间隔为2周,免疫后0~6周每周尾静脉采血分离血清,-20℃保存备用。首免后42 d,无菌摘取小鼠脾脏,常规方法制备脾细胞悬液,用于淋巴细胞增殖试验的测定。
1.4 免疫小鼠血清PPV和PCV2抗体水平的检测参照文献[7]的方法:用100 mM(pH9.6)碳酸钠缓冲液2倍稀释PPV病毒液以及PCV2病毒液(病毒滴度约为10-6/mL),取100μL病毒稀释液在4℃下包被96孔板过夜,次日用1%BSA 37℃封闭1 h,被检血清为倍比稀释的免疫和非免疫小鼠血清(1∶4~1∶512),检测抗体为羊抗鼠 HRP-IgG(1∶2 000),TMB为底物,检测OD450nm值。
1.5 MTT法测定淋巴细胞增殖试验 参照文献[8]的方法,采用RPM I 1640完全培养基悬浮免疫小鼠脾脏淋巴细胞(2×106细胞/mL)。在96孔板中每孔加入50μL细胞悬浮液,每份细胞悬浮液分3孔,将经紫外线灭活的PCV2或PPV作为有丝分裂原为试验组,以ConA刺激组(10μg/mL)为阳性对照组,RPM I-1640营养液(无犊牛血清)为空白对照组,每组3个重复;混匀后,37℃5%CO2继续培养48 h。每孔加入20μL MTT(5 mg/mL),继续培养3 h。每管加入150μL二甲桠枫(DMSO)溶液,使紫黑色结晶完全溶解。在1 h内用酶标仪测定OD570nm值。
2 结 果
2.1 VP2、P21基因的PCR扩增 将VP2、P21基因的PCR扩增产物于1%琼脂糖凝胶中电泳观察结果,分别在约1 700 bp、60 bp处出现特异性的DNA片段,与预期(1 740 bp、60 bp)相符(图1)。经测序表明,扩增的VP2和P21基因序列与GenBank登录的序列一致。
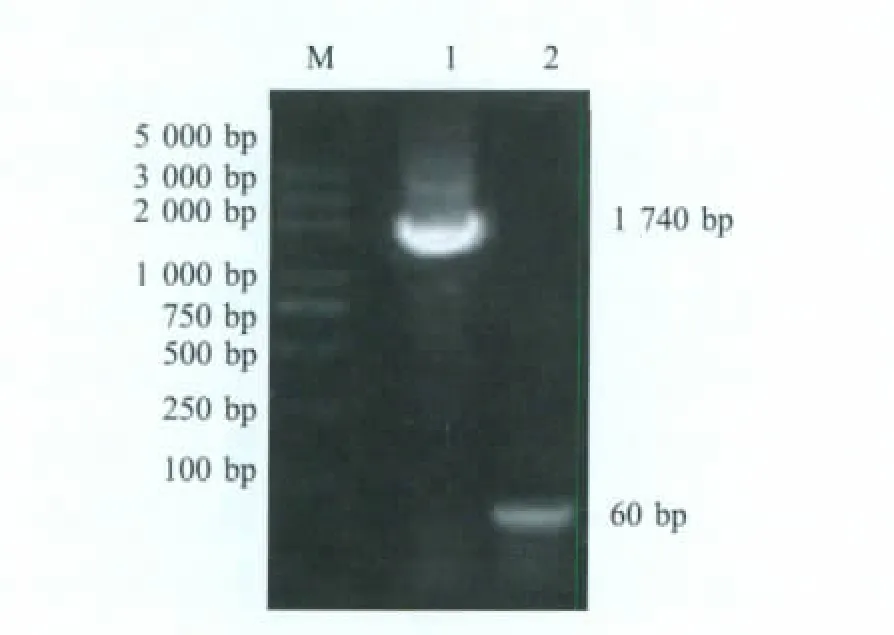
图1 VP2与P21基因PCR扩增结果Fig.1 Amplification of VP2 and P21 gene by PCR
2.2 重组质粒pcDNA-P21-VP2的鉴定 重组质粒pcDNA-P21-VP2分别用KpnⅠ和XholⅠ、BamHⅠ和XholⅠ、KpnⅠ和BamHⅠ进行双酶切鉴定,电泳结果显示,重组质粒分别得到大小约为1 800 bp、1 740 bp和60 bp的目的片段,与预期结果相符,表明目的基因已经正确插入表达载体的阅读框中。
2.3 表达产物的western blot鉴定 采用磷酸钙转染法将pcDNA-P21-VP2和pcDNA3.1(+)质粒分别转染HEK293T细胞,48 h收集细胞,裂解处理后,经western blot分析,pcDNA-P21-VP2质粒转染的HEK293T细胞在67 ku处出现特异性反应带,而同步转染的pcDNA3.1(+)质粒空白对照未出现特异性条带,表明外源基因已在HEK293T细胞中获得表达,并且表达的67 ku重组蛋白能够识别鼠抗PPV、鼠抗PCV2的高免血清(图2)。

图2 Western blot检测重组P21-VP2在HEK293FT细胞的表达Fig.2 Detection of recombinant P21-VP2 expressed in HEK293FT cells by western blot
2.4 免疫小鼠血清中PPV、PCV2 IgG抗体的检测结果 分别采集免疫0~6周小鼠血清,通过ELISA方法检测抗体水平。分别用PPV、PCV2包被96孔板,采用羊抗鼠IgG-HRP抗体分别检测血清PPV、PCV2的IgG型抗体。结果表明pcDNA-P21-VP2能够诱导小鼠机体产生抗PPV特异性抗体,并且高于pcDNA-3.1(+)组和 PBS组(p<0.05)(图 3)。与 PPV灭活苗组进行比较,pcDNA-P21-VP2重组质粒组所诱导产生的抗PPV的IgG抗体略高于PPV灭活苗(p>0.05)。pcDNA-P21-VP2可以诱导小鼠产生明显的免疫反应,并且可以长时期维持较高水平。经ELISA检测血清中PCV2抗体,结果表明接种pcDNA-P21-VP2组,免疫后OD450nm值逐渐升高,而接种pcDNA3.1(+)组和空白对照组则保持平稳(图4)。接种pcDNA-P21-VP2组从14 d开始PCV2抗体水平明显高于其余两组(p<0.05),结果表明本实验构建的pcDNA-P21-VP2能诱导小鼠产生抗PCV2抗体。
2.5 淋巴细胞增殖试验结果 分析pcDNA-P21-VP2核酸疫苗细胞免疫应答水平,本实验采用MTT法初步分析了免疫小鼠淋巴细胞的增殖情况(图5)。试验结果显示,pcDNA-P21-VP2核酸疫苗免疫组的小鼠淋巴细胞增殖反应均高于空载体及空白对照组(p<0.05)。表明pcDNA-P21-VP2核酸疫苗免疫小鼠,对体内的淋巴细胞的增殖反应有明显促进作用。

图3 免疫小鼠ppv抗体水平Fig.3 Dynam ics of PPV specific IgG antibodier in mouse serum

图4 免疫小鼠pcv2抗体水平Fig.4 Dynam ics of PCV2 specific IgG antibodier in mouse serum
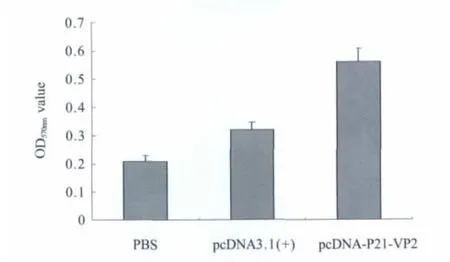
图5 淋巴细胞增殖结果Fig.5 The results of lymphocyte proliferation assay
3 讨 论
PPV的VP2基因表达蛋白不仅自身可以作为疫苗,在外源多肽的转运及多价疫苗的研制中也发挥重要作用[9-12]。Sedlik等以杆状病毒表达载体PACYM对PPV VP2和包含淋巴细胞脉络丛脑炎病毒(LCMV)的118位~132位氨基酸的抗原决定簇区进行融合表达,该融合蛋白免疫鼠可以诱导强烈的细胞毒性T细胞反应(CTL反应),在体内持续时间长达9个月,并可以抵抗致死量的LCMV攻击[10]。Pan等在PPV VP2基因N端插入PCV2抗原表位,在腺病毒中表达嵌合病毒样颗粒,具有良好的免疫原性[12-13]。本实验借鉴该思路,在构建表达载体时,将PCV2多肽P21插入VP2基因N端进行融合表达,产物与PPV、PCV2高免血清可以发生抗原抗体反应。
本研究构建pcDNA-P21-VP2,将其转染HEK293T细胞进行表达,并将构建的pcDNAP21-VP2免疫小鼠,通过ELISA方法检测免疫后小鼠PPV、PCV2的IgG抗体变化,结果显示小鼠免疫后2周就开始产生PPV及PCV2特异性抗体,表明所构建的pcDNA-P21-VP2己转染小鼠体内细胞并在细胞中表达,表达产物作为抗原刺激机体产生免疫应答反应。第二次加强免疫后,试验组小鼠的抗体水平上升幅度很大,表明本实验构建的pcDNA-P21-VP2能够诱导机体免疫系统中的B淋巴细胞产生免疫记忆,这一结果也预示了PPV基因核酸疫苗具有良好的前景,为PPV及PCV2的防制提供了新的思路和技术储备,同时也为其它传染病的核酸疫苗研究提供依据。
[1]Rovira A,Balasch M,Segalés J,et al.Experimental inoculation of conventional pigs w ith porcine eproductive and respiratory syndrome virus and porcine circovirus 2[J].J Virol,2002,4:3232-3239.
[2]Florence B,Paloma R,Sun Cheng-m ing,et al.Cross-prim ing of T cell responses by syntheticm icrospheres carrying a CD8 T cell epitope requires an adjuvant signal[J].J Immunol,2005,174:3432-3439.
[3]王印,王新,郭万柱.猪细小病毒VP2基因核酸疫苗的构建及免疫原性[J].中国兽医学报,2009,29(5):533-535.
[4]韩孝成,董齐,杨奇伟,等.猪细小病毒氧化铝疫苗研究[J].中国预防兽医学报,2001,23(5):381-385.
[5]Stevenson S L,Gilpin D F,Douglas A,et al.T lymphocyte epitope mapping of porcine circovirus type 2[J].Viral Immunol,2007,20(3):389-398.
[6]Mahe D,Blanchard P,Truong C,et al.Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immuno relevant epitopes[J].J Gen Virol,2000,81(7):1815-1824.
[7]殷震,刘景华.动物病毒学[M].2版,北京科技技术出版社,1997:425-426.
[8]侯粉霞,杨慧芳,鱼涛.脂多糖及伴刀豆球蛋白A诱导脾淋巴细胞增殖试验方法用于免疫毒性评价的可行性研究[J].工业卫生与职业病,2007,33(6):336-338.
[9]Opriessnig G T,Fenaux M,Yuc S,et al.Effect of porcine parvovirus vaccination on the development of PMWS in segregated early weaned pigs coinfected with type 2 porcine circovirus and porcine parvovirus[J].Vet Microbiol,2004,98:209-220.
[10]Ignacio C J,Paloma R,A licia H.Parvovirus-like particles as vaccine vectors[J].Methods,1999,19:174-186.
[11]张振梅,崔尚金.猪细小病毒VP2基因与猪圆环病毒2型ORF2基因真核共表达质粒的构建及免疫原性分析[D].中国农业科学院,2010.
[12]丁忠庆,沈荣显,相文华,等.IL-2和绵羊梅迪-维斯纳病病毒核心蛋白Gag核酸疫苗联合免疫小鼠的免疫应答[J].中国预防兽医学报,2007,29(3):204-207.
[13]Sedlik C,Saron M,Sarraseca J,et al.Recombinant parvovirus-like particles as an antigen carrier:a novel nonreplicative exogenous antigen to elicit protective antiviral cytotoxic T cells[J].Proc Natl Acad Sci USA,1997,94:7503-7508.
