芦蒿秸秆总黄酮富集纯化及产物鉴定
2013-08-07邓荣华郭宇星李晓明吕丽爽
邓荣华,郭宇星,李晓明,吕丽爽*
(南京师范大学金陵女子学院,江苏 南京 210097)
芦蒿(Artemisia selengensis Turcz)为菊科蒿属植物,又名藜蒿、柳蒿、香艾蒿、狭叶艾等,为多年生草本植物。《神农本草经》把其列为“上品,甘、平,无毒,长毛发令黑,疗心悬,少食常饥,久服轻身,耳目聪明,防衰之功效”。《本草纲目》记为“主治五脏邪气,风寒湿脾,补中气,利膈开胃,可去东河豚毒”[1]。芦蒿风味独特、营养丰富,且含有较多的黄酮类物质[2],黄酮类物质具有抗氧化性,可以清除活性氧自由基,抑制产生自由基的某些酶的活性等功能[3-9],开发前景广阔。芦蒿的药用价值有清热、去风湿、开胃等功效。民间也有用于治疗急、慢性传染性肝炎者,效果较好[10]。芦蒿在南京八卦洲的种植面积达到3万亩,年产量约5300万kg,由于在生长末期极易木质化,八卦洲每年产生的木质化芦蒿秸秆达2000万kg,种植户采用焚烧的方式对其进行处理,造成了环境污染。因此,为提高芦蒿综合利用价值,开展芦蒿研究很有必要,同时,分离纯化获得高纯度的芦蒿秸秆总黄酮是新药开发的重要前提。本实验通过优选出较理想的大孔树脂AB-8对芦蒿秸秆总黄酮进行富集纯化,并对纯化后产物进行初步鉴定,以期为芦蒿秸秆的开发利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
芦蒿秸秆购于南京八卦洲,干燥粉碎后备用。
AB-8大孔树脂 天津南开大学化工厂;芦丁标准品 中国药品生物制品检定所;无水乙醇、柠檬酸、柠檬酸钠、硝酸铝、亚硝酸钠、三氯化铝、浓盐酸、甲醇等均为分析纯。
1.2 仪器与设备
PHS-3C-01 pH计 上海三信仪表厂;WFH-201B紫外透射反射仪 上海精科实业有限公司;RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂;SHZ-Ⅲ循环水式真空泵 南京科尔仪器设备有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司;HYG-C多功能摇床 太仓市实验设备厂;电脑全自动部分收集器 上海青浦沪西仪器厂;UV-6100A型紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 芦蒿秸秆总黄酮粗提液的制备[11]
芦蒿秸秆→干燥粉碎→乙醇回流提取→冷却→抽滤→离心→旋转蒸发→芦蒿秸秆总黄酮粗提液
1.3.2 芦蒿秸秆总黄酮的测定
采用NaNO2-Al(NO3)3比色法[12]进行测定。
1.3.3 AB-8大孔树脂静态吸附和解吸动力学[13-14]
准确称取一定质量(含干树脂1.0013g左右)的经预处理的湿树脂,置于150mL锥形瓶中,加入芦蒿秸秆提取液(1.790mg/mL)50mL,封口,置于恒温25℃摇床中,以140r/min速率进行吸附,每隔一定时间取样并测定吸附后原液中总黄酮质量浓度。当树脂吸附平衡后,将树脂过滤,用蒸馏水洗去树脂表面的总黄酮溶液后,用体积分数为70%的乙醇50mL于25℃振荡解吸,每隔一定时间取样测定解吸液中总黄酮质量浓度,分别计算树脂的吸附量及解吸量。以时间为横坐标,分别以每克树脂中总黄酮的吸附量及解吸量为纵坐标绘制吸附和解吸动力学曲线,按式(1)~(3)分别计算吸附率、吸附量、解吸率和解吸量。
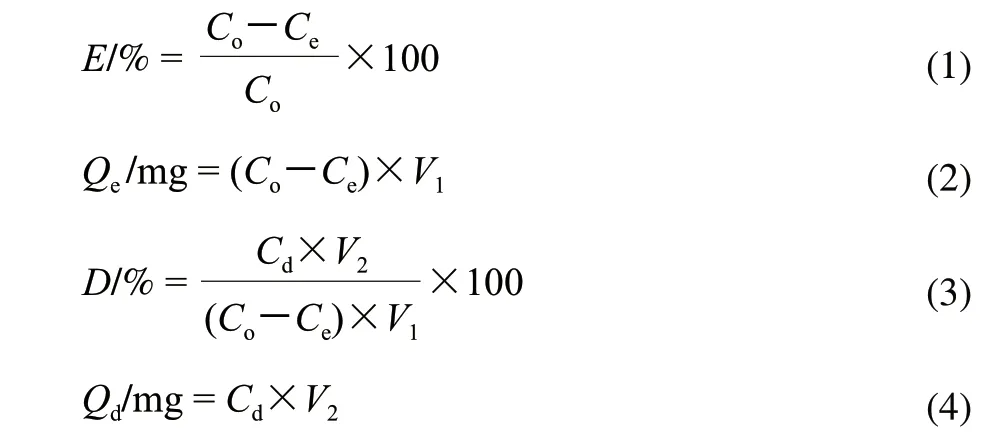
式(1)~(4)中:Co为吸附前溶液的总黄酮质量浓度/(mg/mL);Ce为吸附后溶液的总黄酮质量浓度/(mg/mL);V1为溶液的体积/mL;V2为解吸液体积/mL;E为吸附率/%;Qe为吸附量/mg;D为解吸率/%;Qd为解吸量/mg;Cd为解吸液总黄酮质量浓度/(mg/mL)。
1.3.4 AB-8大孔树脂动态吸附
1.3.4.1 上样液pH值对AB-8动态吸附率的影响[15]
采用规格为1.5cm×60cm的层析柱,将处理好的树脂湿法装柱,取相同体积的芦蒿秸秆提取物,用柠檬酸-柠檬酸钠缓冲液调节上样液pH值分别为3.02、4.08、5.00、6.06、7.02,以1mL/min流速上柱,吸附完全后,用2.0BV的蒸馏水洗柱,再用2.0BV 70%乙醇以1mL/min速率洗脱,将洗脱液浓缩,测定总黄酮质量浓度,计算树脂吸附率。探讨pH值与AB-8吸附率的关系,以确定纯化工艺中最适的上样液pH值。
1.3.4.2 上样质量浓度对AB-8动态吸附效果的影响[16]
量取已知总黄酮质量浓度的芦蒿秸秆提取液,分别用去离子水配制成上样质量浓度和体积分别为0.738mg/mL和16mL、1.476mg/mL和8mL、2.952mg/mL和4mL、5.903mg/mL和2mL的溶液,其余操作同1.3.4.1节,探讨上样质量浓度对AB-8动态吸附效果的影响,以确定最合适的上样质量浓度。
1.3.4.3 上样量的确定[17]
将预处理过的树脂湿法装柱(柱体积为60cm3),在上述确定的最适条件下,以1mL/min的流速连续上柱,每7mL收集一管,测定每管中总黄酮质量浓度随流出体积的变化。将流出液中总黄酮质量浓度达到入口浓度10%的点,作为柱子的穿透点,此时对应的上样量为最大上样量。以流出液累积体积为横坐标,流出液总黄酮质量浓度为纵坐标作图,绘制芦蒿秸秆总黄酮的泄露曲线。
1.3.5 AB-8大孔树脂动态解吸
1.3.5.1 乙醇体积分数对AB-8动态解吸效果的影响[18]
加入相同体积的上样液,在其他条件一致的情况下,分别用不同体积分数的乙醇溶液洗脱,比较不同体积分数乙醇溶液对AB-8解吸效果的影响,以确定最佳乙醇体积分数。
1.3.5.2 洗脱剂用量的确定[17]
将一定体积的上样液按最佳条件上柱后,用蒸馏水冲洗到流出液为无色,按最佳的乙醇体积分数洗脱,10mL/管收集,同时测定各个管中的总黄酮质量浓度,绘制芦蒿秸秆总黄酮的动态洗脱曲线。
1.3.6 AB-8柱纯化前后总黄酮纯度的比较[19]
按上述最佳条件进行AB-8柱层析实验,收集洗脱液,浓缩冻干,得到初步纯化产物,即芦蒿秸秆总黄酮粗品(简称黄酮粗品)。将上柱前芦蒿秸秆黄酮粗提物浓缩液冷冻干燥,得到黄酮粗提物。分别测定和计算总黄酮纯度。
1.3.7 AB-8纯化产物的初步鉴定
1.3.7.1 显色反应[20]
分别进行还原实验、金属盐类络合反应、碱性显色反应、硼酸显色反应,观察并记录实验现象。
1.3.7.2 紫外吸收光谱分析[21]
将纯化后的样品甲醇溶液在200~600nm进行紫外扫描,绘制“MeOH图谱”,观察特征吸收峰。
在黄酮类化合物溶液中加6滴AlCl3试剂,混合均匀后,进行紫外扫描,绘制“AlCl3图谱”,然后加入3滴HCl溶液,混合均匀,进行紫外扫描,绘制“AlCl3/HCl图谱”。
2 结果与分析
2.1 AB-8大孔树脂静态吸附和解吸动力学
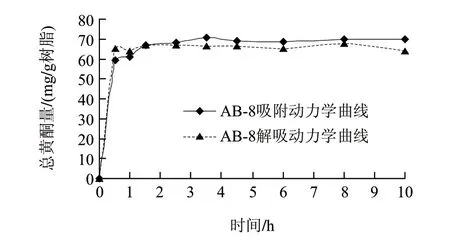
图 1 AB-8树脂的静态吸附及解吸动力学曲线Fig.1 Static adsorption and static desorption curves of AB-8 resin
由图1可知,0~3.5h内,随着吸附时间的延长,AB-8树脂吸附总黄酮量增加,1.5h已经基本达到吸附饱和,吸附量达67.14mg/g树脂,3.5h后达到饱和吸附量70.56mg/g树脂,说明AB-8树脂属于快速平衡型树脂。由解吸动力学曲线可知,在0.5h时,AB-8大孔树脂解吸量为65.43mg/g树脂,1.5h时达到最大解吸量66.77mg/g树脂。结果表明,AB-8树脂不仅具有较高的吸附量和解吸量,而且能快速地达到吸附平衡和解吸平衡,是富集纯化芦蒿秸秆总黄酮的理想树脂。
2.2 AB-8大孔树脂动态吸附
2.2.1 上样液pH值对吸附率的影响
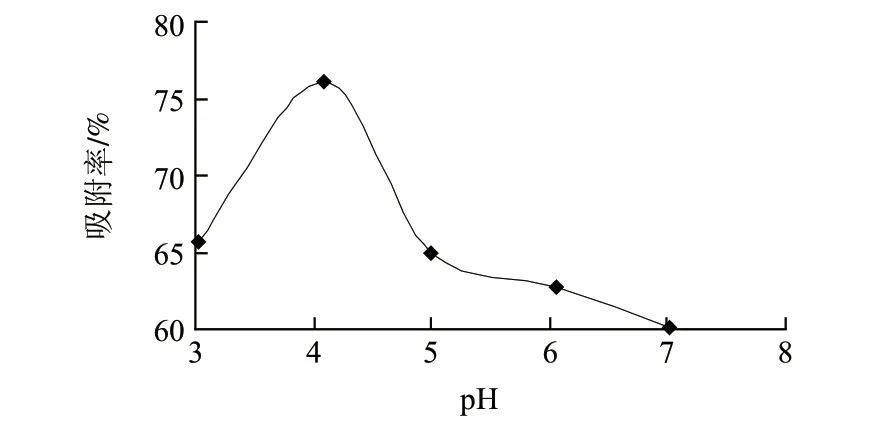
图 2 上样液pH值对吸附率的影响Fig.2 Effect of sample pH value on adsorption effi ciency
由图2可知,上样液pH值对树脂吸附性能影响较大,pH3.02时吸附率较低,这可能是由于黄酮类化合物在强酸环境条件下常转化为佯盐,不容易被吸附上,使得吸附率降低;吸附率在pH4.08时达到最大,但随着pH值的进一步增大,树脂的吸附容量反而下降,可能原因是黄酮类化合物带有酚羟基,呈弱酸性,故在微酸性条件下吸附较好。
2.2.2 上样液质量浓度对动态吸附量的影响
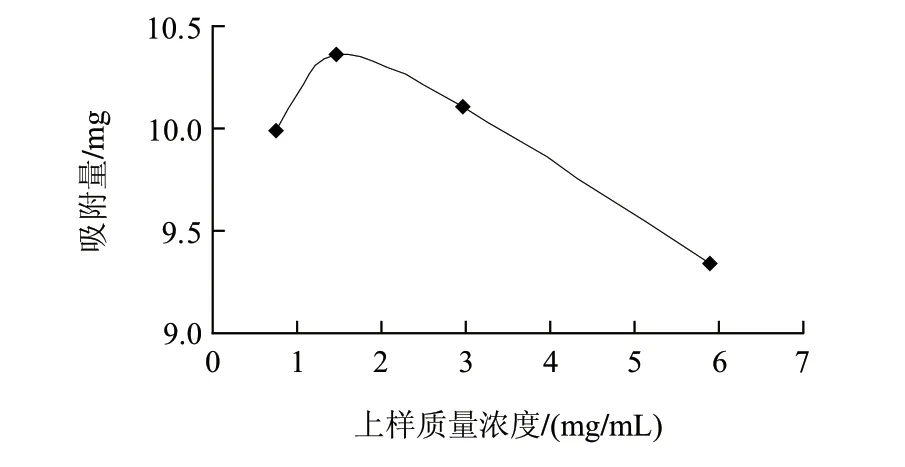
图 3 上样质量浓度对吸附量的影响Fig.3 Effect of sample concentration on adsorption effi ciency
由图3可知,随着上样液质量浓度增加,吸附量增大,当质量浓度增加到1.476mg/mL时吸附量最大,为10.36mg。当上样液质量浓度进一步增加时,吸附量已饱和,过高的样品质量浓度,反而会影响吸附效果,使得吸附量有所减少。这是因为总黄酮质量浓度较低时,提高总黄酮质量浓度可增加黄酮分子与树脂的接触,加速黄酮分子进入树脂内部并迅速扩散,但随着黄酮质量浓度的增大,与黄酮竞争吸附的杂质量也随之加大,影响黄酮分子在树脂内部的扩散,导致树脂吸附量有所下降。因此,最佳的上样质量浓度应控制在1.476mg/mL左右。
2.2.3 上样量的确定
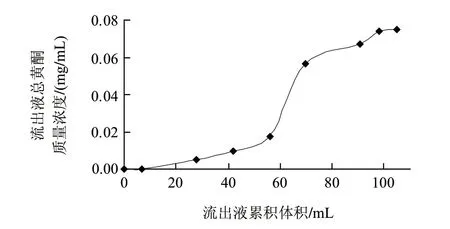
图 4 AB-8树脂泄漏曲线Fig.4 Leakage curve of AB-8 resin
由图4可知,当上柱液体积达到70mL时,芦蒿秸秆黄酮开始出现明显的泄漏。随着流出液体积的增加,流出液的总黄酮质量浓度逐渐增大,当流出液体积增至98mL时,泄漏曲线趋于平缓,即此时AB-8大孔树脂对芦蒿秸秆黄酮的动态吸附达到饱和,由此,可确定芦蒿秸秆黄酮提取液最大上柱体积为树脂体积的2.5倍。
2.3 AB-8大孔树脂动态解吸
2.3.1 乙醇体积分数对解吸率的影响
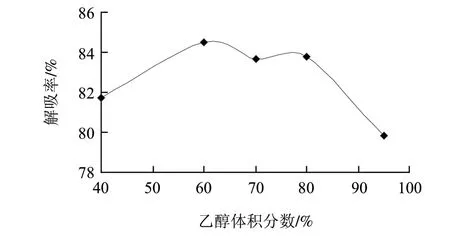
图 5 乙醇体积分数对动态解吸率的影响Fig.5 Effect of ethanol concentration on desorption effi ciency
由图5可知,乙醇体积分数在60%~80%时,对AB-8树脂解吸率影响不大,但乙醇体积分数过低或过高时,解吸率却明显下降,在乙醇体积分数达到60%左右时,解吸率最大,可能是由于体积分数为60%的乙醇的极性和芦蒿秸秆总黄酮的极性更加接近,根据相似相溶的原理,体积分数为60%乙醇的解吸率较高。
2.3.2 洗脱剂用量的确定
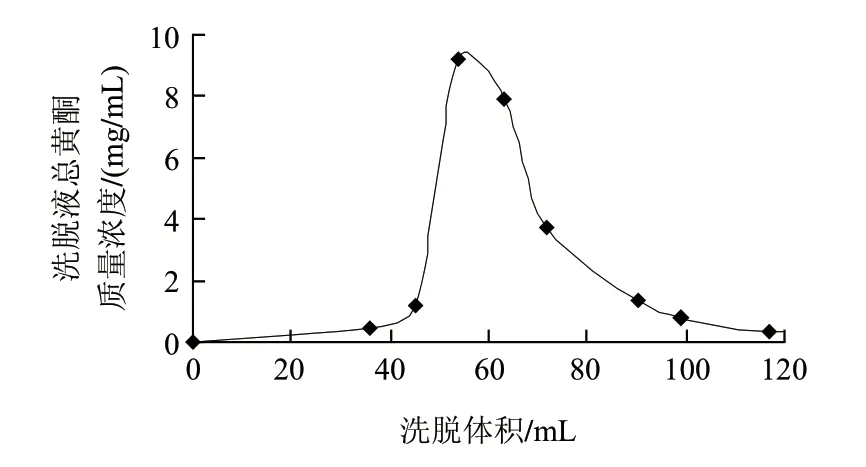
图 6 AB-8树脂动态洗脱曲线Fig.6 Dynamic elution curve of AB-8 resin
由图6可知,AB-8树脂对芦蒿秸秆黄酮有很好的洗脱能力。树脂上吸附的黄酮物质极易洗脱,洗脱峰比较集中,当洗脱体积为50~70mL时,洗脱液中的总黄酮含量最高。洗脱剂用量为1.5BV时,黄酮基本被完全洗脱,在此基础上,再增加洗脱剂用量,解吸量有所增加,但增幅很小。因此,从节约成本出发,宜以1.5~2.0BV左右的洗脱剂用量进行洗脱。
2.4 AB-8柱纯化前后总黄酮纯度的比较
经AB-8大孔树脂吸附、解吸后,总黄酮纯度由原来的5.80%变为30.26%,产品精制倍数为5.2倍,即产品纯度提高到5.2倍,说明AB-8树脂能够有效地对芦蒿秸秆总黄酮进行纯化。
2.5 AB-8纯化产物初步鉴定
2.5.1 显色反应
由表1可知,在盐酸-镁粉反应过程中,发现反应溶液由黄色逐渐变成红色,说明芦蒿秸秆含有黄酮类化合物。醋酸镁与双氢黄酮作用后,在紫外光条件下可呈现显著的蓝色荧光,而其他黄酮类化合物则呈黄色,结果(表1)表明,芦蒿秸秆含有双氢黄酮类化合物。黄酮化合物与铅盐反应会生成黄色或红色沉淀。沉淀色泽因羟基数目及位置不同而不同。其中,醋酸铅只能与分子中具有邻二酚羟基、3-羟基、4-酮基或5-羟基结构的化合物作用,芦蒿秸秆样品与铅盐反应有黄色沉淀生成,表明该提取物分子结构中极有可能含有邻二酚羟基(3-羟基、4-酮基或5-羟基)。与NaOH溶液作用后呈棕色,表明芦蒿秸秆中含有黄酮醇类。

表 1 芦蒿秸秆总黄酮的显色反应Table 1 Phenomena observed in the chromogenic reaction of total fl avonoids from
2.5.2 紫外吸收光谱分析
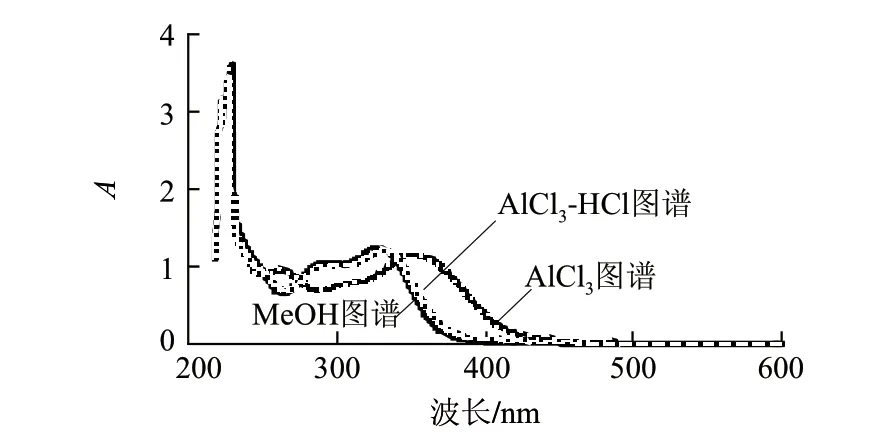
图 7 样品紫外-可见光谱图Fig.7 UV-visible adsorption spectrum of the purifi ed product
黄酮类化合物由2个主要吸收带组成,其中带Ⅰ在300~400nm区间,由B环桂皮酰系统产生,带Ⅱ在240~285nm区间,由A环苯甲酰系统产生。由图7可知,样品在229nm和328nm处有2个明显的吸收峰,可能是由于甲基化和糖基化导致吸收带向短波方向移动,致使样品紫外吸收带Ⅱ向短波方向移动,由于异黄酮、双氢黄酮和双氢黄酮醇的紫外光谱特征都具有强的带Ⅱ吸收,而带Ⅰ以带Ⅱ的肩峰或低强度吸收峰出现,推断芦蒿秸秆黄酮中可能含有黄酮醇、异黄酮、黄烷酮和双氢黄酮类。样品甲醇溶液加入试剂AlCl3后,带Ⅰ的最大吸收波长为351nm,加入HCl后带Ⅰ的最大吸收波长减小为331nm。加酸后移动减小,指示邻位双OH存在,具体结构还需进一步鉴定。
3 结 论
本研究对上样液pH值、上样质量浓度、乙醇体积分数及洗脱剂用量的确定等影响AB-8树脂纯化的因素进行了研究,得出芦蒿秸秆总黄酮纯化的最佳工艺条件为吸附液pH4.0,上样质量浓度1.476mg/mL,上样流速1mL/min,最大上柱体积为树脂体积的2.5倍,洗脱剂乙醇的体积分数为60%,洗脱流速1mL/min,最大洗脱体积为1.5~2.0BV左右。经纯化后,产品中总黄酮的纯度由5.80%增加到30.26%,提高到5.2倍,由此可见,AB-8树脂是芦蒿秸秆总黄酮良好的纯化剂,对芦蒿秸秆总黄酮有较高的吸附和解吸性能,适用于总黄酮的纯化研究。通过显色反应、紫外吸收特征光谱分析对纯化产物进行鉴定,得知芦蒿秸秆黄酮中可能含有黄酮醇、异黄酮、黄烷酮和双氢黄酮类,并且结构中有邻位双OH存在,具体结构还需进一步鉴定。
[1] 刘伟, 董加宝. 芦蒿的开发应用[J]. 中国食物与营养, 2006(7): 22-23.
[2] 邓丹雯, 郑功源, 方继平. 萎蒿黄酮提取方法研究[J]. 天然产物研究与开发, 2001, 13(6): 48-50.
[3] PENG Changlian, LIN Zhifang, LIN Guizhu, et al. The antiphotooxidation of anthocyanins-rich leaves of a purple rice cultivar[J]. Sci China Ser C, 2006, 49(6): 543-551.
[4] YAZAKI K, SUGIYAMA A, MORITA M, et al. Secondary transport as an efficient membrane transport mechanism for plant secondary metabolites[J]. Phytochem Rev, 2008, 7(3): 513-524.
[5] ULANOWSKA K, MAJCHRZYK A, MOSKOT M, et al. Assessment of antibacterial effects of fl avonoids by estimation of generation times in liquid bacterial cultures[J]. Biologia, 2007, 62(2): 132-135.
[6] WU Y, WANG F, ZHENG Q, et al. Hepatoprotective effect of total flavonoids from Laggera alata against carbon tetrachloride-induced injury in primary cultured neonatal rat hepatocytes and in rats with hepatic damage[J]. J Biomed Sci, 2006, 13(4): 569-578.
[7] ONOUE S, YAMAUCHI Y, KOJIMA T, et al. Analytical studies on photochemical behavior of phototoxic substances; effect of detergent additives on singlet oxygen generation[J]. Pharmaceut Res, 2008, 25(4): 861-868.
[8] ZHANG M, ZHANG J P, JI H T, et al. Effect of six flavonoids on proliferation of hepatic stellate cells in vitro[J]. Acta Pharmacol Sin, 2000, 21(3): 253-256.
[9] HUANG Bo, BAN Xiaoquan, HE Jingsheng, et al. Hepatoprotective and antioxidant activity of ethanolic extracts of edible lotus(Nelumbo nucifera Gaertn.) leaves[J]. Food Chem, 2010, 120(3): 873-878.
[10] 赵呈雷, 陈彦, 贾晓斌, 等. 萎蒿地上部分挥发油成分的气-质联用分析[J]. 中国药房, 2006, 17(3): 235-236.
[11] 吕丽爽, 黄健花, 周庆, 等. 芦蒿中黄酮类化合物提取工艺研究[J]. 食品工业科技, 2002(9): 48-49.
[12] 严建刚. 芹菜黄酮提取及其抗氧化与降血脂作用研究[D]. 杨凌: 西北农林科技大学, 2004.
[13] 林建委, 邵干辉. 山竹果壳黄酮的抗氧化性及在卷烟中应用效果初探[J]. 现代食品科技, 2011, 27(7): 816-849.
[14] LÜ Lishuang, TANG Jian, HO C T. Selection and optimization of macroporous resin for separation of stilbene glycoside from Polygonum multifl orum Thumb.[J]. Journal of Chemical Technology & Biotechnology, 2008, 83(10): 1422-1427.
[15] 杨乐, 王洪新, 秦晓娟. 大孔树脂纯化笋壳中的黄酮物质[J]. 食品与生物技术学报, 2011, 30(2): 218-223.
[16] 曾永长, 梁少瑜, 邢学峰, 等. 白花蛇舌草总黄酮的大孔吸附树脂纯化工艺[J]. 中国实验方剂学杂志, 2010, 16(18): 26-29.
[17] 陈蕉黎, 黎云祥, 陈光登, 等. 大孔吸附树脂分离纯化娥嵋岩白菜叶总黄酮[J]. 食品科学, 2010, 31(6): 74-79.
[18] 焦岩, 王振宇. 大孔树脂纯化大果沙棘果渣总黄酮的工艺研究[J]. 食品科学, 2010, 31(16): 16-20.
[19] 贺波. 苎麻叶黄酮的提取、分离纯化、结构及抗氧化活性的研究[D]. 武汉: 华中农业大学, 2010.
[20] 徐宗海. 达乌里胡枝子中黄酮类成分的研究[D]. 杨凌: 西北农林科技大学, 2010.
[21] 尚久方, 胡华强. 黄酮类化合物结构鉴定技术[M]. 北京: 科学出版社, 1990.
