枯草芽孢杆菌角蛋白酶kerC基因在毕赤酵母中的高效表达
2013-12-23韩学易唐自钟王丽华
韩学易,唐自钟,王丽华,陈 惠*
(四川农业大学生命科学与理学院,四川 雅安 625014)
角蛋白是一种具有极强抗性难降解的硬蛋白,主要存在于动物的毛发、羽毛及鳞片等组织中,其化学结构稳定,难以被一般的蛋白酶所降解[1-2],这样极大地阻碍了角蛋白资源的有效利用。角蛋白酶具有降解天然角蛋白的特性,可专一地降解角蛋白[3-4],使其在食品、医药、饲料和制革等工业中得到广泛应用,并可降解疯牛病和人类克雅氏症的Prion蛋白[5-6],成为目前研究热点,应用价值巨大。近年来,能够分泌角蛋白酶的菌株被陆续分离鉴定,具有潜在应用价值的基因被陆续克隆表达[7-9]。在角蛋白酶基因的表达研究中,巴斯德毕氏酵母表达系统有胞外分泌型,根据外源蛋白特性选择合适的表达菌株和载体,可以实现外源蛋白的高效表达[10-11],并且操作简单,表达水平稳定,易于工业化生产。
目前角蛋白酶的研究主要集中在菌种筛选、酶学性质等方面,已经报道的角蛋白酶表达菌株活性相对较低,大规模生产应用未见报道。本实验室前期已筛选出产角蛋白酶的枯草芽孢杆菌B-3,成功克隆角蛋白酶基因kerC,构建了大肠杆菌表达载体BL21-pET-kerC,实现其在大肠杆菌BL21中的异源表达,但酶活力提高并不明显。本研究将角蛋白酶基因kerC构建于表达载体pPICZαA上,电击转入毕氏酵母X-33,实现其在真核表达系统中的高效表达,以期为进一步角蛋白酶的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherichia coli)DH5α、毕赤酵母(Pichia pastoris)X-33、质粒pET-kerC和克隆载体、pPICZαA 美国Invitrogen公司;pMD19-T Simple Vector 宝生物工程(大连)有限公司。
各种DNA限制性内切酶、T4 DNA连接酶、DNA和蛋白质分子质量标准品 宝生物工程(大连)有限公司;Taq DNA聚合酶 天根生化科技有限公司;DNA胶回收试剂盒 上海Omega生物技术有限公司;其他常规试剂均为国产分析纯或进口分装;引物由上海英骏生物技术有限公司合成。
大肠杆菌培养采用LB培养基,转化子筛选用氨苄青霉素抗性和博莱霉素抗性,终质量浓度分别为100、25μg/mL;酵母培养用YPD培养基和BMGY培养基,产酶培养基为BMMY培养基。
1.2 仪器与设备
MyCyclerTM PCR仪、电穿孔仪、GelDoc凝胶成像系统 美国Bio-Rad公司;D-37520高速冷冻离心机 美国Thermo公司;UV-2450紫外-可见分光光度计 日本岛津公司;DK-8D电热恒温水浴锅 上海精宏实验设备有限公司。
1.3 角蛋白酶基因kerC片段的扩增
由角蛋白酶基因kerC序列,设计PCR扩增特异引物,Up:5'-CCGGAATTCGCCGGAAAAAGCAGTACAGA-3’,下划线为EcoRⅠ酶切位点,Down:5’-AGGTCTAGATT ATTGTGCAGCTGCTTGTAC-3’,下划线为XbalⅠ酶切位点。
1.4 角蛋白酶基因kerC重组表达载体的构建
利用XbalⅠ和EcoRⅠ双酶切得到的kerC基因片段,连接到经相同双酶切处理的表达载体pPICZαA,得到重组表达质粒,线性化后电击转化毕赤酵母X-33,挑取Zeocin抗性筛选得到的阳性转化子,扩大培养,提取总DNA,并以总DNA为模板,用通用引物进行PCR筛选鉴定阳性转化子。
1.5 重组角蛋白酶的SDS-PAGE分析
将重组菌株接种于BMGY培养基,于30℃、200r/min振荡培养24h后作为种子液接入BMMY诱导培养基,每隔24h添加甲醇使甲醇的终体积分数为1%,108h后离心收集上清即为粗酶液。将粗酶液透析浓缩后,用DEAE纤维素阴离子柱纯化,收集有酶活力的洗脱峰,经透析浓缩后作为SDS-PAGE上样液。电泳时制备12%的分离胶和5%的浓缩胶进行,同时点上粗酶液和空质粒对照组进行SDS-PAGE分析。
1.6 重组角蛋白酶活力测定
参考Vermelho等[12]方法,并作改进:取1mL发酵液上清,加入2mL Tris-HCl缓冲液配制的羽毛粉底物,于50℃恒温振荡水浴锅中反应1h,加入2mL 20%三氯乙酸(TCA)终止反应,4℃、10000r/min离心5min,在波长280nm处测定上清液吸光度。以灭活酶液作为对照。酶活力单位(U)定义:在以上反应条件下,吸光度每增加0.10为1U。
1.7 重组菌株产酶条件优化
1.7.1 甲醇诱导体积分数对产酶的影响
将角蛋白酶重组菌接种到不同甲醇体积分数(0.5%、0.7%、1.0%、1.5%、2.0%)的BMMY诱导培养基中,每隔24h加入甲醇使其达到相应体积分数, 108h后取上清液测其酶活力。
1.7.2 诱导时间对产酶的影响
将角蛋白酶重组菌接种到BMMY诱导培养基,按1.0%甲醇进行诱导培养,分别在不同时间(72、84、96、108、120、132h)收集上清测定酶活力。
1.8 重组角蛋白酶的酶学性质分析
1.8.1 重组角蛋白酶作用的最适温度和热稳定性
分别在不同温度(30、40、50、55、60、65、70、80℃)条件下测定重组角蛋白酶活力,并在以上温度条件下将重组角蛋白酶保温30min后于50℃反应1h测定剩余酶活力分析其热稳定性。
1.8.2 重组角蛋白酶作用的最适pH值和pH值稳定性
在不同pH值(4.0、5.0、6.0、7.0、7.5、8.0、8.5、9.0、10.0)条件下分析重组角蛋白酶活力变化,将该酶分别在以上pH值环境条件下保温30min后测定酶活力分析其pH值稳定性。
1.8.3 金属离子对重组角蛋白酶作用的影响
在含有3mmol/L不同金属离子的环境中,测定重组角蛋白酶的酶活力,以未加金属离子的酶活力为100%。
2 结果与分析
2.1 角蛋白酶基因的克隆及表达载体的构建
以质粒pET-kerC为模板,高保真酶扩增kerC基因序列,将其连接T载体后,转化大肠杆菌DH5α,经菌落PCR筛选阳性转化子。将质粒pPICZαA与T-kerC同时进行XbalⅠ和EcoRⅠ双酶切,回收、连接,转化大肠杆菌DH5α,菌落PCR和酶切鉴定结果。如图1表明,kerC基因成功连接到表达载体pPICZαA,命名为pPICZαAkerC。将重组表达载体线性化后,电转毕赤酵母X-33,经含Zeocin抗性的YPD平板筛选,以总DNA为模板,用通用引物进行PCR扩增后,经1%琼脂糖凝胶电泳分析其条带大小为1000bp左右即为阳性转化子。电泳结果表明表达载体pPICZαA-kerC成功转入到毕赤酵母X-33中。
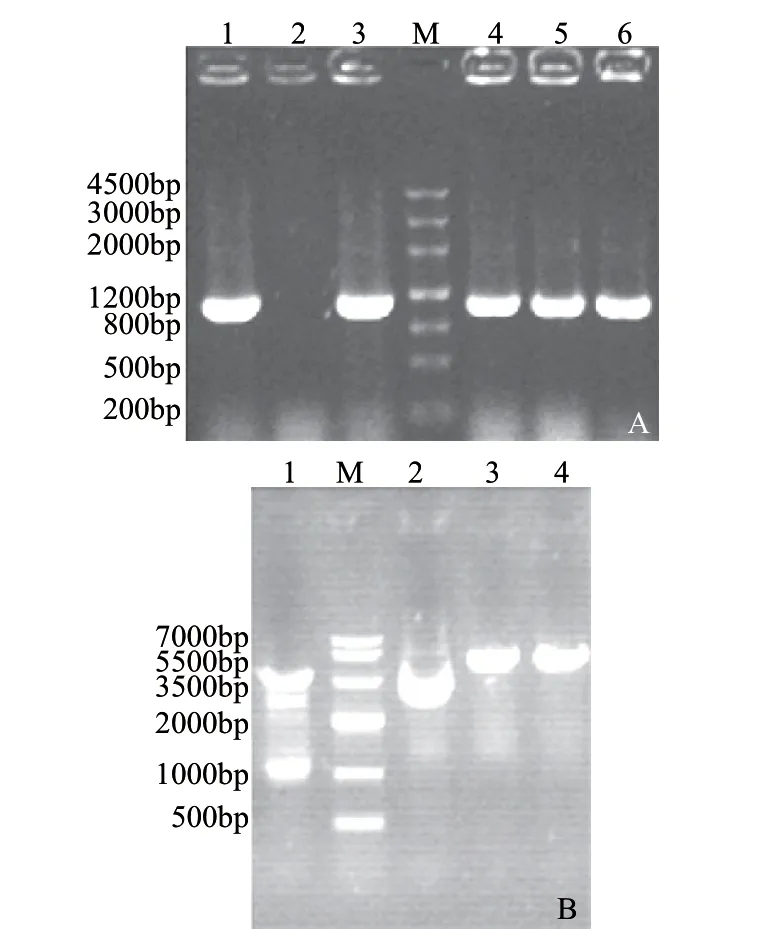
图 1 菌落PCR鉴定(A)和表达载体pPICZαA-kerC的酶切分析(B)Fig.1 PCR identification of colonies (A) and restriction enzyme analysis of plasmid pPICZαA-kerC (B)
2.2 角蛋白酶基因的诱导表达
2.2.1 甲醇诱导体积分数对产酶的影响
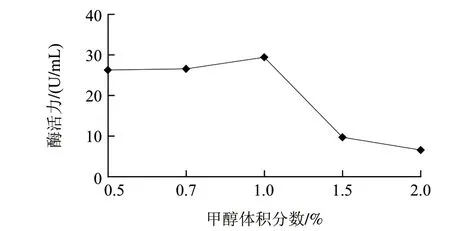
图 2 不同体积分数甲醇诱导下角蛋白酶的活性Fig.2 Effect of methanol concentration on keratinase activity
由图2可知,当甲醇诱导体积分数为1%时酶活力达到最大,甲醇体积分数超过1%时,随着甲醇体积分数的升高,酶活力迅速下降。因此,重组酶最佳甲醇诱导体积分数为1%。
2.2.2 诱导时间对产酶的影响
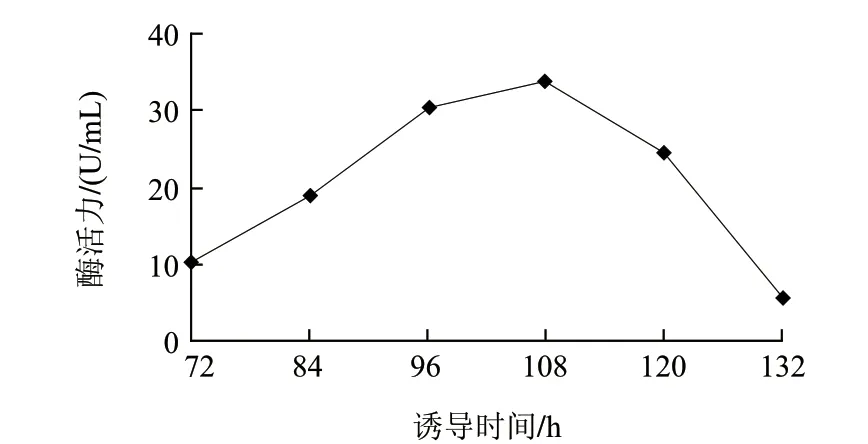
图 3 不同时间诱导下角蛋白酶的活性Fig.3 Effect of induction time on keratinase activity
由图3可知,随着诱导时间的延长,角蛋白酶活力不断升高。当诱导培养时间达到108h时,酶活力达到最大,其后随着时间的延长,酶活力逐渐降低,108h为重组酶产酶最佳诱导时间。

图 4 重组角蛋白酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the recombinant keratinase
2.2.3 SDS-PAGE分析经DEAE-纤维素柱层析纯化后的重组角蛋白酶进行SDS-PAGE分析。由图4可知,重组酶分子质量约31kD,与经ExPASy Proteomics Server软件对重组角蛋白酶的氨基酸序列进行分子质量预测值接近(36.1kD)。
2.3 重组角蛋白酶的性质分析
2.3.1 重组角蛋白酶作用的最适温度和热稳定性
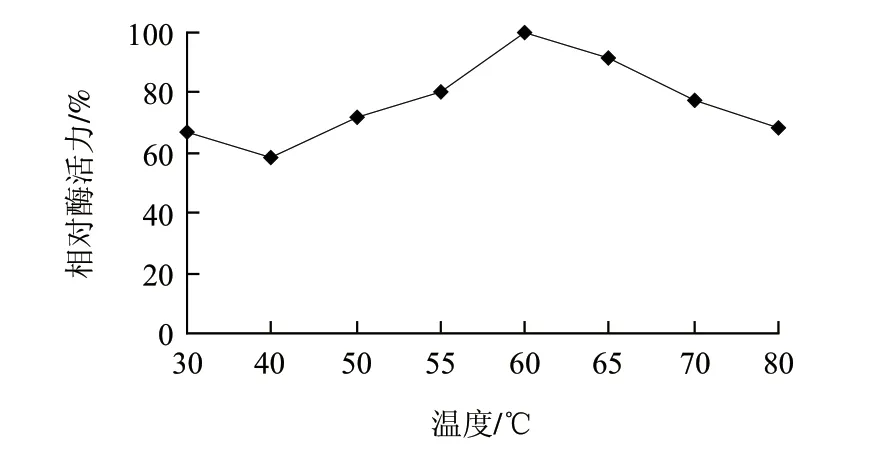
图 5 温度对重组角蛋白酶活力的影响Fig.5 Effect of temperature on activity of the recombinant keratinase
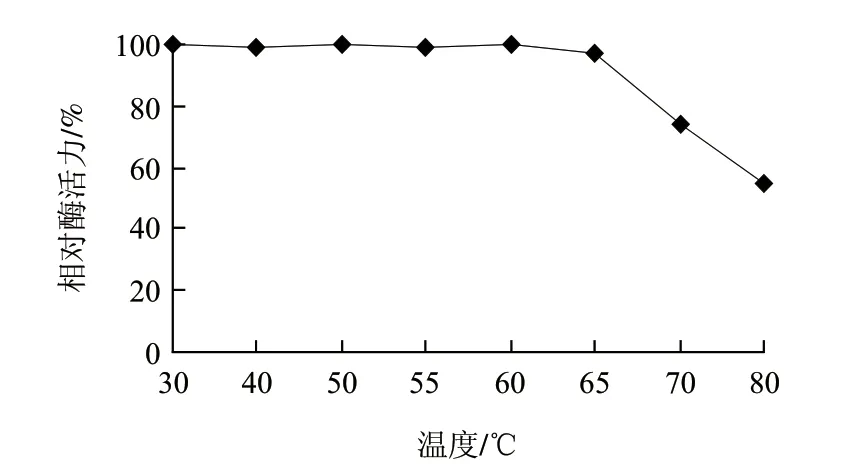
图 6 重组角蛋白酶的热稳定性Fig.6 Temperature stability of the recombinant keratinase
由图5可知,在不同温度条件下测定重组角蛋白酶酶活力,结果表明其最适反应温度为60℃。将重组角蛋白酶保温30min后测定剩余酶活力,由图6可知,重组角蛋白酶在30~65℃范围内具有较高的热稳定性,高于65℃时酶活力开始下降,但在80℃时仍能达到最高酶活力的50%。
2.3.2 重组角蛋白酶作用的最适pH值和pH值稳定性
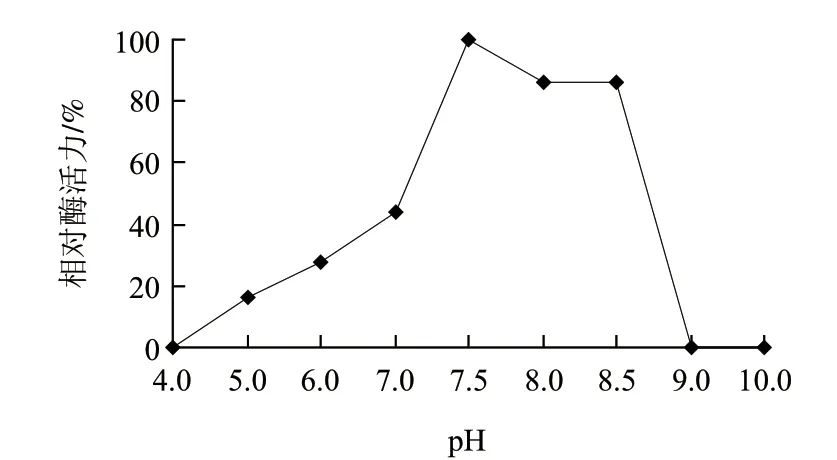
图 7 不同pH值条件下重组角蛋白酶的酶活力Fig.7 Effect of pH on activity of the recombinant keratinase
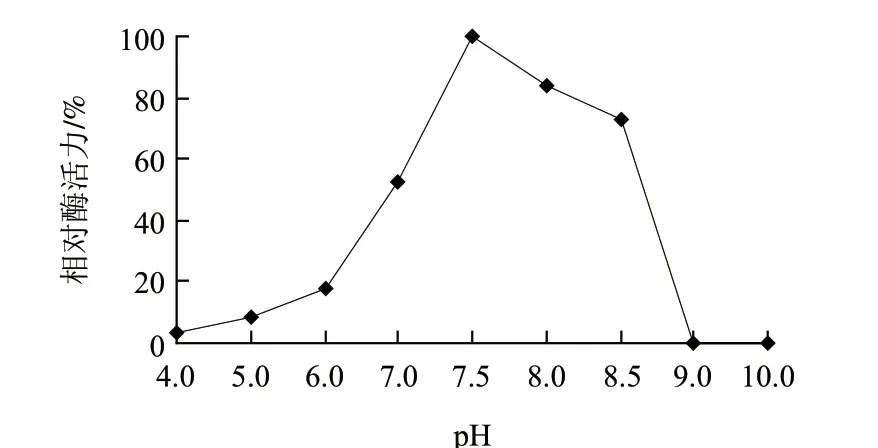
图 8 重组角蛋白酶的pH值稳定性 Fig.8 pH stability of the recombinant keratinase
由图7可知,重组角蛋白酶最适反应pH值为7.5。由图8可知,重组角蛋白酶在pH7.0~8.5的范围内比较稳定,高于pH8.5,酶迅速失活。
2.3.3 金属离子对重组角蛋白酶活力的影响
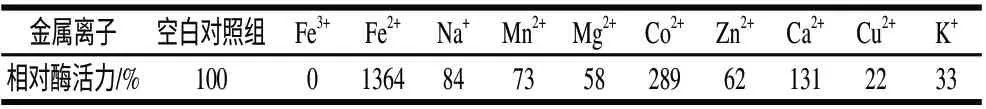
表 1 不同金属离子对重组角蛋白酶活力的作用Table 1 Effect of different metal ions on activity of the recombinant keratinase
在含有不同金属离子的环境中,测定重组角蛋白酶的酶活力,由表1可知,Ca2+、Co2+和Fe2+均可提高角蛋白酶的活力,在3mmol/L离子浓度反应条件下,酶活力分别提高0.31倍、1.89倍和12.64倍。Na+、Zn2+、Mn2+、K+、Cu2+和Mg2+对重组角蛋白酶活力有不同程度的抑制作用,而Fe3+完全抑制其酶活力。
3 讨 论
目前,已有很多能产角蛋白酶的微生物被报道,角蛋白酶基因相继被克隆,并且实现了异源表达,但表达量不高,酶活力相对较低。Lin等[13]将角蛋白酶kerA基因转入B.subtilis菌株DB104中,转化子FDB-29的角蛋白酶产量仅提高了3~5倍;Porres等[7]将Bacillus licheniformis PWD-1的kerA基因克隆到pPICZαA和pGAPZαA载体上,转化毕赤酵母X-33,转化子经甲醇诱导,144h后产酶量为124mg/L;季金殿等[14]克隆了嗜麦芽窄食单胞茵S. maltophilia YHJ-1基因kerD,实现了在大肠杆菌中的表达,酶活力为10.5U/mL。本研究从枯草芽孢杆菌B-3中克隆得到角蛋白酶基因kerC,构建了重组表达载体pPICZαA-kerC,转化巴斯德毕赤酵母X-33,重组菌株以1%体积分数的甲醇诱导培养108h后,酶活力达到32.31U/mL,是原核表达菌株BL21-pET-kerC的11.15倍,表达效果优于前述报道,成功实现了角蛋白酶的异源高效表达,为角蛋白酶的工业化生产奠定基础及提供依据。
已报道的角蛋白酶分子质量在16~440kD[15]范围,大多数是30kD左右,最适pH值是pH7.5~l0.0,最适温度范围在30~75℃,多数在45~55℃[15],不同来源的角蛋白酶酶学性质有一定差异。赖欣等[16]报道的角蛋白酶最适反应温度和最适反应pH值分别为55℃和7.0,pH5.5~8.0时酶活力较稳定,可达最大酶活力的70%以上;邹晓凤等[17]研究的角蛋白酶kerF分子质量为50kD,最适作用pH值和最适作用温度分别为pH9.0和50℃;Radha等[18]报道的角蛋白酶分子质量大小分别为30kD和39kD,最适作用pH值和最适作用温度分别为8.0和70℃;Cao Zhangjun等[19]纯化得到的角蛋白酶分子质量约为35.2kD,最适作用pH值和最适作用温度分别为7.8和40℃。本研究重组角蛋白酶kerC分子质量约为31kD,最适反应温度和最适反应pH值分别为60℃和7.5,在30~65℃范围内具有较高的热稳定性,80℃保温30min后剩余酶活力仍达到最高酶活力的50%;在pH7.0~8.0范围内能保持最高酶活力的80%以上,中性和弱碱性的条件下具有较好的pH值稳定性。
微量金属离子在一定程度上能增强或抑制角蛋白酶的酶活力。Li Jiang等[20]报道在1mmol/L Cu2+环境中,角蛋白酶sfp2活力增强49.4%,在1mmol/L Co2+、Fe2+和Ca2+环境中,酶活力受到一定程度的抑制。Lü Longxian等[21]报道1mmol/L的Co2+、Zn2+能增强Chryseobacterium L99角蛋白酶活力,但Ca2+、Fe3+对其活力有抑制作用。Balaji等[22]报道5mmol/L的Mn2+、Ca2+、Zn2+能显著提高Bacillus subtilis MTCC(9102)角蛋白酶活力,但酶活力受到5mmol/L的Cu2+抑制。可见,相同的金属离子作用不同来源的角蛋白酶,其结果存在差异。在本研究中,在3mmol/L离子环境中,Ca2+、Co2+和Fe2+可以增强重组角蛋白酶活力,而Fe3+却完全抑制重组角蛋白酶活力,Na+、Zn2+、Mn2+、K+、Cu2+和Mg2+能在不同程度上抑制其酶活力。
本研究成功实现了枯草芽孢杆菌角蛋白酶基因的高效表达,为该基因的进一步研究和应用奠定了良好的基础,实验室期望通过进一步完善发酵和分离纯化工艺,以及采用高密度发酵培养等技术,以最大化提高角蛋白酶的产量和活性,使其能最终应用于工业化生产。
[1] PARRY D A, NORTH A C. Hard α-keratin intermediate filament chains: substructure of the N- and C-terminal domains and the predicted structure and function of the C-terminal domains of typeⅠand typeⅡ chains[J]. Journal of Structural Biology, 1998, 122: 279-290.
[2] WILLIAMS C M, RICHTER C S, MACKENZIE J M, et al. Isolation, identification, and characterization of a feather-degrading bacterium[J]. Applied and Environmental Microbiology, 1990, 56(6): 1509-1515.
[3] KIM J M, LIM W J, SUH H J. Feather-degrading Bacillus species from poultry waste[J]. Process Biochemistry, 2001, 37(3): 287-291.
[4] RIFFEL A, LUCAS F, HEEB P, et al. Characterization of a new keratinolytic bacterium that completely degrades native feather keratin[J]. Archives of Microbiology, 2003, 179(4): 258-265.
[5] 李明珠, 王雁萍, 秦广雍. 角蛋白酶的研究现状及发展前景[J]. 安徽农业科学, 2010, 38(4): 1689-1692.
[6] 蔡成岗, 郑晓冬. 角蛋白酶的来源、理化性质与生物工程研究进展[J]. 食品与发酵工业, 2006, 32(4): 111-114.
[7] PORRES J M, BENITO M J, LEI X G. Functional expression of keratinase (kerA) gene from Bacillus licheniformis in Pichia pastoris[J]. Biotechnology Letters, 2002, 24(8): 631-636.
[8] WANG J J, ROJANATAVORN K, SHIH J C. Increased production of Bacillus keratinase by chromosomal integration of multiple copies of the kerA gene[J]. Biotechnology and Bioengineering, 2004, 87(4): 459-464.
[9] LIN H H, YIN Lijung, JIANG Shanntzong. Cloning, expression, and purification of Pseudomonas aeruginosa keratinase in Escherichia coli AD494 (DE3) pLysS expression system[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 3506-35l1.
[10] SUE M P, MARIANA L F, BRIAN M, et al. Heterologous protein production using the Pichiapastoris expression system[J]. Yeast, 2005, 22: 249-270.
[11] 余祖华, 王红宁. 利用巴斯德毕赤酵母表达外源蛋白的研究进展[J]. 生物技术通报, 2004, 15(6): 614-616.
[12] VERMELHO A B, MAZOTTO A M, de MELO A C N, et al. Identification of a Candida parapsilosis strain producing extracellular serine peptidase with keratinolytic activity[J]. Mycopathologia, 2010, 169(1): 57-65.
[13] LIN X, WONG S L, MILLER E S, et al. Expression of the Bacillus licheniformis PWD-1 keratinase gene in B.subtilis[J]. Journal of Industrial Microbiology & Biotechnology, 1997, 19(2): 134-138.
[14] 季金殿, 牛钟相, 刘湛冰, 等. 嗜麦芽窄食单胞菌S.maltophilia YHJ-1角蛋白酶基因的克隆表达及活性鉴定[J]. 中国饲料添加剂, 2011, 114(12): 24-28.
[15] 杨珊, 刘孟华, 吴重德, 等. 角蛋白酶应用研究现状及展望[J]. 四川食品与发酵, 2006(4): 1-4.
[16] 赖欣, 陈惠. 短小芽孢杆菌B-15产酶条件的优化及酶学性质的研究[J]. 中国饲料, 2008(15): 39-43.
[17] 邹晓凤, 岳寿松, 宋爱荣, 等. 嗜麦芽窄食单胞菌角蛋白酶基因(KerF)的克隆及其在大肠杆菌中的表达[J]. 农业生物技术学报, 2011, 19(2): 363-368.
[18] RADHA S, GUNASEKARAN P. Purification and characterization of keratinase from recombinant Pichia and Bacillus strains[J]. Protein Expression and Purification, 2009, 64(1): 24-31.
[19] CAO Zhangjun, ZHANG Qi, WEI Dongkai, et al. Characterization of a novel Stenotrophomonas isolate with high keratinase activity and purification of the enzyme[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(2): 181-188.
[20] LI Jiang, SHI Pengjun, HAN Xiaoyu, et al. Functional expression of the keratinolytic serine protease gene sfp2 from Streptomyces fradiae var. k11 in Pichia pastoris[J]. Protein Expression and Purification, 2007, 54(1): 79-86.
[21] LÜ Longxian, SIM M H, LI Yudong, et al. Production, characterization and application of akeratinase from Chryseobacterium L99 sp. nov.[J]. Process Biochemistry, 2010, 45(8): 1236-1244.
[22] BALAJI S, SENTHIL KUMAR M, KARTHIKEYAN R, et al. Purification and characterization of an extracellular keratinase from a hornmeal-degrading Bacillus subtilis MTCC (9102)[J]. World Journal of Microbiology and Biotechnology, 2008, 24(11): 2741-2745.
