小米米糠中抗癌细胞增殖活性蛋白的分离纯化
2013-12-23单树花武海丽李宗伟袁琳洁赵文彬刘庆午郭茂林李卓玉
单树花,武海丽,李宗伟,袁琳洁,赵文彬,刘庆午,郭茂林,李卓玉,*
(1.山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006;2.太原师范学院生物系,山西 太原 030031)
肿瘤是危害人类健康的严重疾病之一。虽然肿瘤的治疗取得了很大的进展,但抗癌化学药物在治疗癌症的同时,对人体本身也会产生很大的毒副作用。很多病人在治疗后复发或转移,或因反复用药产生耐药性。因此,寻找疗效高、毒性低的天然抗癌成分,一直是国内外医学界研究的热点。大量研究表明,许多天然产物中含有低毒、高效的抗肿瘤活性成分,如黄酮、生物碱类、挥发油类、萜类、苷类等一些小分子物质[1]。近年来随着分子生物学、分子肿瘤学、现代提取分离和分析测试技术的发展,一些抗肿瘤的活性多肽,如:大米米糠和苦瓜中的多肽[2-5]和一些植物蛋白(如:辽东楤木[6]、毛蚶[7]、桑黄菌[8])已经从天然产物中筛选出来,这对抗肿瘤药物的研究和开发具有重要的意义。
谷子,即小米或粟(Setaria italica),英文名(foxtail millet),一年生禾本科属植物,起源于我国黄河流域。小米米糠是小米经垄谷脱壳,碾米等加工成精米过程中得到的副产品。小米米糠中含有丰富的甘油三酯、脂蛋白、谷维醇、VB、VE、葡萄糖、纤维素以及微量元素等,能够排出人体内的毒素,有健脑、补肾、强身、抗癌等作用,经常食用小米米糠,可以增强人体的免疫功能,防病健身[9]。目前由于小米米糠的口感不佳,主要被用作饲料,或被作为废弃物处理,所以小米米糠资源的深度开发和有效利用将会带来很高的经济和社会价值。根据现有文献报道,目前国内外关于小米米糠的研究主要集中在其化学成分和营养价值方面[10],而未见关于小米米糠抗肿瘤活性蛋白的报道。本研究中, 以纯天然小米米糠为原料,制备并纯化小米米糠中的有效活性蛋白,并对其抗肿瘤细胞活性进行研究,从而为抗肿瘤药物的开发提供实验依据,同时也促进小米米糠的深度开发和这一资源的有效增值利用。
1 材料与方法
1.1 材料、试剂与仪器
小米米糠(Setaria italica)由山西省天下谷股份有限公司提供。
人结肠癌细胞系DLD1、人宫颈癌细胞株HeLa、和人正常肝细胞株HL-7702,购自中国科学院上海生命科学研究院细胞资源中心。
改良型RPMI-1640培养基 美国Thermo Scientific Hyclone公司;无支原体胎牛血清 武汉博士德生物工程有限公司;噻唑蓝(MTT) 北京索莱宝科技有限公司;二甲基亚砜(DMSO) 美国Amresco公司;胰蛋白酶 北方同正公司;青链霉素(100X) 碧云天生物技术研究所;Protein Marker 生工生物工程(上海)股分有限公司;苯甲酰-DL-Arg-P-硝基酰替苯胺盐酸盐(BAPA) 上海三杰生物技术有限公司;培养细胞荧光染色凋亡显示试剂盒 北京威格拉斯生物技术有限公司;Q柱和SP柱介质材料 美国GE公司;其他化学试剂均为进口分装或国产分析纯试剂。
5417离心机 德国Eppendorf公司;756MC型紫外-可见分光光度计 上海光谱仪器有限公司;Milli-QA10超纯水仪、超滤管 美国Millipore公司;微量Gilson加样器 法国Gilson公司;凝胶电泳仪、Microplate Reader Model 550酶联免疫检测仪 美国Bio-Rad公司;inoLad Multi 720酸度计 德国WTW公司;CO2细胞培养箱 美国Thermo公司;细胞培养板 美国Hyclone公司;倒置显微镜 日本Olympus公司。
1.2 方法
1.2.1 小米米糠粗蛋白的制备及纯化
取30g干燥的谷糠,粉碎,按1:5(m/V)的量加入蛋白提取液(20mmol/L Tris-HCl,含0.85% NaCl,1mmol/L 苯甲基磺酰氟(PMSF),pH8.0),4℃条件下放置过夜,11000r/min离心30min,取上清,加入2倍体积的-20℃预冷的丙酮,于-20℃沉淀1h,11000r/min离心30min,弃上清,沉淀在-20℃条件下放置20min,使丙酮完全挥发。将沉淀用pH8.0、20mmol/L的Tris-HCl缓冲液溶解,11000r/min离心30min,取上清即为小米米糠粗蛋白。向上清液中先加入30%饱和度的硫酸铵粉末溶解后,静置30min,11000r/min离心,收集上清液,再向上清液中加入85%饱和度的硫酸铵粉末溶解后,静置30min,11000r/min离心,收集沉淀,用Tris-HCl缓冲液溶解、透析、浓缩即得到小米米糠中抗肿瘤粗蛋白。
将小米米糠抗肿瘤粗蛋白进行Q-阴离子交换层析,收集穿透液;再将穿透液进行SP-阳离子柱交换层析,先用40mmol/L的Tris-NaCl缓冲液(pH8.0,20mmol/L的Tris-HCl缓冲液中含有40mmol/L的NaCl)洗脱,去杂蛋白;再用100mmol/L的Tris-NaCl缓冲液(pH8.0,20mmol/L的Tris-HCl缓冲液中含有100mmol/L的NaCl)洗脱,紫外检测仪于280nm波长检测,收集洗脱峰,将此洗脱液在80℃水浴中孵育15min热变性法进一步去杂蛋白,即得到具有抗肿瘤的小米米糠活性纯蛋白。
1.2.2 蛋白质量浓度的测定
采用考马斯亮蓝染色法对样品的蛋白质量浓度进行测定。以1mg/mL的牛血清白蛋白(BSA)配成0、0.2、0.4、0.6、0.8、1.0mg/mL的蛋白质量浓度梯度,在595nm波长处测定溶液的吸光度,以A595nm为横坐标,标准蛋白含量为纵坐标,绘制标准曲线。取样品20μL进行测定。
1.2.3 蛋白质表观分子质量的测定
采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)法测定蛋白质的表观分子质量,12%分离胶,进行恒压电泳,浓缩胶的电压为60~80V,分离胶的电压为80~120V。
1.2.4 细胞培养
人结肠癌细胞系DLD1、人宫颈癌细胞株HeLa和人正常肝细胞株HL-7702均培养于含10%胎牛血清(含100U/mL青链霉素)的RPMI-1640培养基中,置于5% CO2、37℃的培养箱中培养。
1.2.5 细胞增殖实验
采用MTT法。选取对数生长期的细胞,经胰酶消化后,用血球计数板计数。调整细胞浓度为每孔8000个细胞/100μL培养液,加到96孔培养板中。37℃、5% CO2培养箱中过夜培养。待细胞贴壁后取出培养板,加入不同质量浓度的小米米糠纯蛋白20μL,使其终质量浓度分别为0.025、0.05、0.075、0.1μg/μL,每个浓度设5个平行孔。培养板放回培养箱中继续培养48h,取出培养板,每孔加入20μL 5.0mg/mL MTT,继续培养4h,吸去板中培养液,每孔加入150μL的DMSO,振荡均匀,于波长570nm处测定各孔光吸光度。

1.2.6 细胞形态学实验
常规方法培养、传代各细胞,采用血球计数板进行计数,调整细胞浓度为8×104个/孔(每孔1mL),接种到30mm×30mm的小皿中,待细胞贴壁后,吸掉旧培养基,加入1mL新鲜培养基和200μL的 0.1μg/μL小米米糠蛋白,处理48h,在激光共聚焦扫描显微镜下观察并扫描细胞核的形态(×60),照相。
1.2.7 数据整理
2 结果与分析
2.1 小米米糠中抗肿瘤活性蛋白的分离纯化

表 1 FMB蛋白的分离纯化Table 1 Purification of FMB protein

图 1 SDS-PAGE电泳显示目的蛋白的分离纯化Fig.1 SDS-PAGE analysis of the purified target protein
上图各个泳道显示了小米米糠蛋白的纯化过程。首先采用丙酮沉淀法提取该小米米糠粗蛋白(泳道1),随后用30%~85%饱和度的硫酸铵沉淀活性蛋白组分(泳道2),再将该组分过Q-阴离子交换层析柱,发现活性蛋白成分在穿透液里(泳道3)。将上述穿透液上样于SP-阳离子交换层析柱,先用pH8.0、40mmol/L NaCl的Tris-HCl缓冲液洗柱,洗掉杂蛋白,再用pH8.0 100mmol/L NaCl的Tris-HCl缓冲液洗柱,收集此洗脱峰,即为具抗肿瘤活性的蛋白(泳道4),最后将该蛋白在80℃的水浴中孵育15min热变性法进一步去杂蛋白,得到电泳纯的活性蛋白(泳道5),其表观分子质量约为35kD左右,将该蛋白命名为FMB。
2.2 小米米糠中抗肿瘤活性蛋白组分对细胞增殖活力的影响
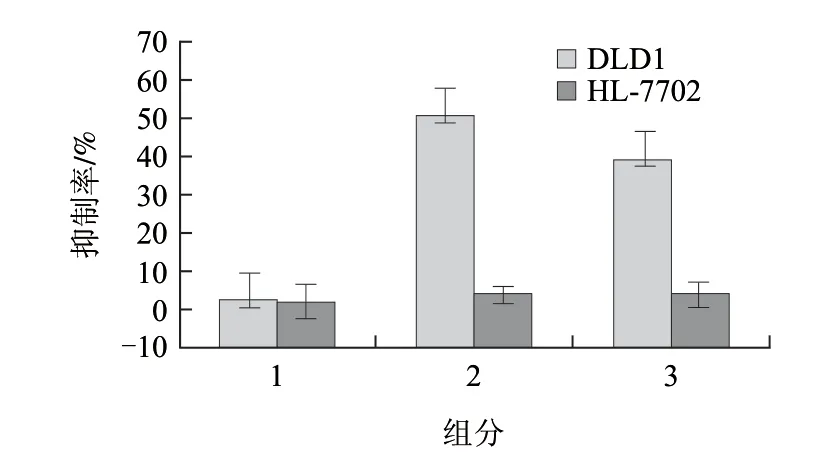
图 2 谷糠活性粗蛋白对DLD1、HL-7702细胞增殖的影响Fig.2 Effects of the crude protein extract and its fractions at different saturation degrees of ammonium sulfate on the growth of DLD1 and HL-7702 cells

图 3 图2中蛋白组分2对DLD1细胞增殖的影响Fig.3 Effects of active components chromatographically separated from fraction 2 (as shown in Fig.2) on the growth of DLD1 cells

图 4 Q-柱得到的活性蛋白组分2-1对DLD1细胞增殖的影响Fig.4 Effect of active components chromatographically separated from fraction 2-1 on the growth of DLD1 cells

图 5 蛋白组分2-1-3分别用不同温度孵育后对DLD1细胞增殖的影响Fig.5 Effect of incubation temperature on the growth inhibitory activity of active component 2-1-3 against DLD1 cells
本实验采用MTT法,通过体外抗肿瘤活性实验检测小米米糠蛋白中的有效成分,用小米米糠分离过程中的各级蛋白作用于人结肠癌细胞株DLD1和人正常肝细胞株48h。MTT结果(图2)显示,30%~85%饱和度的硫酸铵分级沉淀所得到的谷糠蛋白对DLD1细胞有明显抑制作用,所以该级蛋白中可能含有抗肿瘤活性组分;实验数据还表明,各级蛋白对正常细胞HL-7702均无明显抑制作用。图3结果进一步表明,小米米糠蛋白活性成分在Q-阴离子柱分离时的穿透液里。将此穿透液过SP柱,100mmol/L的Tris-NaCl洗脱液被检测到具较显著的抗肿瘤活性(图4)。SDS-PAGE结果表明,该组分主要为一条35kD的蛋白条带(图1)。为了进一步纯化该蛋白,将该蛋白分别在37、60、80、100℃的水浴中孵育15min,发现该蛋白仍具有细胞活性(图5),且通过此步骤得到进一步的纯化,SDS-PAGE结果显示为单一条带,见图1的泳道5。
2.3 不同质量浓度的小米米糠活性蛋白对各种肿瘤细胞增殖活力的影响

图 6 不同质量浓度的小米米糠活性蛋白对细胞株HL-7702、DLD1、HeLa细胞增殖的影响Fig.6 Effect of FMB concentration treatment on the growth of HL-7702, DLD1 and HeLa cells
为了比较FMB对不同肿瘤细胞增殖能力的影响,采用不同质量浓度(0.025、0.050、0.075、0.100μg/μL)的FMB分别作用于人结肠癌细胞株DLD1、人宫颈癌细胞株HeLa、人正常肝细胞HL-7702。由图6可知,FMB对不同肿瘤细胞的抑制能力各不相同,其中对DLD1细胞株的抑制作用最显著,HeLa细胞株次之;且随着蛋白质质量浓度的增加,抑制率也逐渐增强,具有明显的剂量依赖性;而对正常细胞株HL-7702无明显抑制作用。如图6结果所示,当FMB的终质量浓度为0.1μg/μL时,体外处理上述各细胞株48h后,DLD1细胞生长抑制率为44%,HeLa细胞生长抑制率为37%,HL-7702细胞抑制率为7.7%。在表2中显示了经FMB处理后,获得的各种细胞的IC50值,DLD1细胞的IC50值最小,HL-7702细胞株的IC50值最大。

表 2 FMB对肿瘤细胞(DLD1、HeLa)和正常细胞(HL-7702)毒性的影响Table 2 Cytotoxic activity of FMB against various human cancer cell lines (DLD1 and HeLa) and a normal cell line (HL-7702)
2.4 小米米糠抗肿瘤活性蛋白对不同细胞株形态特征的影响

图 7 倒置显微镜下观察FMB处理后HL-7702、DLD1和HeLa细胞的形态特征(×60)Fig.7 Morphological observation of HL-7702, DLD1 and HeLa cells after FMB treatment under an inverted microscope (×60)
倒置光学显微镜下观察各细胞的形态特征(图7),发现经FMB蛋白处理48h后的DLD1和HeLa细胞的数量明显减少,出现细胞核明显皱缩,变圆,部分细胞漂浮等凋亡现象;而对照组细胞形态正常,HeLa细胞呈多角形,胞浆丰富,核明显可见核仁。DLD1细胞树突状明显,细胞均一,生长良好。而正常细胞株HL-7702在处理前后细胞形态均无明显变化。
3 讨 论
小米米糠作为农副产品,其营养价值丰富,来源充足、价格低廉,但目前由于人们对其价值缺乏足够的认识,造成了大量的小米麸皮资源的浪费,若能将其充分利用,将具有很高的经济效益和社会价值。本研究以纯天然小米米糠为原料,通过丙酮和硫酸铵沉淀法制备了米糠粗蛋白,并通过离子交换层析法和蛋白的热稳定性纯化出了单一FMB。体外抗肿瘤活性实验表明:该蛋白能够显著抑制人结肠癌细胞株DLD1和宫颈癌细胞株HeLa的增殖,并能诱导其凋亡;而对人正常肝细胞株HL-7702无明显作用。因此,FMB有望成为绿色、高效的天然抗癌药物。
3.1 小米米糠中活性蛋白的制备及纯化
表1的数据表明,30g的谷糠原材料经过一系列的制备、纯化过程后能获得3.1mg的谷糠活性纯蛋白,得率较低。因此,在以后的蛋白纯化中,将不断优化纯化程序,以期大幅度的提高其得率,为以后的深入研究和开发应用奠定基础。在纯化小米米糠活性蛋白的过程中发现,FMB在pH8.0的缓冲溶液体系中能与SP-阳离子交换层析柱结合,由此初步推测该蛋白可能为碱性蛋白。当用100mmol/L的Tris-NaCl洗脱液洗脱与蛋白结合的层析柱时,该蛋白被洗脱下来,因而推测该蛋白的等电点大约在8.5左右。另外,蛋白热稳定性实验表明,FMB在80℃的水浴中孵育15min后,经SDS-PAGE电泳检测发现该蛋白不但未发生降解,而且其纯度进一步提高;将FMB分别在37、60、80、100℃的水浴中孵育15min后,进行体外抗癌细胞增殖活性实验检测,结果发现该蛋白仍具有较强的抗癌细胞增殖的活性。这说明,本研究纯化获得的FMB的分子结构非常稳定,具有较强的耐热性,这有利于我们进一步研究其生物活性及作用机制,同时也有利于进行大规模的分离纯化。
3.2 小米米糠活性蛋白对细胞增殖的影响
细胞增殖与肿瘤的发生、发展及退化有密切的关系。大多数抗肿瘤药物都能抑制敏感肿瘤细胞的增殖,并且其抗肿瘤效果与肿瘤细胞在药物诱导下发生细胞增殖抑制的活性有关[11]。本实验采用MTT法,探讨了小米米糠活性蛋白对肿瘤细胞株DLD1、HeLa及正常细胞株HL-7702增殖的影响,同时比较了各种细胞抑制率的IC50。IC50值可以用来衡量药物诱导凋亡的能力,该数值越低,表明细胞对药物处理越敏感。本研究中FMB对人结肠癌细胞DLD1的抑制作用最强,IC50值最小,HeLa次之。这说明,FMB对不同肿瘤细胞的抑制作用存在一定差异,它对人结肠癌细胞DLD1的生长抑制作用显著,有望为结肠癌的治疗提供新的靶向药物。特别是FMB对HL-7702细胞生长基本无抑制作用,表明FMB具有特异的抑制癌细胞增殖的作用,它对正常细胞无明显抑制作用。
3.3 小米米糠活性蛋白对细胞凋亡的影响
人类恶性肿瘤形成的重要病理学基础是肿瘤细胞异常增殖、凋亡严重减退造成的。就细胞内调控调节机制而言,既须拮抗、抑制肿瘤细胞增殖,或诱导促使肿瘤细胞凋亡[12]。许多人类恶性肿瘤是由于细胞的死亡过程严重受阻,使得肿瘤细胞在数量上无限制恶性增生。越来越多的证据表明,化疗药物对肿瘤的作用主要是诱导肿瘤细胞死亡[13-15],本研究也证实了这一点。细胞形态实验结果表明FMB蛋白能促使肿瘤细胞发生凋亡,尤其对DLD1细胞作用显著。在倒置显微镜下可以观察到,经FMB处理48h后的DLD1细胞的细胞核出现明显皱缩、变圆、部分细胞漂浮等典型的凋亡信号;而对正常肝细胞株HL-7702却无明显影响。以上实验结果充分表明,FMB能显著诱导癌细胞凋亡,但对正常细胞没有明显影响。
本实验的研究结果表明来源于小米米糠中的活性蛋白不但具有较强的抗癌细胞增殖的能力,而且还能显著诱导癌细胞发生凋亡,但对人正常细胞却无明显作用。该蛋白是通过何种细胞通路实现这一功能其作用靶点及具体分子机制又如何,这些问题都有待进行进一步的深入探讨,以期为癌症的低毒、高效治疗提供新的靶向药物。
[1] 许旭东, 胡晓茹, 杨峻山. 抗肿瘤药用植物有效成分研究概况[J]. 中国中药杂志, 2008, 33(17): 2073-2081.
[2] KANNAN A, HETTIARACHCHY N S, LAY J O, et al. Human cancer cell proliferation inhibition by a pentapeptide isolated and characterized from rice bran[J]. Peptide, 2010, 31(9): 1629-1634.
[3] KANNAN A, HETTIARACHCHY N S, JOHNSON M, et al. Human colon and liver cancer cell proliferation inhibition by peptide hydrolysates derived from heat stabilized defatted rice bran[J]. J Agric Food Chem, 2008, 56(24): 11643-11647.
[4] PARKASH A, NG T B, TSO W W. Purification and characterization of charantin, anapin-like ribosome-inactivating peptide from bitter gourd (Momordica charantia) seeds[J]. J Pept Res, 2002, 59(5): 197-202.
[5] FANG E F, ZHANG C Z Y, ZHANG Lin, et al. RNase MC2: a new Momordica charantia ribonuclease that induces apoptosis in breast cancer cells associated with activation of MAPKs and induction of caspase pathways[J]. Apoptosis, 2011, 17(4): 377-387.
[6] MAKOTO T, MAYUMI O K, NORIO S. Aralin, a new cytotoxic protein from Aralia elata, inducing apoptosis in human cancer cells[J]. Cancer Lett, 2003, 199(1): 19-25.
[7] SONG Liyan, REN Shengfang, YU Rongmin, et al. Purification, characterization and in vitro anti-tumor activity of proteins from Arca subcrenata Lischke[J]. Mar Drugs, 2008, 6(3): 418-430.
[8] LI Ge, KIM D H, KIM D, et al. Protein-bound polysaccharide from Phellinus linteus induces G2/M phase arrest and apoptosis in SW480 human colon cancer cells[J]. Cancer Lett, 2004, 216(2): 175-181.
[9] 谢钟琪. 谷糠治病不妨一试[J]. 现代养生, 2005(8): 18.
[10] 恩和, 庞之洪, 熊本海. 粟谷糠类饲料成分及营养价值比较分析[J]. 中国饲料, 2008(2): 39-41.
[11] MELET A, SONG Keli, BUCUR O, et al. Apoptotic pathways in tumor progression and therapy[J]. Adv Exp Med Biol, 2008, 6(15) : 47-79.
[12] FANG E F, ZHANG C Z Y, NG T B, et al. Momordica charantia Lectin, a Type II ribosome inactivating protein, exhibits anti-tumor activity toward human nasopharyngeal carcinoma cells in vitro and in vivo[J]. Cancer Prev Res, 2011, 5(1): 109-121.
[13] PIOTR J, BRANDON W, JORGE G, et al. A novel quinoline, MT477: suppresses cell signaling through Ras molecular pathway, inhibits PKC activity, and demonstrates in vivo anti-tumor activity against human carcinoma cell lines[J]. Invest New Drugs, 2008, 26: 223-232.
[14] SEOANE S, MONTERO J C, OCANA A, et al. Effect of multikinase inhibitors on caspase-independent cell death and DNA damage in HER2-overexpressing breast cancer cells[J]. J Natl Cancer Inst, 2010, 102(18): 1432-1446.
[15] FANG E F, ZHANG C Z Y, WONG J H, et al. The MAP30 protein from bitter gourd (Momordica charantia) seeds promotes apoptosis in liver cancer cells in vitro and in vivo[J]. Cancer Lett, 2012, 324(1): 66-74.
