野生与栽培蓝靛果果实提取物的体外抗氧化活性
2013-04-10刘德江田立娟程广东赵永勋
刘德江,申 健,田立娟,程广东,赵永勋
(佳木斯大学 生命科学学院,黑龙江 佳木斯 154007)
蓝靛果Lonicera edulisTurcz.是忍冬科忍冬属植物,为落叶小灌木。我国蓝靛果主要分布在东北、华北和西北地区,以东北的大、小兴安岭和长白山地区的野生资源贮量最为丰富,但掠夺式采摘使其资源破坏严重,而人工规模化栽培的产量几乎为零[1-3]。有关研究结果表明,蓝靛果果实中含有大量的活性物质,此类活性物质具有抗病毒、抗癌和改善肝脏解毒功能等功用[4-5],具有较高的营养及药用双重价值[6],是开发天然抗氧化剂的良好资源[7]。多年来,国内外现有关于蓝靛果的研究内容主要集中在野生蓝靛果抗氧化性质的研究方面,而有关栽培蓝靛果的抗氧化性质的研究在国内外尚无报道。因此,文中测定并统计了以不同产地野生与栽培蓝靛果果实提取物制备的样液对DPPH• 、•OH及O2¯•自由基的清除率,比较分析了二者抗氧化活性的大小及差异性,以期为野生蓝靛果资源的有效保护及蓝靛果人工规模化的栽培提供参考依据。
1 材料与方法
1.1 材 料
野生蓝靛果果实2010年6~7月分别采摘于黑龙江省的伊春、勃利和吉林省的汪清;栽培蓝靛果果实2010年5~6月采摘于4年生的栽培蓝靛果树,这些栽培树都是采用2007年通过采枝扦插繁殖得到的伊春、勃利和汪清的苗木而种植的。将采摘后的果实除杂后放入-20 ℃的冰箱中冻藏。
1.2 方 法
1.2.1 蓝靛果提取物样品的制备
根据刘德江等人采用的方法[8-9]制备蓝靛果提取物样品,提取方法为超声波法,超声波作用时间为19 min,超声波作用功率为229 W,料液比为1∶19,提取级数为1 级。选用HPD-200A大孔树脂进行粗提物纯化,最佳纯化条件为:上样液的质量浓度为50 mg/mL,洗脱流速为2.0 mL/min,洗脱液浓度为70%(v/v)。将提取物减压浓缩后进行真空冷冻干燥处理以备用。
1.2.2 DPPH•自由基的清除
采用杨玲等人的方法[10-12]将蓝靛果提取物用蒸馏水制成样液,其质量浓度分别设为0.5、1.0、1.5、2.0、2.5 mg/mL, 并 配 制 DPPH 2×l0-4mol/L的60%乙醇溶液。分别取不同质量浓度提取物样液各2.0 mL,加入DPPH的60%乙醇溶液2.0 mL,摇匀后放置30 min,以蒸馏水为空白对照,在517 nm处测定其吸光度(A0)。然后,分别取不同质量浓度提取物样液各2.0 mL,与2.0 mL乙醇溶液混合后,在517 nm处测定其吸光度(Ax)。最后,测定DPPH乙醇溶液2.0 mL与蒸馏水2.0 mL混合后的517 nm处的吸光度(Ac)。样液对自由基的清除能力以K来表示。重复3次。清除率(K)的计算公式如下:
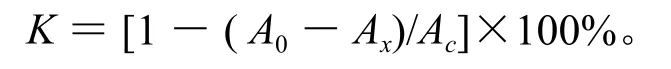
1.2.3 •OH自由基的清除
依据杨玲等人的方法[13],在具塞试管中依次加入2.0×10-4mol/L的甲基紫溶液1.0 mL、1.0×10-3mol/L的 Fe2+溶 液 1.0 mL、0.12% 的H2O2溶液1.0 mL,以Tris-HCl缓冲液将pH值调至4.5后,用蒸馏水精确稀释到10 mL,摇匀放置30 min后,用分光光度计在578 nm处测定吸光度(Ai),以甲基紫和Tris-HCl缓冲溶液作为空白溶液,测定其吸光度(A),两者均以水为参比。测定样品时在上述体系中预先加入1.0 mL的样液,采用上述方法测定样品的吸光度(As),以同体积的样液、Tris-HCl和水溶液作参比,重复3次。清除率(S)的计算公式为:

1.2.4 O2¯•自由基的清除
参照郭雪峰的方法[14-15]测定样液对超氧自由基的清除能力。反应体系中依次加入50 mmol/L的Tris-HCl溶液5.7 mL、样液0.2 mL、6 mmol/L的邻苯三酚溶液0.1 mL,将混合物反应4 min,滴入2滴HCl以终止反应,在320 nm波长下测定吸光度(A1);用等体积的蒸馏水代替邻苯三酚,测定其吸光度(A2);再用等体积的蒸馏水代替样品溶液,测定其吸光度(A3)。重复3次。清除率(S)的计算公式为:
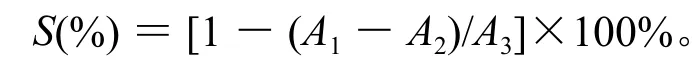
2 结果与分析
2.1 DPPH•自由基的清除结果
不同产地野生与栽培蓝靛果果实提取物不同质量浓度的样液对DPPH·的清除作用分别如图1A、B、C所示。由图1A、B、C可知,不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对DPPH·都具有很强的清除能力,且其对DPPH·的清除能力随着蓝靛果样液质量浓度的增加而呈现出更强的变化趋势。在图1的A与B中,不同产地野生蓝靛果果实样液对DPPH·的清除能力均高于栽培果样液。由图1A可知,当样液质量浓度分别为0.5、2.0 mg/mL且P<0.05时,野生与栽培蓝靛果果实样液对DPPH·的清除能力之间存在差异;由图1B可知,当样液质量浓度分别为2.0、2.5 mg/mL且P<0.05时,野生与栽培蓝靛果果实样液对DPPH·的清除能力之间亦有差异;由图1C可知,当样液的质量浓度分别为0.5、2.0 mg/mL且P<0.05时,栽培和野生蓝靛果果实提取样液对DPPH·自由基的清除能力之间具有差异性。在图1A、B、C中,当P<0.01时,野生与栽培蓝靛果果实提取样液对DPPH·自由基的清除能力之间均无差异。
2.2 •OH自由基的清除结果
不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对•OH的清除作用分别如图2A、B、C所示。由图2A、B、C可知,不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对•OH均有较强的清除能力,且随着蓝靛果样液质量浓度的增加,其对•OH的清除能力愈来愈强,当样液的质量浓度达到2.5 mg/mL时,栽培和野生蓝靛果样液对•OH的清除能力均达到70%以上,汪清栽培果样液的清除率最大(86.5%)。在图2A、B中,不同产地栽培蓝靛果样液对•OH的清除能力均高于野生果样液。当样液的质量浓度分别为如图2A的2.0、2.5 mg/mL 和如图2B的1.5、2.0 mg/mL且在P<0.05时,野生与栽培蓝靛果样液对•OH的清除能力之间差异显著。在图2C中,当样液的质量浓度分别为0.5、1.0 mg/mL时,栽培蓝靛果样液对•OH的清除能力略低于野生果样液;而当样液的质量浓度增加到1.5、2.0 mg/mL时,两者在P<0.05时具有差异。图2A、B、C中,当P<0.01时,野生与栽培蓝靛果样液对•OH的清除能力之间均无差异。

图1 不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对DPPH·的清除作用Fig.1 Scavenging activities to DPPH· of different mass concentration of extracts from wild and cultivated Lonicera edulis at different regions

图2 不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对•OH的清除作用Fig.2 Scavenging activities to •OH of different mass concentration extracts from wild and cultivated Lonicera edulis at different regions
2.3 O2¯•自由基的清除结果
不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对O2¯•的清除作用分别如图3A、B、C所示。由图3A、B、C可知,以不同产地的野生与栽培蓝靛果果实提取物制备的不同质量浓度的样液对O2¯•自由基均有极强的清除能力,且同等质量浓度的栽培果提取样液对O2¯•的清除能力均略高于野生果样液。除此之外,当样液的质量浓度均为0.5 mg/mL时,野生和栽培蓝靛果提取样液的清除率均高于60%以上;当样液的质量浓度均为2.5 mg/mL时,野生和栽培蓝靛果提取样液的清除率均达到90%,最大为98.1%。由图3B可知,当样液的质量浓度为1.5 mg/mL且在P<0.05时,栽培与野生果样液的清除率之间具有显著的差异;由图3C可知,当样液的质量浓度分别为2.0、2.5 mg/mL且在P<0.05时,栽培与野生果样液的清除率之间具有显著差异。在图3A、B、C中,当P<0.01时,野生与栽培蓝靛果提取样液对O2¯•的清除能力之间均无差异性。

图3 不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对O2¯•的清除作用Fig.3 Scavenging activities to O2¯• of different mass concentration extracts from wild and cultivated Lonicera edulis at different regions
3 结 论
不同产地野生与栽培蓝靛果果实提取物不同质量浓度样液对DPPH•、•OH及O2¯•自由基都具有较强的清除能力,且其清除率随着提取样液的质量浓度的增加而增加,呈量效关系。方差分析结果表明,当P<0.05时,野生与栽培蓝靛果提取样液对DPPH•、•OH及O2¯•自由基的清除率,仅表现出点状差异,却未呈现出线性关系;而当P<0.01时,野生与栽培蓝靛果提取样液对三种自由基的清除率之间并无显著差异。
综上所述,不同产地的野生与栽培蓝靛果均有较高的抗氧化活性,且野生与栽培果的抗氧化活性之间无显著差异。
参考文献:
[1]霍俊伟,睢 薇,阮瑞雪.黑龙江省野生蓝靛果忍冬染色体的观察[J].中国林副特产,2004,8(4):15-16.
[2]李 恒,邢桂菊,廉美丹.药用植物——蓝靛果[J].中国林副特产,2002,(1):10.
[3]申 健,杨国亭,刘德江.木醋对几种小浆果扦插繁殖的影响[J].经济林研究,2013,31(1):167-171.
[4]金 政,王启伟,金 美,等.蓝靛果对四氯化碳所致小鼠肝损伤修复作用的形态学研究[J].中国中医药科技,2002,9(1): 46.
[5]向延菊,郑先哲,王大伟.野生浆果资源——蓝靛果忍冬利用价值的研究现状及应用前景[J].东北农业大学学报,2005,36(5): 669-671.
[6]CHAOVANALIKIT A. Athocyanins, phenolics antioxidant capacity and color characteristics of bluehoneysuckles[J]. J Agric Food Chem, 2001,45: 362-367.
[7]WANG H, CAO G, PRIOR RL. Total antioxidant capacity of fruits[J]. Journal of Agricultural and Food Chemistry, 1996,(44):701-705.
[8]刘德江,刘 娟,申 健,等. RSM法优化蓝靛果色素的提取工艺[J].林业实用技术,2012,(3):59-61.
[9]刘德江,孙国志,李佳琳,等.五种HPD系列树脂分离纯化蓝靛果红色素的工艺研究[J].中国食品添加剂,2012,(5):154-158.
[10]杨 玲.蓝靛果提取物抗氧化及抗癌作用的研究[D].哈尔滨:东北林业大学,2009.
[11]李姣娟,周尽花,戴 渝,等.川桂叶总黄酮清除DPPH自由基作用的研究[J].中南林业科技大学学报, 2010, 30(10):125-128.132.
[12]郭雪峰,岳永德,汤 锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008, 28(8):1823-1826.
[13]杨 玲,王振宇.蓝靛果乙醇提取物体外抗氧化作用的研究[J].食品工业科技,2009,30(12):162-164.
[14]李姣娟,戴 瑜,周尽花,等.川桂叶总黄酮对油脂抗氧化作用的研究[J].中南林业科技大学学报,2011,31(10):134-137.
[15]王振宇,刘奕琳.蓝靛果乙醇洗脱物的抗氧化活性研究[J].食品工业科技,2012,33(9):163-165.
