1,3-二氯-2-丙醇对睾丸间质细胞R2C活性及孕酮合成的影响
2013-12-23孙建霞白卫滨邹飞雁张齐好黄亚东
白 顺,孙建霞,白卫滨*,邹飞雁,张齐好,黄亚东
(1.暨南大学发育与再生生物学系,广东 广州 510632;2.广东工业大学轻工化工学院,广东 广州 510006;3.暨南大学食品科学与工程系,广东 广州 510632;4.暨南大学医药生物技术研究开发中心,广东 广州 510632)
食品中的氯丙醇的污染主要来自以盐酸水解蛋白工艺生产的酱油、“鸡精”等人们日常生活中常见的调味品[1-3]。2001年经粮农组织/世界卫生组织食品添加剂联合专家委员会(JECFA)综合评价得出氯丙醇类同系物1,3-二氯-2-丙醇(1,3-dichloro-2-propanol,1,3-DCP)可引起肝脏和肾脏毒性[3-4],并具有遗传毒性、发育毒性和致癌性[5-7],因此国际上各主要国家对调味品乃至食品中氯丙醇都有一定的限量标准[8-9]。此前Omura等[10]给予大鼠长期喂食含1,3-DCP的水后发现其能降低精子数,说明1,3-DCP是大鼠的睾丸毒物,对生殖系统有一定的潜在影响,但其具体的毒理机制尚不明确。本研究通过1,3-DCP对体外培养的大鼠睾丸间质细胞R2C毒性损伤情况,探讨氯丙醇引起的生殖毒性机制,为氯丙醇的食品安全评价提供一定的依据。
1 材料与方法
1.1 材料、试剂与仪器
R2C细胞由暨南大学医药生物技术研究开发中心提供。
1,3-DCP(#1100996,纯度为98%) 上海晶纯公司;F12培养液、胰酶、胎牛血清、马血清、肌氨酸钠 美国Sigma公司;噻唑蓝(MTT)、二甲基亚砜(DMSO) 美国Amresco公司;EDTANa2、Triton X-100、Tris 美国Genview公司;低熔点琼脂糖 美国FMC公司;正常熔点琼脂糖 西班牙Biowest公司;孕酮放射免疫试剂盒 北京北方生物技术研究所。
CO2培养箱、酶标仪 美国Thermo公司;GC-1200 γ放射免疫计数仪 安徽中科中佳公司;DDL-5低温离心机 上海安亭公司。
1.2 方法
1.2.1 MTT法检测1,3-DCP对R2C细胞增殖率
取对数期的R2C细胞悬液调整浓度为2×104个/mL,以每孔200μL细胞悬液接种96孔板。培养24h后加入用无血清培养液稀释的1,3-DCP,使每孔终浓度分别为0.5、1、2、4、6mmol/L并混合均匀。每个浓度设3个平行孔,并设有空白组(只加200μL培养基)和对照组(加200μL细胞悬液,不加药)。药物作用48h后,每孔加入20μL 5mg/mL MTT。继续培养4h后吸去孔内液体,每孔加200μL DMSO溶解沉淀后于脱色摇床摇匀10min,酶标仪检测570nm波长处的吸光度。按下式计算细胞生长抑制率。
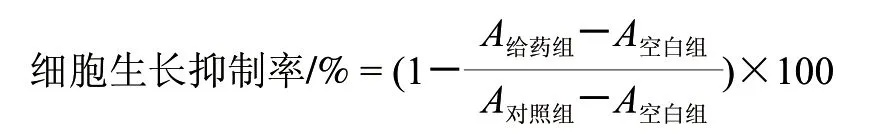
通过SPSS软件分析得出1,3-DCP刺激细胞48h后的IC25、IC50和IC75。
1.2.2 单细胞电泳法(single cell gel electrophoresis,SCGE)检测1,3-DCP对R2C细胞DNA损伤作用
R2C细胞培养至对数期,调整细胞浓度为1×105个/mL,以每孔1mL接种到6孔板内。培养24h后加1,3-DCP,使其终浓度为IC25、IC50和IC75。培养4h后收获细胞,PBS重悬,冷却用于SCGE实验。
配制0.8%常温熔点琼脂糖溶液,加热熔化后,冷却至45℃,取100μL滴于载玻片上,盖上盖玻片,4、10min后取下盖玻片作为第一层;取104个细胞与75μL 0.8%的低熔点琼脂糖溶液在37℃条件下混匀,迅速滴在第一层琼脂糖上,加上盖玻片,4℃、10min后取盖玻片形成第二层胶。
将玻片浸入预冷的裂解液(2.5 m o l/L N a C l,100mmol/L Na2EDTA,10mmol/L Tris,1% Triton X-100及10% DMSO组成,临用前配用,pH10),4℃静置1h。取出玻片,蒸馏水洗3次后放入电泳槽内,加电泳液(1mmol/L Na2EDTA,300mmol/L NaOH,pH13)并使电泳液面高出玻片0.25cm,静置20min后25V 200mA电泳15~20min。取玻片置于0.4mol/L Tris(pH7.5)溶液中洗涤3次,每次10min。每片滴加20μL 25μg/mL EB进行DNA染色,盖上盖玻片后荧光显微镜下观察拍照。CASP软件分析电泳结果。
1.2.3 放射免疫(radioimmunoassav,RIA)检测1,3-DCP对R2C细胞合成孕酮的影响
R2C细胞培养至对数期,调整细胞浓度为106个/mL,以每孔1mL细胞悬液接入6孔板,培养24h后更换分别含IC25、IC50和IC75浓度1,3-DCP的培养液。继续培养4h或24h后胰酶消化细胞,1500r/min离心5min后收取上清,放于-20℃保存。按孕酮放射免疫试剂盒进行孕酮的测定。
1.2.4 统计学处理
运用SPSS软件19.0进行统计分析,采用单因素方差分析结果,检验水准α=0.05。
2 结果与分析
2.1 1,3-DCP对R2C细胞的生长抑制作用

图 1 不同浓度1,3-DCP刺激R2C细胞48h后的细胞形态图(×200)Fig.1 Morphology of R2C cells subjected to treatment of 1,3-DCP at various concentrations for 48 h (×200)
不同浓度的1,3-DCP作用R2C细胞48h后,细胞生长受到不同程度的抑制。由图1可知,随着浓度的增加,细胞形态和数量均发生了变化。细胞形态逐渐变圆,且贴壁不稳定,随着浓度的增加,此现象越明显,同时细胞抑制率随着1,3-DCP浓度的增大也逐渐增大(表1)。通过SPSS软件分析得出1,3-DCP对R2C细胞的IC25、IC50、IC75分别为(1.161±0.046)、(1.897±0.018)、(3.100±0.040)mmol/L。

表 1 不同浓度1,3-DCP对R2C细胞生长抑制率的影响Table 1 Inhibitory effect of 1,3-DCP on the growth of R2C cells
2.2 1,3-DCP对R2C细胞DNA损伤的作用
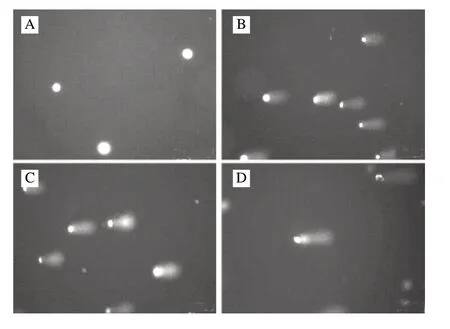
图 2 不同浓度1,3-DCP刺激4h后对R2C细胞DNA损伤作用Fig.2 Damage of DNA in R2C cells after treatment with 1,3-DCP
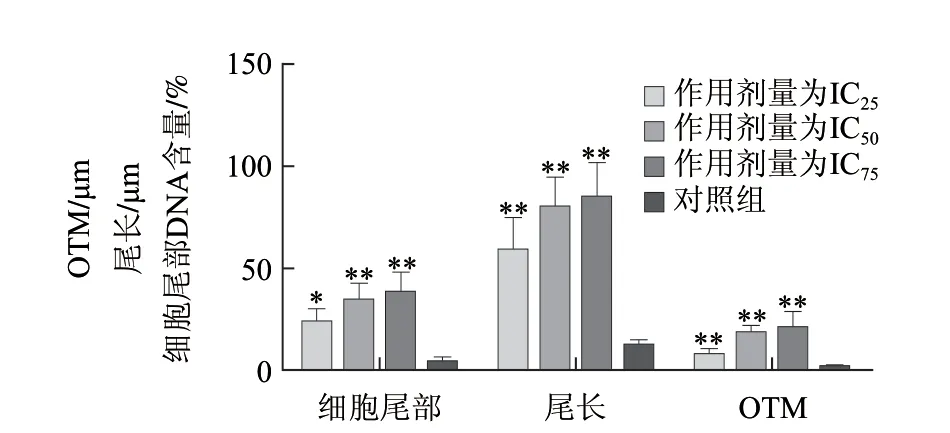
图 3 不同浓度1,3-DCP刺激4h后对R2C细胞尾部DNA含量、尾长、Olive尾距(OTM)的影响Fig.3 Effect of 1,3-DCP on tail DNA content, tail length and Olive tail moment in R2C cells
不同浓度1,3-DCP刺激R2C细胞4h后,细胞拖尾的长度随着浓度的增加而增大(图2)。通过CASP软件分析尾部DNA含量、尾长、尾距以及Olive尾距(OTM)等数据得出(图3),各浓度组对细胞DNA有明显的损伤作用,并具有统计学意义。
2.3 1,3-DCP对R2C细胞分泌孕酮的影响
放射免疫结果显示,不同浓度1,3-DCP作用R2C细胞4h后,各浓度组能够明显影响R2C细胞孕酮的合成(图4)。而在作用24h后,各浓度组孕酮合成量显著降低,且随着浓度的增加,降低也更明显,各浓度组与对照组相比,有显著性差异(P<0.05)(图5)。
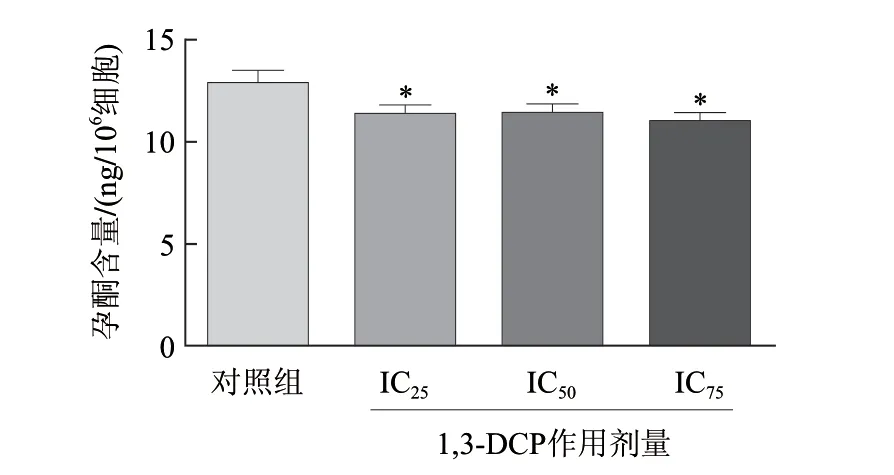
图 4 不同浓度1,3-DCP刺激4h后对R2C细胞孕酮合成的影响Fig.4 Effect of 1,3-DCP on progesterone production of R2C cells for 4 h
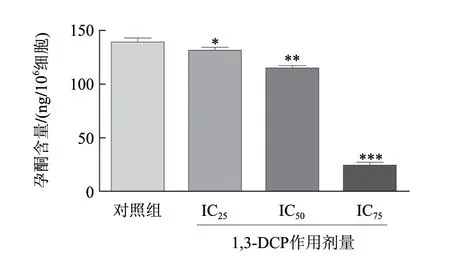
图 5 不同浓度1,3-DCP刺激24h后对R2C细胞孕酮合成的影响Fig.5 Effect of 1,3-DCP on progesterone production of R2C cells for 24 h
3 讨 论
前期研究[11]发现氯丙醇毒性作用的靶器官为肾脏和生殖系统。目前,1,3-DCP的毒性和致癌性实验资料显示,1,3-DCP可以显著的增加肝脏、肾脏等恶性肿瘤的发生[12]。一系列细菌和哺乳动物体外系统实验中均表明1,3-DCP具有体外致突变作用和遗传毒性作用[13]。大鼠体内实验表明,1,3-DCP对大鼠雄性生殖系统具有毒性,但未对睾丸间质细胞进行体外毒理评价[10],本研究通过对睾丸间质细胞R2C的生物活性及其功能的影响来探讨1,3-DCP的毒性作用。
1,3-DCP刺激剂量的选择是依据Ramy等[14]对氯丙醇的另一同系物3-氯-1,2-丙二醇(3-MCPD)的研究来确定剂量范围。3-MCPD与1,3-DCP都有生殖毒性和致癌性,且1,3-DCP体外研究目前还比较少,因此本实验参考3-MCPD的刺激剂量范围来探讨1,3-DCP的毒性作用。
研究首先发现1,3-DCP能抑制R2C细胞的增殖,并且随着浓度的增加,抑制也越来越明显,推测1,3-DCP可能是通过影响睾丸间质细胞的活性来影响生殖系统的正常运行。此外,单细胞电泳结果表明1,3-DCP作用的R2C细胞与对照组相比DNA受到明显的损伤,这说明了其对睾丸间质细胞具有遗传毒性作用。孕酮是睾酮合成的第一步,通过检测孕酮水平可间接说明睾酮的分泌量[15-16]。有研究[17]表明,体外培养睾丸间质细胞4h时睾酮分泌量达到最大,本实验首先检测1,3-DCP作用R2C细胞4h后孕酮的分泌量,同时也设置了24h时间点,目的是探讨1,3-DCP对R2C细胞孕酮分泌量的影响有没有时间依赖性。研究结果显示1,3-DCP刺激4h或24h后,各浓度组R2C细胞合成的孕酮与对照组有明显差异,浓度越高,差异也越明显。结果说明1,3-DCP能抑制R2C细胞孕酮的合成,进而抑制睾酮的合成,且抑制呈时间—剂量效应。
通过以上结果可猜测,1,3-DCP是通过对R2C细胞孕酮合成过程中关键蛋白DNA的损伤来达到影响孕酮合成的作用。今后准备通过对孕酮合成中关键蛋白的mRNA水平和蛋白水平的研究来进一步探讨1,3-DCP的毒性作用机理,从而为阐明1,3-DCP调控睾丸间质细胞孕酮分泌具体机制奠定基础。
[1] 王卫华, 徐锐锋, 刘军, 等. 食品中氯丙醇测定方法研究进展[J]. 化学分析计量, 2007, 16(3): 74-76.
[2] NYMAN P J, DIACHENKO G W, PERFETTI G A. Survey of chloropropanols in soy sauces and related products[J]. Food Additives and Contaminants, 2003, 20: 909-915.
[3] STEPHEN W C, KWONG K P, JOAN C W, et al. Chloropropanols levels in foodstuffs marketed in Hong Kong[J]. Journal of Food Composition and Analysis, 2008, 21(7): 569-573.
[4] SHIOZAKI T, MIZOBATA Y, SUGIMOTO H, et al. Fulminant hepatitis following exposure to dichlorohydrin report of two cases[J]. Human & Experimental Toxicology, 1994, 13: 267-270.
[5] YANN G, ROBERT B, BEATRICE S, et al. Carcinogenicity of chemicals in industrial and consumer products, food contaminants and flavourings, and water chlorination byproducts[J]. The Lancet Oncology, 2011, 12(4): 328-329.
[6] LEE J C, SHIN I S, AHN T H, et al. Developmental toxic potential of 1,3-dichloro-2-propanol in Sprague-Dawley rats[J]. Regulatory Toxicology and Pharmacology, 2009, 53: 63-69.
[7] Joint FAO/WHO Expert Committee on Food Additives. Safety evaluation of certain food additives and contaminants/prepared by the sixty-seventh meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA)[C]. WHO Food Additives Series, 2007: 209-238.
[8] 张烨, 丁晓雯. 食品中氯丙醇污染及其毒性[J]. 粮食与油脂, 2005(7): 44-46.
[9] 李吉平, 高宏伟, 刘文森, 等. 小口径毛细管色谱柱测定酱油中三种氯丙醇含量的研究[J]. 食品科学, 2007, 28(9): 473-477.
[10] OMURA M, HIRATA M, ZHAO M, et al. Comparative testicular toxicities of two isomers of dichloropropanol, 2,3-dichloro-l-propanol, and 1,3-dichlo-ro-2-propanol, and their metabolites alpha-chlorohydrin and epichlorohydrin, and the potent testicular toxicant 1,2-dibromo-3-chloropropane[J]. Bulletin of Environmental Contamination Toxicology, 1995, 55(1): 127.
[11] 李宁, 刘泽钦, 贾旭东, 等. 氯丙醇对大鼠的毒性研究[J]. 卫生研究, 2003, 32(4): 349-352.
[12] KLUWE W M, GUPTA B N, LAMB J C. The comparative effects of 1,2-dibromo-3-chloropropane(DBCP) and its metabolites 3-chloro-1,2-propaneoxide(epichlorohydrin),3-chloro-,1,2-propanediol(alphachlorohydrin), and oxalic acid, on the urogenital system of male rats[J]. Toxicology and Applied Pharmacology, 1983, 70: 67-86.
[13] 戴滢. 国际上对(含氯丙醇)盐酸水解蛋白的安全性评价及质量标准[J]. 食品信息指导, 1999(12): 31-32.
[14] RAMY R E, ELHKIM M O, LEZMI S, et al. Evaluation of the genotoxic potential of 3-monochloropropane-1,2-diol (3-MCPD) and its metabolites, glycidol and β-chlorolactic acid, using the single cell gel/comet assay[J]. Food and Chemical, 2007, 45: 41-48.
[15] ZHANG Qihao, ZOU Ping, ZHAN Haichao, et al. Dihydrolipoamide dehydrogenase and cAMP are associated with cadmium-mediated Leydig cell damage[J]. Toxicology Letters, 2011, 205: 183-189.
[16] 管永波, 郝鹏飞, 唐春宇, 等. 氟化钠对小鼠睾丸间质瘤细胞StAR和P450scc mRNA表达的影响[J]. 卫生研究, 2012, 41(1): 105-108.
[17] 王丽蕃. 藏党参中主要活性成分的测定及其多糖对睾丸间质细胞影响的研究[D]. 北京: 中央民族大学, 2009.
