鼠伤寒沙门氏菌鞭毛蛋白FliC的原核表达、纯化及其多克隆抗体的制备
2013-12-23徐幸莲周光宏汤晓艳陈爱亮
陈 明,徐幸莲,周光宏,汤晓艳*,袁 飞,陈爱亮
(1.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081;2.南京农业大学食品科技学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095;3.中国检验检疫科学研究院,北京 100123)
沙门氏菌(Salmonella)是对人类和动物健康危害严重的一类致病菌,在美国,沙门氏菌已被实验室证实是最重要的食源性致病菌,而在欧洲,沙门氏菌也成为最主要的致病菌之一[1-3]。在引起沙门氏菌中毒的食品中,以动物性食品污染最为严重[4-5]。感染了沙门氏菌的患者轻则引起腹泻、恶心,重则导致伤寒、败血性休克,甚至死亡[6-8]。引起人类疾病的沙门氏菌血清型主要为肠炎沙门氏菌和鼠伤寒沙门氏菌[9-13]。本研究选择含有属特异性共同抗原表位的鼠伤寒沙门氏菌鞭毛蛋白基因fliC,利用大肠杆菌表达系统获得沙门氏菌鞭毛融合蛋白,纯化后以此融合蛋白作为抗原制备多克隆抗体,为进一步研究沙门氏菌免疫学检测方法和试剂盒的研制奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒及实验动物
鼠伤寒沙门氏菌菌株S. typhimurium(从鸡肉中分离) 中国检验检疫科学院;质粒载体pET28a(+)由本实验室保存;表达菌株BL21(DE3)pLysS 天根生化科技(北京)有限公司。
BALB/c小鼠,6~8周龄,由中国检验检疫科学院动物中心提供。
1.1.2 试剂
DNA限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、dNTP 美国NEB公司;细菌基因组提取试剂盒、胶回收试剂盒、质粒小提试剂盒、蛋白质分子质量标准 天根生化科技(北京)有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、弗氏佐剂及弗氏不完全佐剂 美国Sigma公司;Ni-NTA树脂 德国Qiagen公司;PVDF膜和显色试剂 生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 目的基因fliC引物的设计与合成
根据PCR引物设计的原则,利用Primer Premier 5.0软件对经NCBI数据库筛选的沙门氏菌属内同源性较高的鼠伤寒沙门氏菌目的基因fliC(AY353377.1)进行引物设计,上游引物(FLICF):5’-GGCAGCCATATGGCACAAGTC ATTAATACAAACAGCCTGT-3’,划线处为NdeⅠ酶切位点,下游引物(FLICR):5’-GTGGTGCTCGAGACGCA GTAAAGAGAGGACGTTTTGCGGAA-3’,划线部分为XhoⅠ限制性内切酶位点,以上引物由生工生物工程(上海)股份有限公司合成。
1.2.2 总DNA的提取及鞭毛蛋白基因的扩增
利用天根生化科技(北京)有限公司的细菌基因组提取试剂盒从新鲜的沙门氏菌菌液中提取沙门氏菌基因组,并以此为模板进行目的基因的扩增,PCR反应程序:94℃、5min;94℃、1min,60℃、45s,72℃、90s,32个循环;72℃、7min。采用1%琼脂糖凝胶电泳鉴定。
1.2.3 融合表达载体的构建与测序
用N d e Ⅰ和X h o Ⅰ双酶切P C R 产物和表达载体pET28a(+),将胶回收纯化的载体酶切产物和PCR酶切产物进行连接,构建融合表达质粒pET28a-fliC,转入感受态大肠杆菌BL21(DE3)pLysS,涂于含20μg/mL卡那霉素的LB平板上,37℃过夜培养。取阳性克隆进行NdeⅠ和XhoⅠ双酶切鉴定,并送至生工生物工程(上海)股份有限公司测序验证。
1.2.4 表达载体在大肠杆菌中的表达及可溶性分析
挑取含重组质粒的阳性克隆菌株,过夜培养,次日按1:100转种至100mL含卡那霉素抗性的LB培养液中,37℃摇床培养3h至A600nm达0.6~0.8,加入诱导剂IPTG至终浓度为1mmol/L,继续振摇6h。培养结束后12000r/min离心5min,收集菌体沉淀。将菌体沉淀重悬于细菌裂解液(50mmol/L NaH2PO4,300mmol/L NaCl,10mmol/L咪唑,pH8.0)中,超声波破碎后12000r/min离心10min,收集上清液和沉淀。分别取少量上清液和沉淀进行SDSPAGE电泳分析。
1.2.5 亲和层析纯化融合蛋白
根据1.2.4节的步骤将含重组质粒的阳性菌株扩增培养至500mL,诱导表达后,离心收集沉淀,将其用细菌裂解液溶解后进行超声破碎,离心取上清,根据Ni-NTA琼脂糖树脂操作说明对上清液进行纯化。具体步骤参考Qiagen公司Ni-NTA树脂使用说明。经纯化的蛋白用SDS-PAGE进行电泳分析。
1.2.6 Western-blotting鉴定
将纯化产物经10% SDS-PAGE电泳后,湿转法转印至PVDF膜上,在含5g/100mL脱脂奶的PBST中4℃封闭过夜,以鼠抗His标签单抗为第一抗体,室温结合1h,TBST洗3次,每次10min,再加入碱性磷酸酶标记的羊抗鼠IgG,室温结合1h,TBST洗3次,每次10min,用 ECL显色试剂对表达产物进行显色鉴定。
1.2.7 FliC融合蛋白多克隆抗体的制备
选3只体质量为6~8周龄的健康雌性和雄性BALB/c小鼠,对小鼠进行多点皮下注射,50μg/只。每隔2周加强免疫1次,此时免疫原改用弗氏不完全佐剂进行乳化。从第2次加强免疫后开始监测血清,于第3次加强免疫后7d尾部静脉采血,用间接ELISA检测抗血清。待血清效价稳定后,断头采血,分离血清,-20℃冻存备用。
1.2.8 间接ELISA法测定抗血清效价
用包被缓冲液(pH9.6、0.05mol/L碳酸盐缓冲液)稀释的抗原包被酶标板,4℃过夜;以含3g/100mL脱脂奶粉的封闭液37℃封闭1h;依次加入倍比(100、1000、10000、100000)稀释的抗血清,37℃温育30min,洗涤,同时设空白对照和阴性血清对照;加入稀释(1:4000)的羊抗鼠IgG-HRP,37℃温育2h,最后以TMB为底物显色置室温暗室处10min最后加50μL终止液(2mol/L H2SO4),用酶标仪测定各孔OD450nm值。
1.2.9 抗血清特异性的鉴定
以10种沙门氏菌(含目标菌)和10种非沙门氏菌属的常见食物中毒菌(大肠杆菌、金黄色葡萄球菌等)为包被原包被酶标板,同时做阴性对照,用间接ELISA法测定各孔的OD450nm值,具体操作步骤同1.2.8节。
2 结果与分析
2.1 PCR扩增结果
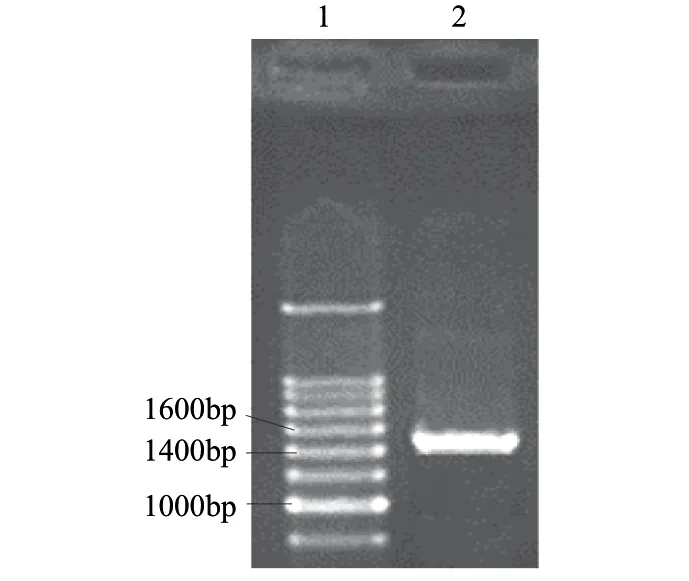
图 1 PCR产物凝胶电泳结果Fig.1 Analysis of PCR products by 1% agarose gel electrophoresis
本实验用所设计的引物进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳,电泳结果见图1,可以看出1条特异性的DNA条带,大小与预期值1509bp大小相吻合。
2.2 重组质粒pET28a-fliC酶切鉴定和测序验证
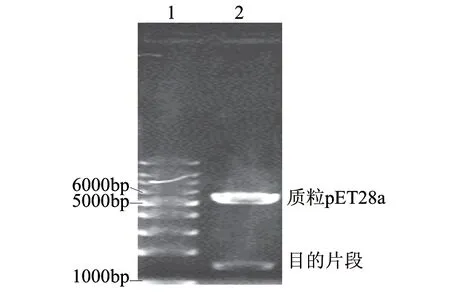
图 2 重组表达载体的双酶切鉴定结果Fig.2 Identification of recombinant expression vectors by double enzyme digestion
用质粒小提试剂盒提取重组质粒进行NdeⅠ和XhoⅠ双酶切,经0.8%琼脂糖电泳检测共出现2条带,分别与载体和预期fliC目的基因片段的大小相符(图2),提示重组质粒构建成功。重组质粒pET28a-fliC的fliC基因经测序,全长为1509bp,结合载体序列进行分析,确定其开放读码框架正确,无移码和突变现象,进一步证明载体构建成功。
2.3 重组质粒的表达和可溶性分析
将重组质粒转化至大肠杆菌BL21(DE3)pLysS中,加入诱导剂IPTG,参考文献[14]的诱导时间诱导6h,收集细胞裂解后进行SDS-PAGE电泳发现,在40.0~60.0kD间,诱导组菌体蛋白较对照组出现明显诱导条带(图3),其分子质量大小与预期(54.6kD)基本相符。可溶性分析结果表明,融合蛋白大部分存在于裂解液上清液中(图4)。
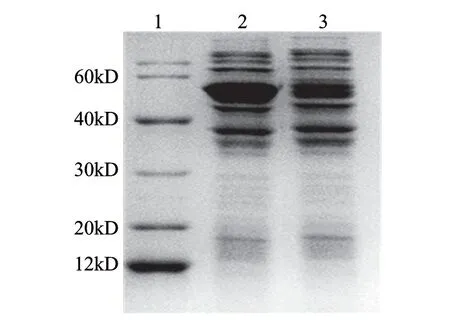
图 3 融合蛋白表达的SDS-PAGE 分析Fig.3 SDS-PAGE analysis for the expression of fusion protein
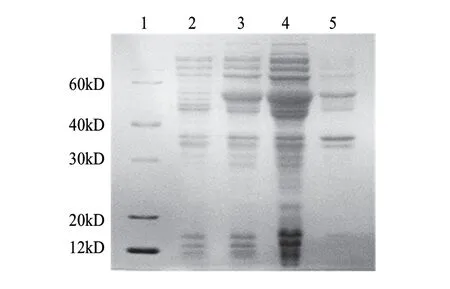
图 4 重组蛋白表达形式的鉴定Fig.4 Identification of the recombinant proteins
2.4 重组蛋白的纯化及Western-blotting鉴定
阳性克隆菌经IPTG诱导后,经超声裂解,收集超声后的上清液,经Ni-NTA树脂纯化,收集洗脱液用SDSPAGE分析,纯度较高(图5)。Western-blotting结果(图6)显示,纯化后所得蛋白可被His-Tag抗体识别,说明表达的重组蛋白带有His-Tag,空质粒对照并未出现诱导条带。
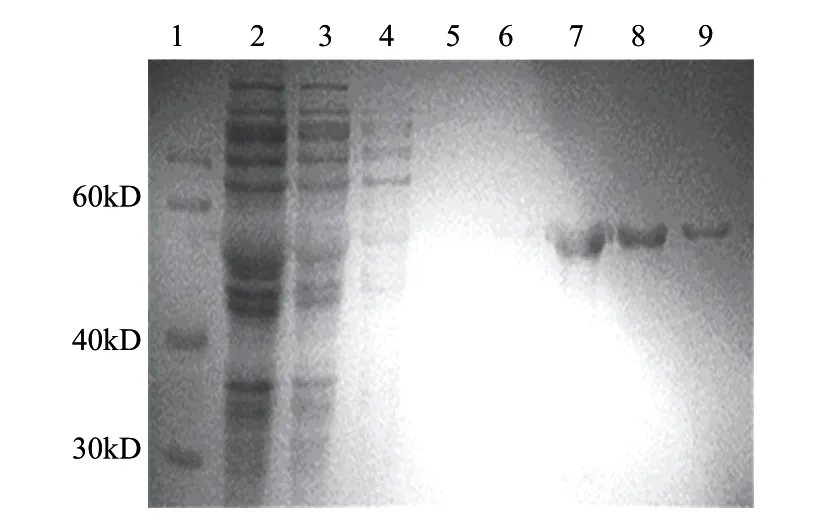
图 5 纯化的重组蛋白的SDS-PAGE分析 Fig.5 SDS-PAGE analysis of the purified proteins
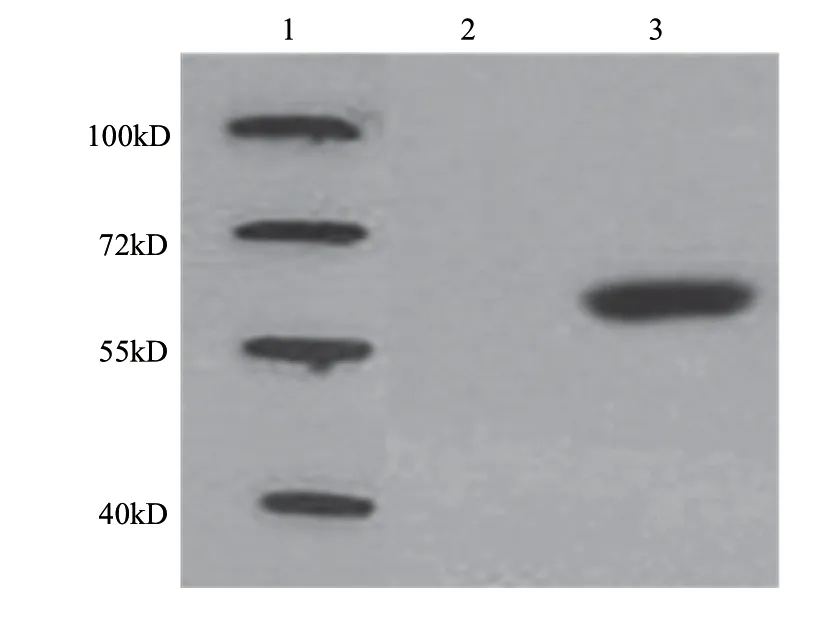
图 6 纯化的重组蛋白的Western-blotting分析Fig.6 Western-blotting analysis of the purified proteins
2.5 血清效价的测定结果
小鼠经4次免疫后,尾静脉取血检测,用间接ELISA进行效价测定,根据P/N≥2.1,阳性血清的最大稀释比例为抗血清的效价,结果表明3只小鼠血清抗体效价达到1:32000,其中第2只小鼠的抗血清效价达1:128000,具体结果见表1。
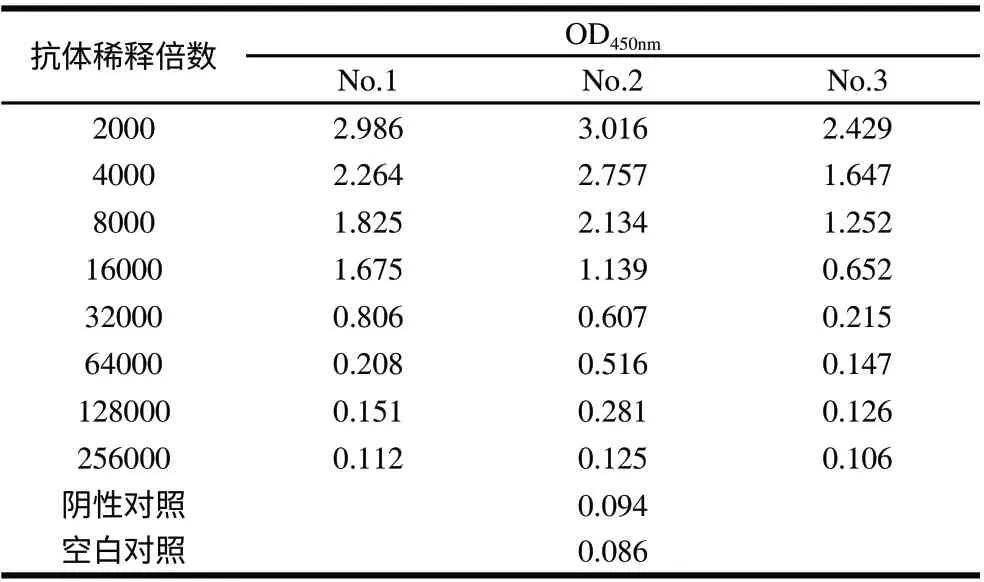
表 1 间接ELISA检测抗体效价结果 Table 1 Results obtained for the assay of titer by indirect ELISA
2.6 抗体特异性检测结果
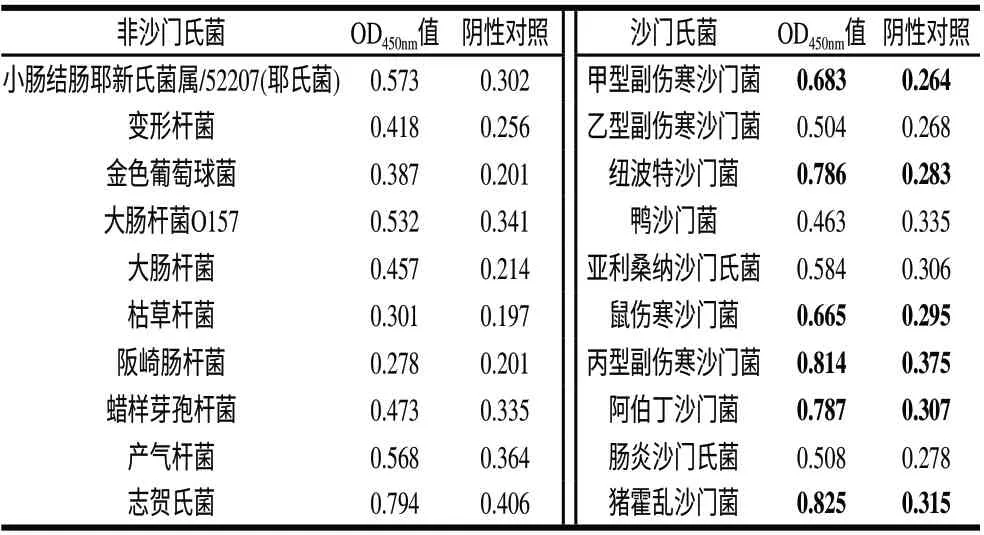
表 2 间接ELISA检测抗体特异性结果Table 2 Results obtained for the analysis of specificity by indirect ELISA
由表2可知,制备的抗血清与6种非沙门氏菌属的常见食品中致病菌无阳性反应,与10种沙门氏菌中的6株有阳性反应,这6株菌分别为:鼠伤寒沙门氏菌、猪霍乱沙门氏菌、甲型副伤寒沙门氏菌、纽波特沙门氏菌、丙型副伤寒沙门氏菌和阿伯丁沙门氏菌。
3 讨 论
本实验将PCR得到的目的片段测序,通过生物信息学方法预测其编码蛋白序列,发现了TDKN GKSIDGGY这一肽段,通过相关软件的比对发现其与沙门氏菌属特异性共同抗原表位TDNNGKTIDGGL位点具有同源性,这与文献[15]报道的一致。原核细胞表达系统具有成本低、周期短、操作简便等许多优点,而pET系统在E. coli 中克隆表达重组蛋白具有很大的优势,主要表现为表达效率高,可在短时间内诱导出大量的目的蛋白。本研究利用pET28a(+)表达了C端和N端融合了6×His的沙门氏菌鞭毛蛋白基因fliC,并利用Ni-NTA亲和纯化方法得到了较纯的目的蛋白,经SDS-PAGE和Western-blotting鉴定证明,该蛋白的大小和预计大小相符。
本研究采用His-Tag标记的质粒pET28a(+)载体进行表达,His-Tag分子质量小,免疫原性小,不影响目的蛋白的活性,且方便后续的纯化和鉴定[16]。表达的His-Tag融合蛋白无论是可溶性的或者包涵体形式都可以用Ni-NTA树脂去纯化,Ni-NTA树脂具有特异性好、流速快、颗粒度均匀、粒径小、螯合镍稳定、物理和化学稳定性好、批次重复性好等优点。本实验表达的目的蛋白经SDS-PAGE电泳发现,大部分以可溶性形式存在。这与饶星等[14]在相关研究中表达出的以包涵体形式存在的鞭毛蛋白不同,可溶性蛋白的纯化过程相对简单,无需像包涵体形式蛋白纯化那样经历变性、复性等复杂过程[17]。
要制备高效价、高特异性的抗体必须有理想的免疫原、合适的免疫动物和切实可行的免疫方案。蛋白质是良好的抗原,前期实验获得的鞭毛融合蛋白经过亲和层析纯化,可作为免疫原免疫小鼠制备抗血清。
佐剂是一种非特异性的免疫增强剂,当其与抗原一起注入机体时,可增强机体应答反应。佐剂的作用原理为:1)改变抗原的物理性状,增加抗原在体内储留时间;2)通过刺激单核-巨噬细胞,增加APC对抗原的处理和提呈能力;3)诱发抗原注射部位及其局部淋巴结的炎症反应,有利于刺激免疫细胞的增殖作用;4)刺激淋巴细胞的增殖分化,从而增强和扩大免疫应答的能力[18-19]。本实验中用于乳化抗原的佐剂即为弗氏佐剂,在初次免疫时,使用弗氏完全佐剂,加强免疫时使用弗氏不完全佐剂,以利于抗原持续刺激动物机体,产生高浓度的特异性IgG型免疫球蛋白。
免疫间隔时间是影响免疫效果的重要因素。第一次免疫后,因动物机体正处于抗原识别和特异性B细胞增殖阶段,若很快进行第二次抗原注入,极易引起免疫抑制。所以一般以间隔10~20d为宜。第二次免疫注射后,每次加强免疫的间隔时间一般为7~10d,不能太长,以防刺激变弱,抗体效价不高。加强免疫两次后就可进行试血,如抗血清效价符合要求,应在末次免疫后5~7d及时采血,否则抗体效价将会下降[20]。本实验初次免疫小鼠后2周,进行加强免疫,然后每隔2周进行一次加强免疫,在第四次加强免疫后的第7天取血用间接ELISA测定效价。结果表明用纯化的鞭毛融合蛋白免疫小鼠后得到的抗血清,效价可达1:32000以上,为进一步建立沙门氏菌属的免疫学检测方法提供了前期参考。
[1] JARQUIN R, HANNING I, AHN S, et al. Development of rapid detection and genetic characterization of Salmonella in poultry breeder feeds[J]. Sensors, 2009, 9(7): 5308-5323.
[2] MALORNY B, HUEHN S, DIECKMANN R, et al. Polymerase chain reaction for the rapid detection and serovar identification of Salmonella in food and feeding stuff[J]. Food Anal Methods, 2009, 2(2): 81-95.
[3] 张双虎, 冯王龙. 沙门氏菌病研究探讨[J]. 中国畜牧种业, 2009(6): 149-150.
[4] 刘家发, 朱建如. 食品安全存在的问题及对策[J]. 公共卫生与预防医学, 2005, 16(6): 35-38.
[5] 刘胜贵, 魏麟. 应用PCR技术检测猪肉中沙门氏菌的研究[J]. 食品科学, 2007, 28(3): 254-256.
[6] WICK M J. Living in the danger zone: innate immunity to Salmonella[J]. Curr Opin Microbiol, 2004, 7: 51-57.
[7] 吴永宁. 现代食品安全科学[M]. 北京: 化学工业出版社, 2003: 4-5.
[8] HIROSE K, ITOH K L, NAKAJIMA H, et al. Selective amplification of tyv(rfbE), prt(rfbS), viaB, and fliC genes by multiplex PCR for identification of Salmonella enterica serovars typhi and paratyphi A[J]. Clin Microbiol, 2002, 40: 633-636.
[9] XIA Shengli, HENDRIKSEN R S, XIE Zhiqiang, et al. Molecular characterization and antimicrobial susceptibility of Salmonella isolates from infections in humans in Henan province, China[J]. Journal of Clinical Microbiology, 2009, 47(2): 401-409.
[10] BANGTRAKULNONTH A, PORNREONGWONG S, PULSRIKAM C, et al. Salmonella serovars from humans and other sources in Thailand, 1993—2002[J]. Emerging Infectious Diseases, 2004, 10: 131-136.
[11] HERIKSTAD H, MOTARJEMI Y, TAUXE R V. Salmonella surveillance: a global survey of public health serotyping[J]. Epidemiology and Infection, 2002, 129: 1-8.
[12] 杨保伟, 申进玲, 席美丽, 等. 2007—2008 西安地区鸡肉源沙门氏菌相关特性[J]. 食品科学, 2011, 32(19): 130-136.
[13] 李扬, 鞠玉琳, 王晓波, 等. 中药“连黄”对耐药沙门氏菌抑制作用的研究[J]. 吉林畜牧兽医, 2007(9): 9-11.
[14] 饶星, 卢士英, 王颖, 等. 三株沙门氏菌的鞭毛基因重组及蛋白的免疫特性[J]. 中国生物工程杂志, 2008, 28(6): 82-86.
[15] 曹军平, 焦新安, 张如宽, 等. 沙门氏菌鞭毛蛋白属共同抗原表位的定位[J]. 江苏农学院学报, 1996, 17(1): 67-72.
[16] 徐艳玲, 王振营, 何康来. 转Bt基因抗虫玉米对亚洲玉米螟幼虫几种主要酶系活性的影响[J]. 昆虫学报, 2006, 49(4): 562-567.
[17] 吉清, 何凤田. 包涵体复性的研究进展[J]. 国外医学: 临床生物化学与检验学分册, 2004, 25(6): 516-518.
[18] 高艳, 陈雪梅, 吴爱群. 增强型绿色荧光蛋白原核表达纯化与多克隆抗体的制备[J]. 郑州大学学报: 医学版, 2003, 38(3): 345-348.
[19] 孙红祥, 潘杭君. 免疫佐剂作用机理的研究进展[J]. 中国兽药杂志, 2005, 39(10): 22-27.
[20] 朱立平, 陈学清. 免疫学常用实验方法[M]. 北京: 人民军医出版社, 2000.
