火鸡肌肉丙氨酰氨肽酶的酶学特性
2013-12-23魏延玲何立超阮贵萍张迎阳章建浩
田 甜,魏延玲,何立超,阮贵萍,张迎阳,章建浩*
(国家肉品质量安全控制工程技术研究中心,教育部肉品加工与质量控制重点实验室,农业部农畜产品加工与质量控制重点开放实验室,南京农业大学食品科技学院,江苏 南京 210095)
氨肽酶广泛存在于动物、植物和微生物体内,发挥着从蛋白质或多肽链的N末端切割酰胺键逐一释放氨基酸的作用。氨肽酶在火腿的加工过程中水解寡肽(特别是三肽和四肽)释放游离氨基酸,游离氨基酸再通过Strecker降解和美拉德反应产生小分子化合物,形成产品的特征风味[1]。丙氨酰氨肽酶(AAP)广泛存在于各类动物骨骼肌中,其底物范围广,特别是水解苯丙氨酸、赖氨酸、甲硫氨酸、丙氨酸和亮氨酸形成的酰胺键,由于水解丙氨酸的速率最快,故称为丙氨酰氨肽酶[2]。
火鸡原产于墨西哥,是世界上最大的肉用禽类;与肉鸡相比,火鸡的肉质鲜嫩可口,蛋白质含量高,脂肪和胆固醇含量低,并富含丰富的B族维生素和VE,被美国营养学家推崇为“超级营养食物”[3]。目前,我国火鸡产业处于“易产难销”的状态,市面上的火鸡产品种类少、价格高,不利于消费;但随着人民生活水平的提高、健康饮食的不断关注以及食品种类多元化的发展,火鸡可能将成为人们餐桌上优质的肉源性食物的首选。国际上对于火鸡的研究多集中在火鸡加工[4]、火鸡鲜肉及产品的保鲜[5-6]、脂质氧化及抗氧化[7-9]、胆固醇氧化[10]及类PSE肉[11-12]等方面,而火鸡肌肉蛋白质水解及相关蛋白酶的酶学特性及作用机理还缺乏系统研究。本文以火鸡肌肉为原料,研究其中的重要氨肽酶AAP酶学特性及其盐分和水解产物等对其酶活力的影响,探索AAP等氨肽酶在火鸡加工过程中对蛋白质水解及风味品质形成的作用机理,为调控及提高产品风味品质提供理论依据。
1 材料与方法
1.1 材料与试剂
冷冻火鸡下腿60只由南京雨润集团提供,使用前于4~10℃条件下自然解冻。
丙氨酸-7-氨基-4-甲基香豆素(Ala-AMC)、7-氨基-4-甲基香豆素(AMC) 瑞士Bachem公司;β-巯基乙醇(BC级) 美国Amresco公司;丙氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸(BR级) 上海楷洋生物技术公司;其他试剂均为分析纯。
1.2 仪器与设备
M2e多功能酶标仪 美国MD公司;96孔黑色酶标板 美国Costar公司;722s可见分光光度计 上海精密仪器有限公司;TGL 20M-Ⅱ冷冻高速离心机 湖南省凯达实业发展有限公司;T25 digital高速分散机 德国IKA集团。
1.3 方法
1.3.1 丙氨酰氨肽酶活力测定
1.3.1.1 酶的提取
丙氨酰氨肽酶的提取参考Toldrá[13]、Rosell[14]等的方法,并进行了适当的修改。具体方法如下:剔除火鸡样品中可见的脂肪和结缔组织,剁碎后准确称取10g左右(精确到0.001g),加入50mL酶提取缓冲液(50mmol/L PBS缓冲液,pH7.5,含5mmol/L EDTA),在冰浴条件下用高速分散机匀浆3次(15000~17000r/min,每次10s,间隔20s),10000×g离心20min,上清液经4层纱布过滤即得粗酶液。粗酶液再经质量分数为45%~65%的硫酸铵进行分级分离,沉淀用最少量的蒸馏水溶解后用蒸馏水透析。
1.3.1.2 酶活力测定
丙氨酰氨肽酶活力的测定参考Toldrá等[15]的方法,并进行了适当的修改。具体方法如下:酶反应缓冲液为50mmol/L的Tris-HCl(pH7.5)含体积分数0.1% β-巯基乙醇(记为缓冲液A),向270μL缓冲液A中加入30μL酶液,37℃条件下预热10~20min,加入3μL 25mmol/L荧光底物Ala-AMC反应20min后立刻加入600μL无水乙醇终止反应。产生的荧光强度用多功能酶标仪于激发波长(λex)380nm、发射波长(λem)440nm处测定。对照组在加入底物后立刻加入600μL无水乙醇终止反应。
酶活力(U)单位定义为:每小时释放1μmol AMC所需的酶量。相对酶活力为:各处理组的酶活力相对于最高酶活力的百分比(最高酶活力记为100%)。
1.3.1.3 AMC标准曲线的绘制
用无水乙醇溶解AMC,配制5mmol/L的AMC标准液。取21支试管分7组(每组3支平行样)编号。向7组试管中分别加入0、5、10、15、20、25、30μL的AMC标准液,再加入缓冲液A至试管中溶液体积为300μL。混匀后放入37℃水浴中保温20min后加入600μL无水乙醇。产生的荧光强度用多功能酶标仪于λex为380nm、λem为440nm处测定。对照AMC标准曲线计算酶反应产生的AMC浓度,进而计算酶活力。
1.3.2 蛋白质含量的测定
采用考马斯亮蓝G-250比色法[16]。
1.3.3 最适温度的测定
在反应体系不变的情况下,分别在0、6、25、40、50、60、70、80℃条件下恒温反应20min,然后测定各组酶活力。
1.3.4 最适pH值的测定
在其他测定条件不变的情况下,酶反应最适pH值的测定分别在以下缓冲液(浓度均为50mmol/L)中进行:醋酸-醋酸钠缓冲液(pH3.0~5.0)、磷酸缓冲液(pH5.5~7.0)、Tris-HCl缓冲液(pH7.5~10.0)。
1.3.5 NaCl浓度对AAP活力影响的测定
向缓冲液A中加入NaCl至终浓度为800mmol/L,将其进行稀释,配制NaCl浓度梯度为200~800mmol/L的缓冲液作为酶反应液。在其他条件不变的情况下,测定不同NaCl浓度对AAP活力的影响。
1.3.6 不同氨基酸对酶活力影响的测定
参考Toldrá等[15]的方法,用缓冲液A分别配制浓度为100mmol/L的丙氨酸、亮氨酸、赖氨酸、甲硫氨酸和苯丙氨酸溶液,调节pH值至7.5。然后用缓冲液A将各氨基酸溶液浓度稀释到6.2、12.5、25.0、50.0mmol/L。在其他条件不变的情况下,测定酶活力。
1.3.7 数据分析
利用SPSS 17.0进行回归分析,拟合出各游离氨基酸对酶活力的作用曲线,得回归方程;利用SAS软件进行方差分析,分析NaCl浓度对AAP影响的差异性(P<0.05)。
2 结果与分析
2.1 火鸡腿肉中AAP的纯化结果
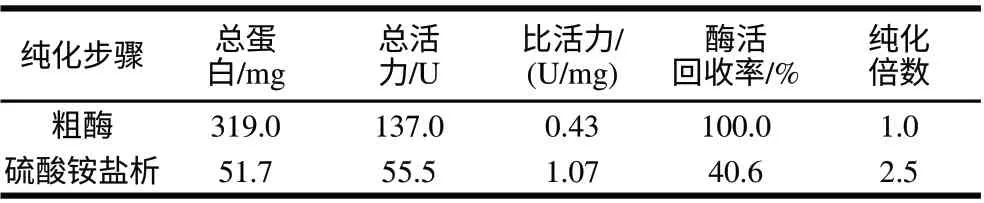
表 1 火鸡腿肉中AAP的纯化结果Table 1 Purification of AAP from turkey leg muscle
由表1可知,经过45%~65%的硫酸铵盐析后,酶的总蛋白和总活力均降低,而比活力和酶的纯度均提高了1.5倍,酶活回收率为40.6%。火鸡腿肉中AAP酶总活力137.0U,略低于Toldrá等[13]报道的猪腿肉中的AAP酶总活力,这可能与AAP的来源及酶反应缓冲体系的不同有关。
2.2 温度对AAP活力的影响
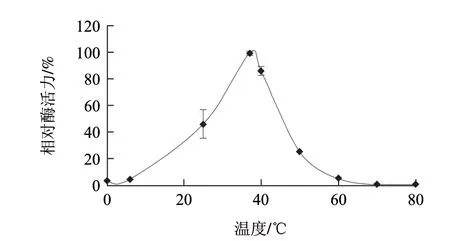
图 1 温度对AAP相对酶活力的影响Fig.1 Effect of temperature on AAP activity
如图1所示,AAP相对酶活力随着温度的升高呈现先升高后降低的变化趋势;AAP相对酶活力在37~39℃之间达到最大值;当温度低于6℃或高于60℃时,AAP几乎没有活力。说明当酶反应温度控制在37~39℃之间时,酶处于最适反应条件能最大地释放酶活。牛肉中AAP的最适温度为37℃,但在低温条件下(6℃以下)仍能保持较高的活力[17];不同部位的氨肽酶的最适温度不同,鸡肠道氨肽酶[18]的最适温度在40~50℃之间,高于火鸡肌肉中氨肽酶的最适温度,这可能与肠道温度比肌肉温度高有关,而氨肽酶的最适温度可能接近于所处环境的温度。
2.3 pH值对AAP活力的影响
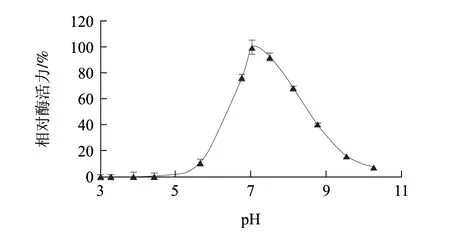
图 2 pH值对AAP相对酶活力的影响Fig.2 Effect of pH on AAP activity
如图2所示,AAP相对酶活力随着pH值的升高呈现先升高后降低的变化趋势;AAP相对酶活力在pH6.8~7.5之间达到最大值;当pH值小于5.0或大于10.3时,AAP几乎没有活力。这一结果验证了AAP是一种中性氨肽酶。不同来源的AAP的最适pH值不同,Nishimura等[19]从鸡肉中提取的AAP却表现出弱酸性的最适pH值为6.5左右,Ye Xiujuan等[17]从牛肉中提取的AAP表现出弱碱性的最适pH值为8.0左右。
2.4 NaCl浓度对AAP活力的影响
如图3所示,盐分对丙氨酰氨肽酶活力有一定的抑制作用,但抑制作用较弱。NaCl浓度低于200mmol/L时,它对AAP的抑制作用不显著(P>0.05);盐浓度在200~400mmol/L之间时,随着盐浓度增加,AAP相对酶活力显著降低;随着盐浓度继续增加,AAP相对酶活力变化不显著(P>0.05),800mmol/L的NaCl可以抑制10%的AAP相对酶活力。NaCl对猪骨骼肌中的丙氨酰氨肽酶同样具有抑制作用,且随着NaCl浓度的增加,酶活力逐渐降低,但NaCl的抑制作用较强,800mmol/L的NaCl使相对酶活力降低了近60%[20]。这可能与酶反应体系的差别有关,包括缓冲液、pH值及底物浓度。
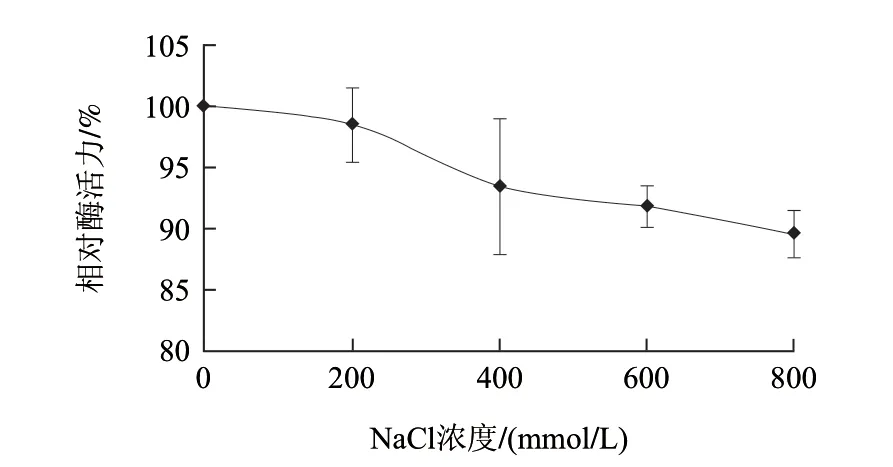
图 3 NaCl对AAP相对酶活力的影响Fig.3 Effect of NaCl on AAP activity
2.5 蛋白质水解产物氨基酸对AAP活力的抑制作用
以氨基酸浓度为横坐标,AAP的相对酶活力为纵坐标,将赖氨酸(Lys)、甲硫氨酸(Met)和亮氨酸(Leu)对AAP活力的影响进行回归分析。将AAP相对酶活力抑制率为50%时各种游离氨基酸的浓度记为IC50,用于比较各游离氨基酸对AAP活力抑制作用的强弱。
2.5.1 Lys对AAP活力的影响
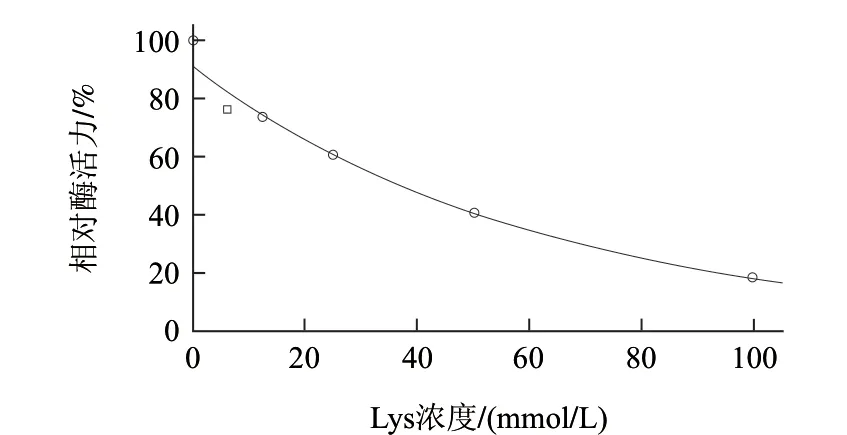
图 4 赖氨酸对AAP相对酶活力的作用曲线Fig.4 Function curve of AAP activity by lysine
如图4所示,Lys对AAP相对酶活力的影响的回归方程为y = e4.511―0.016x,该回归模型显著(P<0.01),拟合度较高(R2=0.99)。AAP相对酶活力随着Lys浓度的增加呈下降趋势,Lys浓度每增加10mmol/L,AAP相对酶活力降低约15%;当Lys浓度为100mmol/L时,AAP仅有18.4%的残余相对酶活力;Lys对AAP相对酶活力的IC50为37.4mmol/L。
2.5.2 Met对AAP活力的影响
如图5所示,Met对AAP相对酶活力影响的回归方程为y = e4.634―0.008x。此回归模型显著(P<0.01),拟合度较高(R2=0.98)。AAP相对酶活力随着Met浓度的增加呈下降趋势,Met浓度每增加10mmol/L,AAP相对酶活力降低约7%,Met对AAP相对酶活力的抑制作用比Lys的抑制作用弱;Met对AAP相对酶活力的IC50为90.2mmol/L。
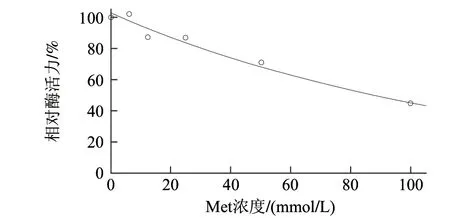
图5 甲硫氨酸对AAP相对酶活力的作用曲线Fig.5 Function curve of AAP activity by methionine
2.5.3 Leu对AAP活力的影响
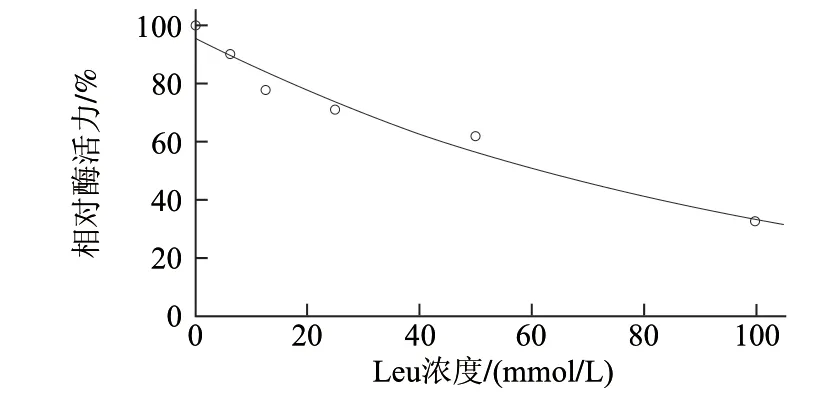
图 6 亮氨酸对AAP活力的作用曲线Fig.6 Function curve of AAP activity by leucine
如图6所示,Leu对AAP相对酶活力影响的回归方程为y = e4.560―0.011x。回归模型显著(P<0.01),拟合度较高(R2=0.98)。由方程可知AAP相对酶活力随着Leu浓度的增加呈下降趋势,Leu浓度每增加10mmol/L,AAP相对酶活力降低约11%,由此可见,Leu对AAP相对酶活力的抑制作用强弱介于Met和Lys之间;当AAP相对酶活力抑制率为50%时,Leu浓度为58.9mmol/L。
2.5.4 苯丙氨酸(Phe)对AAP活力的影响

图 7 苯丙氨酸对AAP活力的作用曲线Fig.7 Function curve of AAP activity by phenylalanine
由图7可知,Phe对AAP相对酶活力抑制作用较强,Phe浓度在0~25mmol/L之间时,随着其浓度的增加AAP相对酶活力波动下降;Phe浓度达到25mmol/L时,AAP相对酶活力降低了67%;而当Phe浓度大于25mmol/L时,AAP相对酶活力变化不显著;当AAP相对酶活力为50%时,Phe浓度小于20mmol/L。
2.5.5 Ala对AAP活力的影响
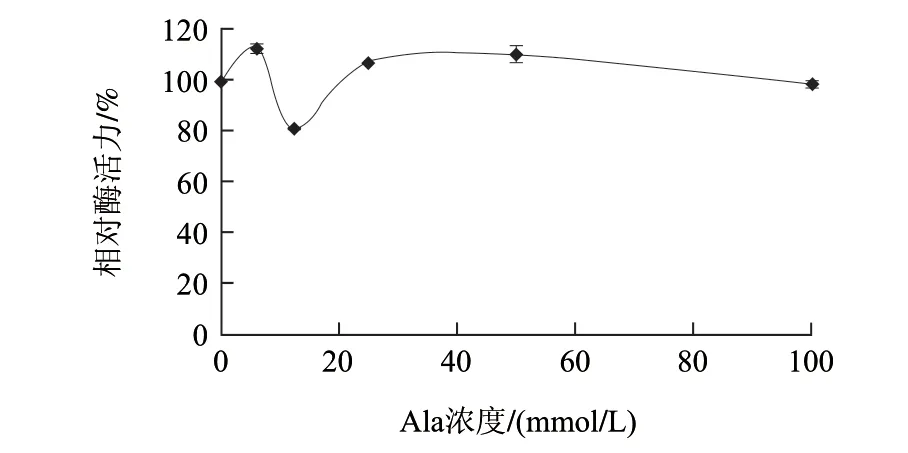
图 8 丙氨酸对AAP活力的作用曲线Fig.8 Function curve of AAP activity by alanine
由图8可知,Ala对AAP几乎没有抑制作用;当Ala浓度为100mmol/L时,AAP仍有98.7%的相对酶活力;IC50大于100mmol/L。
综上所述,AAP活力被产物氨基酸广泛抑制,AAP优先水解寡肽的N端丙氨酸,而丙氨酸的抑制作用反而最弱,这与Toldrá等[15]研究结果一致。IC50值越小,表明该氨基酸对AAP的抑制作用越强。由各氨基酸对AAP活力的IC50值可以看出:苯丙氨酸对AAP活力的抑制作用最强,其次是赖氨酸、亮氨酸和甲硫氨酸。Toldrá等[14]研究了游离氨基酸对猪和人骨骼肌中AAP抑制作用发现,2种来源的AAP都被游离氨基酸广泛抑制,且起抑制作用的氨基酸范围大致相同。起抑制作用的氨基酸均为疏水性氨基酸且支链氨基酸的作用更强。各产物氨基酸对人骨骼肌中AAP的抑制强弱为Leu>Phe>Met>Lys>Ala,而对猪骨骼肌中AAP的抑制强弱为Phe>Leu>Lys>Met>Ala。对比发现,Ala都是最弱的抑制剂,各产物氨基酸对火鸡肉与猪肉中的AAP的抑制强弱顺序更接近,这可能与不同来源的AAP的基因组成有关。游离氨基酸对调控细胞内蛋白质转换(蛋白质降解与合成的动态平衡)的过程具有重要作用,氨肽酶水降解寡肽产生游离氨基酸,游离氨基酸反过来又能抑制氨肽酶的降解作用,这种反馈抑制机制或许是操控整个蛋白质转换过程的潜在点。
3 结 论
丙氨酰氨肽酶是火鸡肉中一种重要的蛋白质水解酶,温度和pH值均能显著影响AAP活力,37~39℃、pH6.8~7.5时AAP活力最高,而盐分对AAP活力只有较弱的抑制作用;AAP的产物氨基酸可抑制其水解活性,但主要产物Ala对其抑制作用最弱,这种反馈机制通过氨基酸的积累会自动抑制AAP活力。因此,通过调节火鸡加工过程中的温度、pH值,降低盐分可提高AAP活力,增加火鸡肉中蛋白质的水解程度,提高产品的风味品质。
[1] FLORES M, ARISTOY M C, TOLDRÁ F. Hydrolysis of alanine oligopeptides by porcine muscle alanyl aminopeptidase[J]. Zeitschrift Fur Lebensmittel-Untersuchung Und-Forschung A, 1999, 208: 264-266.
[2] 赵改名. 肌肉蛋白水解酶在金华火腿加工过程中作用的研究[D]. 南京: 南京农业大学, 2004.
[3] 黄蓉, 刘敦华. 火鸡产业发展状况[J]. 肉类研究, 2010, 24(1): 3-4.
[4] SAMMEL L M, CLAUS J R, GREASER M L, et al. Investigation of mechanisms by which sodium citrate reduce the pink color defect in cooked ground turkey[J]. Meat Science, 2006, 72: 585-595.
[5] LEE E J, AHN D U. Quality characteristics of irradiated turkey breast rolls formulated with plum extract[J]. Meat Science, 2005, 71: 300-305.
[6] ZHU M J, LEE E J, MENDONCA A, et al. Effect of irradiation on the quality of turkey ham during storage[J]. Meat Science, 2003, 66: 63-68.
[7] TANG X Y, CRONIN D A. The effects of brined onion extracts on lipid oxidation and sensory quality in refrigerated cooked turkey breast rolls during storage[J]. Food Chemistry, 2007, 100: 712-718.
[8] MIELNIK M B, SEM S, EGELANDSDAL B, et al. By-products from herbs essential oil production as ingredient in marinade for turkey thighs[J]. LWT-Food Science and Technology, 2008, 41: 93-100.
[9] WANG J M, JIN G F, ZHANG W G, et al. Effect of curing salt content on lipid oxidation and volatile flavour compounds of dry-cured turkey ham[J]. LWT-Food Science and Technology, 2012, 48: 102-106.
[10] BAGGIO S R, MIGUEL A M R, BRAGAGNOLO N. Simultaneous determination of cholesterol oxides, cholesterol and fatty acids in processed turkey meat products[J]. Food Chemistry, 2005, 89: 475-484.
[11] RAMMOUZ R E, BABILÉ R, FERNANDEZ X. Effect of ultimate pH on the physicochemical and biochemical characteristics of turkey breast muscle showing normal rate of postmortem pH fall[J]. Poultry Science, 2004, 83: 1750-1757.
[12] CHAN J T Y, OMANA D A, BETTI M. Effect of ultimate pH and freezing on the biochemical properties of proteins in turkey breast meat[J]. Food Chemistry, 2011, 127(1): 109-117.
[13] TOLDRÁ F, ARISTOY M C, FLORES M. Contribution of muscle aminopeptidases to flavor development in dry-cured ham[J]. Food Research International, 2000, 33: 181-185.
[14] ROSELL C M, TOLDRÁ F. Comparison of muscle proteolytic and lipolytic enzyme levels in raw hams from Iberian and white pigs[J]. Journal of the Science of Food and Agriculture, 1998, 76: 117-122.
[15] TOLDRÁ F, FALKOUS G, FLORES M, et al. Comparison of aminopeptidase inhibition by amino acids in human and porcine skeletal muscle tissues in vitro[J]. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 1996, 115(4): 445-450.
[16] 胡琼英, 狄洌. 生物化学实验[M]. 北京: 化学工业出版社, 2007.
[17] YE Xiujuan, NG T B. Purification and characterisation of an alanine aminopeptidase from bovine skeletal muscle[J]. Food Chemistry, 2011, 124: 634-639.
[18] JAMADAR V K, JAMADAR S N, DANDEKAR S P, et al. Purification and characterization of aminopeptidase from chicken intestine[J]. Journal of Food Science, 2003, 68(2): 438-443.
[19] NISHIMURA T, KATO Y, OKITANI A, et al. Purification and properties of aminopeptidase C from chicken skeletal muscle[J]. Agricultural and Biological Chemistry, 1991, 55(7): 1771-1778.
[20] ARMENTEROS M, ARISTOY M C, TOLDRÁ F. Effect of sodium, potassium, calcium and magnesium chloride salts on porcine muscle proteases[J]. European Food Research & Technology, 2009, 229(1): 93-98.
