经左锁骨下动脉药盒系统灌注吉西他滨治疗晚期胰腺癌
2013-06-28帖君李延宏殷占新何创业白苇郭文刚牛静吴菲菲张淑娜韩国宏
帖君 李延宏 殷占新 何创业 白苇 郭文刚 牛静 吴菲菲 张淑娜 韩国宏
胰腺癌是一种发病隐匿、发展迅速、预后极差的肿瘤,仅占恶性肿瘤的2%~3%,但却已成为癌症死亡原因的第4 位。在中国,胰腺癌在全身恶性肿瘤中发病率已上升到第7 位,死亡率居恶性肿瘤第5 位[1]。目前认为手术切除是胰腺癌惟一的可治愈性方法,但由于胰腺解剖位置特殊,胰腺癌早期缺乏特异性症状,80%的患者在确诊时已为中晚期,能够进行根治性手术者仅占10%~20%[2],而化疗是不可切除胰腺癌患者的主要治疗手段。
目前,加入吉西他滨是晚期胰腺癌的标准化疗方案。与吉西他滨单药相比,多种以吉西他滨为基础的化疗方案均未能使患者明显获益,联合分子靶向药物治疗对胰腺癌患者的预后也无明显改善。胰腺癌的化疗目前处于平台期。在新的有效药物出现之前,积极探讨新的治疗方式对于晚期胰腺癌的治疗具有重要价值。
随着介入放射学的发展,局部动脉灌注化疗为晚期胰腺癌的治疗开辟了一条新的途径。理论上讲,经动脉灌注局部给药可以大大提高胰腺癌灶的药物浓度,从而提高化疗药物的治疗作用[3]。笔者回顾性分析2005—2011 年发表的19 篇英文文献[4-22],总病例数:862 例;手术方式:3 种;灌注药物:8 种;动脉灌注化疗的平均反应率为33.4%,平均1 年存活率为45.5%,平均中位生存期为10.8 个月,明显高于全身化疗的文献报道。但这些研究,多数样本量小,治疗方法与化疗方案多样,结果差异较大。且既往经股动脉插管灌注化疗的方法需反复插管,给药间隔时间长,治疗力度不足,难以维持有效的血药浓度。近年来,笔者采用经左锁骨下动脉药盒介入治疗晚期胰腺癌,既有动脉介入治疗病灶局部药物浓度高的优点,又避免了常规介入反复插管的缺陷,同时能实现规律性的灌注化疗。
资料与方法
1.患者收集:按下述纳入、排除标准收集2008 年6 月至2011 年12 月第四军医大学西京消化病医院收治的晚期胰腺癌患者。入选标准:(1)经临床(影像学)、病理诊断的不可手术切除的晚期胰腺癌;(2)有可评价病灶;(3)ECOG 评分≥2 分;(4)无其他重要相关疾病(如其他肿瘤,严重心脏和中枢神经系统疾病等);(5)血液生化指标:白细胞(WBC)计数>3.5×109/ml,血小板(PLT)计数>100 ×109/ml,丙氨酸转氨酶<200 IU/L,无冬氨酸转氨酶<200 IU/L;总血清胆红素<30 umol/L,血尿素氮(BUN)<7.14 mmol/L,肌酐<132 μmol/L。排除标准:(1)怀孕期或哺乳期妇女;(2)伴有严重的心血管或精神疾病,包括中枢神经系统转移;(3)不能控制的内科疾病(如不稳定心绞痛和慢性心衰等);(4)曾经接受过免疫抑制剂治疗(包括皮质类固醇);(5)凝血功能显著异常等。
2.左锁骨下动脉药盒植入术:患者平卧于数字减影血管造影(DSA)仪检查床,常规碘伏消毒,铺无菌手术巾,2%利多卡因在锁骨中外1/3、下约2.5 cm 处局部麻醉后,透视下向内上方穿刺左锁骨下动脉,穿刺成功后引入0.035 in(1 in =2.54 cm)的超滑导丝,沿导丝送入4 F Cobra 管,分别行腹腔动脉和肠系膜上动脉造影以观察肿瘤供血情况和确定靶血管,然后选择性插管至靶血管,退出Cobra 管,保留导丝,送入药盒导管,固定。在穿刺点下方2 cm 处,2%利多卡因局部麻醉后,切一长约4 cm 横切口,钝性分离皮下组织成囊袋状,用纱布填塞压迫止血,用隧道针穿通穿刺点与囊袋之间的皮下组织,引过药盒导管,连接药盒,置于囊袋中,缝合切口并放置引流条。检查药盒导管通畅后用肝素盐水封管,酒精消毒后,敷料包扎固定(图1)。治疗前伴有黄疸的22 例患者经胆管支架置入术减黄后再行左锁骨下动脉药盒置入术。药盒导管系统每隔2 周以肝素盐水冲管1 次。
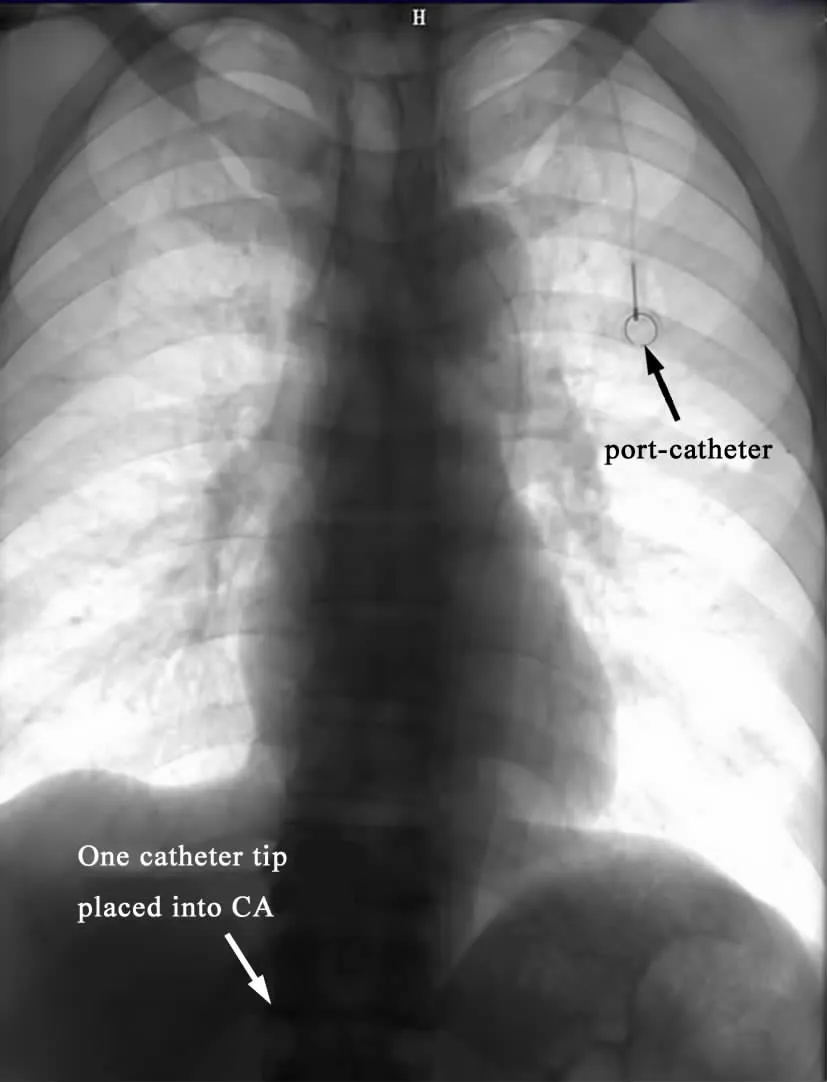
图1 胰腺癌患者前盆植入术后胸部X 线图像,显示前盆及导管头位置
3.化疗方案:术后用化疗泵注射盐酸吉西他滨1000 mg/m2,d1,8,15,间隔1 周,4 周为1 周期。
4.疗效评价:每次化疗前检查血常规、肝肾功能、离子、CA19-9,并评估其体能状况。每2 个月进行1 次CT、胸片的复查和疗效评估。(1)临床受益反应(clinical benefit response,CBR)的评定标准:具有以下一项指标改善,持续4 周以上,且无一项指标恶化者,为临床受益病例。①镇痛药剂量减少≥50%;②疼痛强度减轻≥50%;③体力状况改善KPS评分(karnofsky performance status)≥20 分;④非体液潴留性体重增加≥7%。(2)肿瘤客观疗效:按照修定版的实体瘤疗效评价标准(response evaluation criteria in solid tumors 1.1,RECIST 1.1)进行疗效评价。(3)总生存:根据随访资料计算OS,随访方式以通讯联系和门诊复查为主,失访病例按失访日期为死亡时间进行统计。Kaplan-Meier 法计算生存率。频数分布法计算中位生存期。
5.不良事件:包括药物不良反应及手术并发症。采用WHO 抗肿瘤药物急性与亚急性毒性分级标准进行分级,治疗后观察患者的不良反应,主要观察指标包括胃肠道、血液毒性及肝、肾功能等。手术并发症主要包括:剂过敏、局部血肿、血气胸、穿刺部位出血、切口感染、延迟愈合或开裂,以及药盒导管堵塞、移位和药盒周围组织坏死等。
结 果
1.患者基线资料:2008 年6 月至2011 年12 月本中心经左锁骨下动脉药盒介入治疗晚期胰腺癌86 例,符合纳入标准的80 例,男49 例,女31 例,其中22 例伴有梗阻性黄疸的患者行胆管支架植入术后行经左锁骨下动脉药盒介入治疗,10 例患者行姑息性胆-肠吻合术,未切除肿瘤。有12 例患者在PCS术前或术后行HIFU 治疗,7 例患者同时行放疗或放射性离子植入。经病理诊断41 例,39 例患者经CT、MRI 影像学诊断。有1 例患者术后第2 天突然出现呼吸、心跳骤停,心脏复苏成功,转ICU,未行化疗。患者基线资料见表1。
2.疗效评价:临床受益反应(CBR):符合CBR标准的临床受益者有45 例(56.25%)。在临床受益评价的指标中,以痛疼减轻最为明显。其中,镇痛药用量减少的患者有38 例(47.5%),痛疼减轻41例(51.25%),体力状况改善有31 例(38.75%),体重增加26 例(32.50%)。
肿瘤客观反应见表2。80 例患者可评价52 例,其中,部分缓解(PR)9 例,稳定(SD)27 例,进展(PD)16 例,治疗客观反应率11. 25%。总有效率45%。其中1 例患者,经治疗后部分缓解,病情稳定6 个月余,后疾病进展,但仍坚持化疗,至今仍健在(图2)。

表1 80 例晚期胰腺癌患者临床基线资料
3. 生存情况:80 例患者失访3 例,失访率为3.75%。生存期20~730 d,中位生存期160 d(95%CI:98.76~221.24 d),6 个月生存率为48.9%,9 个月生存率为39.7%,1 年生存率为23.3%(图3)。

图2 晚期胰腺癌患者介入治疗后8 个月CT 检查图像,显示病变部分缓解,1 年后病变进展
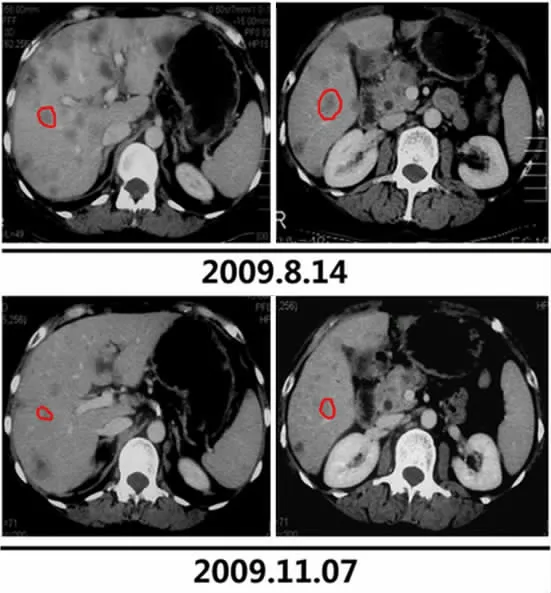
图3 晚期胰腺癌患者介入治疗后CT 检查图像,显示肝转移灶治疗后明显减少、缩小
用SPSS17.0 软件包,对年龄、性别、梗阻性黄疸、CA199、ECOG 评分、病灶部位、转移、化疗次数、是否合并其它治疗进行单因素分析,结果表明,梗阻性黄疸、ECOG 评分、化疗次数、转移、糖尿病与晚期胰腺癌患者的生存显著相关(P<0.05)(表3)。将有相关的影响因素进行Cox 比例风险回归模型多因素分析,结果表明梗阻性黄疸、ECOG 评分、化疗次数以及转移是影响晚期胰腺癌患者预后的独立因素(表4)。
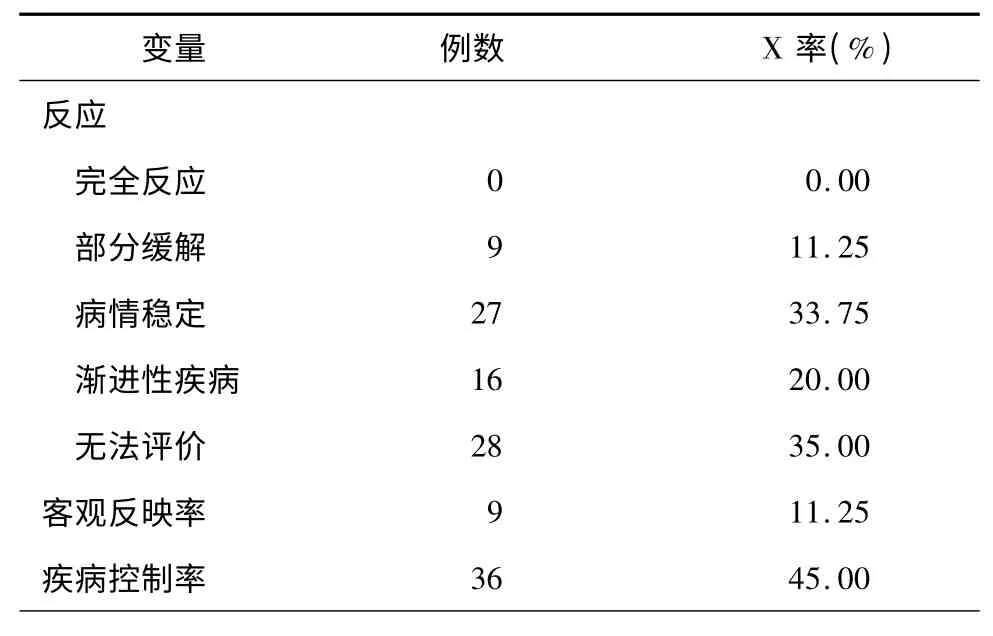
表2 80 例晚期胰腺癌患者介入治疗后的客观反应

表3 80 例晚期胰腺癌患者与生存相关的单因素分析

表4 80 例晚期胰腺癌患者与生存相关的多因素分析
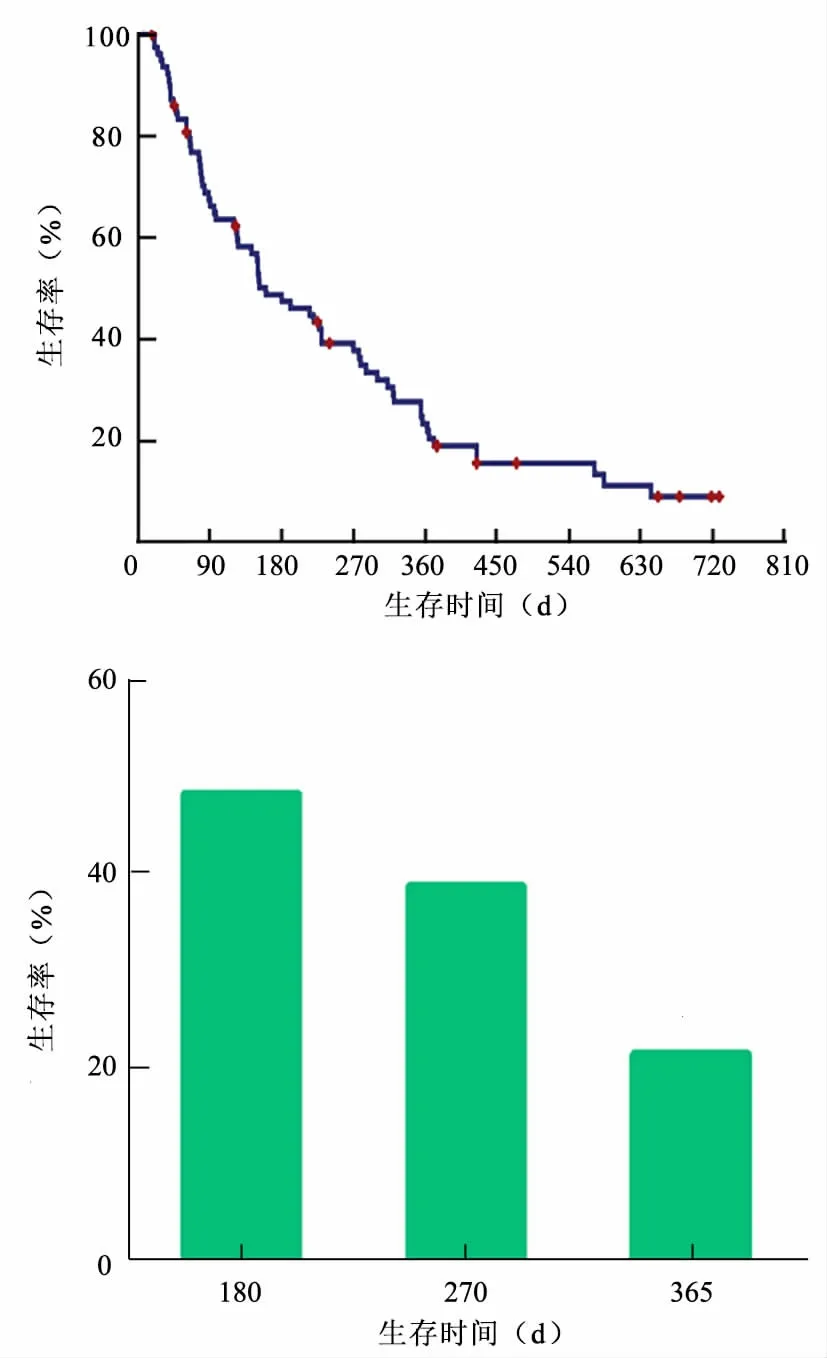
图4 80 例晚期胰腺癌患者介入治疗后的随访结果
化疗超过5 次的患者生存期76~730 d,中位生存期为321 d(95%CI:239.95~402.05 d),6 个月生存率为76.50%,9 个月生存率为64.60%,1 年生存率为38.70%。ECOG 评分0 分的患者生存期为230~730 d,中位生存期为573 d(95%CI:227.63~918.37 d),1 年生存率为80.80%。
4.不良事件:有1 例患者术后第2 天突然出现呼吸、心跳骤停,心脏复苏成功,转ICU,未行化疗。考虑为肿瘤本身的并发症,并非手术并发症。总共有33 例患者(41. 25%)出现不同程度的WBC 减少,其中1~2 级26 例(32.50%),3 级7 例(8.75%),4 级没有。分别有4 例(5%)患者出现3 度的嗜中性白细胞减少和贫血,出现骨髓抑制的中位时间为:10 d。有17 例(21.25%)患者出现恶心,其中绝大多数(11 例,13.75%)为1~2 级,仅有2 例为3 级。出现呕吐者9 例(11.25%),2 例为3 级。发热者3 例,1 级1 例,2 级2 例。总共有2 例患者出现药盒导管堵塞,1 例患者术后28 d 出现药盒导管堵塞,导致化疗时出现药盒穿刺处渗液;1 例患者术后15 个月时出现药盒导管堵塞,2 例均经药盒修正术后继续化疗(表5)。
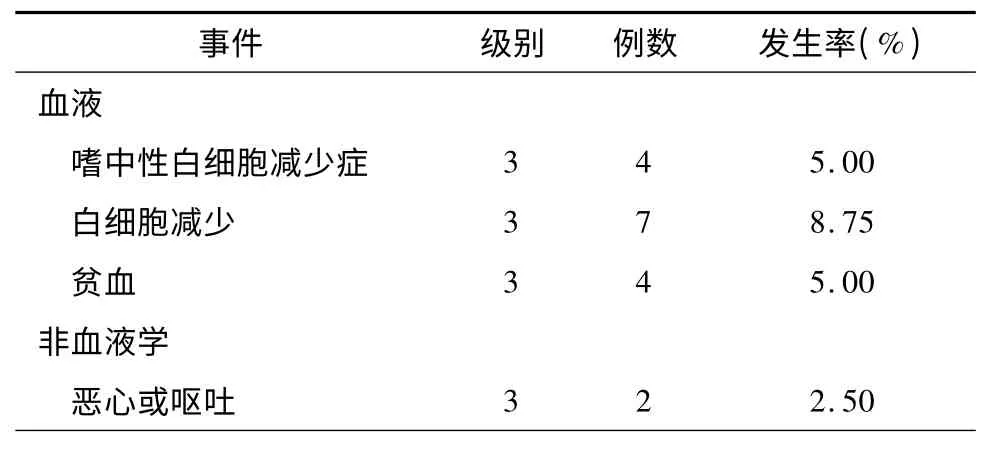
表5 80 例晚期胰腺癌患者介入治疗后的不良事件发生率
讨 论
吉西他滨是胰腺癌化疗的常用药物,既往多采用外周静脉给药,区域动脉化疗尚处于探索阶段。对于局部晚期不可切除及有远处转移的胰腺癌患者,化疗是其主要的治疗手段。然而,胰腺癌是少血供肿瘤,肿瘤细胞被包裹在紧密的、血液供应不良的纤维组织当中,全身静脉给药时化疗药物很难穿透并作用到癌细胞,瘤体内难以达到有效浓度,临床疗效不理想,且全身毒副作用大,患者往往不能耐受。而动脉灌注局部给药可以大大提高胰腺癌灶的药物浓度,从而提高化疗药物的治疗作用。Mitsutsuji等[23]在犬身上用5-Fu 进行胰腺区域性灌注实验时发现,5-FU 在胰腺组织中浓度显著高于全身给药,而外周血中的药物浓度却低于全身给药,因此,动脉灌注化疗不仅可以提高疗效,同时也减少了全身不良反应。该研究采用经药盒胰腺区域动脉灌注化疗治疗晚期胰腺癌,结果显示临床受益反应显著优于既往报道的外周静脉化疗,且不良反应轻微。本组患者最常见的不良反应为骨髓抑制,与全身化疗相同。但骨髓抑制的严重程度明显减轻,无一例4 度的骨髓抑制。其次为消化道反应,其严重程度也低于全身用药。
本组患者的中位生存期与既往文献报道的全身化疗相比没有明显差别。但本组患者中,伴有远处转移的患者占65 例,ECOG 评分2 分的患者13 例,而既往全身化疗很少有ECOG 评分2 分的患者。另外,本组患者中,有44 例化疗≤5 次,14 例患者仅进行了1 次化疗,有4 例患者因病情进展,其他10 例患者均因经济或其他原因未能进行规律化疗。单因素及多因素分析发现,转移、ECOG 评分、化疗次数与患者的生存明显相关,并且是晚期胰腺癌患者预后的独立危险因素。对ECOG 评分0 分,化疗大于5 次的患者分别进行生存分析,结果表明患者的中位生存期分别为:321 d(95%CI:239.95~402.05 d),1 年生存率为38.70%,明显高于既往全身化疗的文献报道。提示如果能进行规律的药物动脉灌注化疗,患者的临床受益及生存获益会更好。
动脉药盒介入治疗,除了胰腺病灶局部药物浓度高之外,化疗药物直接到肝、脾,同时还能经门静脉回注入肝,能有效地预防和治疗胰腺癌肝转移,延长患者的生存期。本组达到PR 的9 例患者,其中有6 例胰腺密灶稳定,肝转移灶明显减少、缩小(图3)。对于肝脏转移灶的治疗,这也是动脉药盒优于全身系统化疗之处。
关于动脉药盒的手术并发症与术者的手术技巧及术后的维护、保养密切相关。比如定期肝素封管、限制患者左肢大幅度活动等。本组仅有2 例患者出现药盒导管的堵塞。未出现气胸、感染、出血等严重并发症。表明经左锁骨下动脉药盒植入术进行晚期胰腺癌的灌注化疗是一种微创、安全的方法。有1 例患者在术后第2 天出天呼吸、心跳骤停,考虑为晚期肿瘤所致的肺栓塞,并非手术所致的并发症。
尽管吉西他滨经动脉药盒灌注化疗尚不能有效改善晚期胰腺癌的客观疗效,但显示出显著的临床受益反应,且患者不良反轻微,临床耐受性良好,值得进行多中心大宗病例前瞻研究,本中心已经设计、开展了经动脉药盒灌注吉西他滨对外周静脉注射吉西他滨治疗晚期胰腺癌的单中心、临床、随机、对照研究,为经左锁骨下动脉药盒置入术治疗晚期胰腺癌获得进一步的循证医学证据。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012.CA Cancer J Clin,2012,62:10-29.
2 Siegel R,DeSantis C,Virgo K,et al. Cancer treatment and survivorship statistics,2012.CA Cancer J Clin,2012,62:220-241.
3 Cao Y,Wu L,Tan A,et al.Meta-analysis of randomized trials:evaluation of benefit of gemcitabine-based molecular targeted therapy for inoperable pancreatic cancer.Pancreas,2010,39:253-255.
4 Reni M,Sartori N,Mambrini A,et al. An Italian study on treatment trends and outcomes of patients with stage Ⅲpancreatic adenocarcinoma in the gemcitabine era:is it time to change?Anticancer Drugs,2010,21:459-464.
5 Uwagawa T,Misawa T,Sakamoto T,et al.A phase Ⅰstudy of fulldose gemcitabine and regional arterial infusion of nafamostat mesilate for advanced pancreatic cancer.Ann Oncol,2009,20:239-243.
6 Sasada T,Denno R,Tanaka T,et al.Intra-arterial infusion chemotherapy with 5-fluorouracil and cisplatin in advanced pancreatic cancer:a feasibility study.Am J Clin Oncol,2008,31:71-78.
7 Nakchbandi W,Müller H,Singer MV,et al. Prospective study on warfarin and regional chemotherapy in patients with pancreatic carcinoma.J Gastrointestin Liver Dis,2008,17:285-290.
8 Ishikawa T,Kamimura H,Tsuchiya A,et al.Clinical efficacy of intraarterial pharmacokinetic chemotherapy with 5-fluorouracil,CDDP,gemcitabine,and angiotensin-Ⅱin patients with advanced pancreatic cancer.Hepatogastroenterolog,2007,54:2378-2382.
9 Milandri C,Calzolari F,Passardi A,et al.Intra-arterial chemotherapy of advanced pancreatic cancer:a single center experience.Hepatogastroenterology,2007,54:2373-2377.
10 Tanaka T,Sakaguchi H,Anai H,et al. Arterial infusion of 5-fluorouracil combined with concurrent radiotherapy for unresectable pancreatic cancer:results from a pilot study.AJR Am J Roentgenol,2007,189:421-428.
11 Barletta E,Fiore F,Daniele B,et al. Second-line intra-arterial chemotherapy in advanced pancreatic adenocarcinoma.Front Biosci,2006,11:782-787.
12 Han GH,Yin ZX,Meng XJ,et al. Prospective randomized clinical trial of two drug delivery pathway in the treatment of inoperable advanced pancreatic carcinoma.Chin J Dig Dis,2006,7:45-48.
13 Mambrini A,Sanguinetti F,Pacetti P,et al.Intra-arterial infusion of 5-fluorouracil,leucovorin,epirubicin and carboplatin(FLEC regimen)in unresectable pancreatic cancer:results of a ten-year experience. In Vivo,2006,20:751-755.
14 Nakchbandi W,Müller H,Singer MV,et al. Effects of low-dose warfarin and regional chemotherapy on survival in patients with pancreatic carcinoma.Scand J Gastroenterol,2006,41:1095-1104.
15 Aigner KR,Gailhofer S. Celiac axis infusion and microembolization for advanced stage Ⅲ/Ⅳpancreatic cancer--a phase Ⅱstudy on 265 cases.Anticancer Res,2005,25:4407-4412.
16 Kuemmerle A,Decosterd LA,Buclin T,et al.A phaseⅠpharmacokinetic study of hypoxic abdominal stop-flow perfusion with gemcitabine in patients with advanced pancreatic cancer and refractory malignant ascites.Cancer Chemother Pharmacol,2009,63:331-341.
17 Pohlen U,Rieger H,Kunick-Pohlen S,et al.Phase Ⅱstudy of regional chemotherapy using the hypoxic abdominal perfusion technique in advanced abdominal carcinoma. 5-FU pharmacokinetics,complications and outcome.Anticancer Res,2007,27:667-674.
18 Guadagni S,Clementi M,Valenti M,et al. Hypoxic abdominal stopflow perfusion in the treatment of advanced pancreatic cancer:a phase Ⅱevaluation/trial.Eur J Surg Oncol,2007,33:72-78.
19 Meyer F,Gebauer T,Grote R,et al.Results of regional chemotherapy uing the aortic stop-flow technique in advanced pancreatic carcinoma.Surg Today,2006,36:155-161.
20 Miyanishi K,Ishiwatari H,Hayashi T,et al. A Phase Ⅰtrial of arterial infusion chemotherapy with gemcitabine and 5-fluorouracil for unresectable advanced pancreatic cancer after vascular supply distribution via superselective embolization.Jpn J Clin Oncol,2008,38:268-274.
21 Ikeda O,Tamura Y,Nakasone Y,et al. Comparison of intrahepatic and pancreatic perfusion on fusion images using a combined SPECT/CT system and assessment of efficacy of combined continuous arterial infusion and systemic chemotherapy in advanced pancreatic carcinoma.Cardiovasc Intervent Radiol,2007,30:912-921.
22 Takamori H,Kanemitsu K,Tsuji T,et al.5-fluorouracil intra-arterial infusion combined with systemic gemcitabine for unresectable pancreatic cancer.Pancreas,2005,30:223-226.
23 Mitsutsuji M,Suzuki Y,Iwanaga Y,et al. An experimental study on the pharmacokinetics of 5-fluorouracil regional chemotherapy for pancreatic cancer.Ann Surg Oncol,2003,10:546-550.
