UPLC/Q-TOF MS法检测和鉴定肿瘤患者血浆和尿中阿帕替尼代谢物
2013-05-25曹广美山东大学药学院山东济南250012
曹广美 (山东大学药学院,山东 济南 250012)
甲磺酸阿帕替尼(apatinib,YN968D1)是一种新型口服小分子血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI)[1-2],由恒瑞医药股份有限公司开发,目前处于III期临床试验阶段,用于胃癌、肺癌、乳腺癌等适应证的治疗。阿帕替尼与同类药瓦他拉尼(valatinib,PTK787)和舒尼替尼(sunitinib)相比显示出更高的体外和体内活性,且在安全性上更优。目前阿帕替尼在人体内代谢过程尚未见研究报道。本实验用UPLC/Q-TOF MS法鉴定阿帕替尼在肿瘤患者血浆和尿中的代谢物,确定阿帕替尼人体内主要代谢途径,可为后期进一步新药开发提供参考[3]。
1 材料与方法
1.1 材料
1.1.1 仪器 Acquity Ultra超高效液相色谱系统及Synapt Q-TOF质谱仪,配有ESI源及 Masslynx V4.1、MetaboLynx、MassFragmentTM等数据处理软件(美国Waters公司)。
1.1.2 药品与试剂 甲磺酸阿帕替尼(批号20101117,纯度99.8%)、顺式-3-羟基阿帕替尼(批号501-000,纯度94.7%)、反式-3-羟基阿帕替尼(批号UTP0137,纯度96.8%)均由江苏恒瑞医药有限公司提供;二磷酸尿苷葡萄糖醛酸(UDPGA,美国Sigma公司);人肝微粒体(HLM,美国BD公司);还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH,德国罗氏公司);β-葡萄糖苷酸酶(101300Units·g-1,美国Sigma公司);盐酸、磷酸氢二钠、磷酸二氢钠、Tris均为分析纯;乙腈、醋酸铵、甲酸均为色谱纯,水为Millipore超纯水。
1.2 方法
1.2.1 色谱条件 Acquity UPLC HSS T3色谱柱(2.1mm×100mm×1.8μm);柱温:40℃;流动相:A(5 mmol·L-1醋酸铵水溶液含0.05%甲酸),B(乙腈);流速0.45 mL·min-1;采用梯度程序洗脱。
1.2.2 质谱条件 ESI电离源,正离子方式检测,雾化气流量700L·h-1,去溶剂温度350℃,离子源温度100℃,毛细管电压3.5 kV。低能量扫描时传输碰撞能量3 eV,阱碰撞能量5 eV;高能量扫描时传输碰撞能量8 eV,阱碰撞能量8~10eV。质量扫描范围m/z80~1 000。
1.2.3 样品采集 5名胃癌患者每天一次口服给予850mg甲磺酸阿帕替尼片,连续28 d。于第28天给药后4 h和6 h采集血浆样品。收集一名乳腺癌患者给药后11 h尿样。
1.2.4 样品处理 取同一时间点不同受试者血浆样品各100μL合并,作为合并血浆样品。取200μL合并血浆,乙腈沉淀蛋白处理后采用UPLC/Q-TOF MS分析;取50μL尿样,乙腈沉淀蛋白处理后采用 UPLC/Q-TOF MS分析。
1.2.5 人肝微粒体(HLM)孵化实验 I相代谢孵化实验:孵化介质为100mmol·L-1磷酸缓冲液(pH 7.4),孵化体系包括1 mg·mL-1的 HLM,2 mmol·L-1的 NADPH,终浓度为2.0μmol·L-1的阿帕替尼、顺式-3-羟基阿帕替尼或反式-3-羟基阿帕替尼,反应60min。II相代谢孵化实验:孵化介质为50mM Tris-HCl缓冲液(pH7.5),孵化体系包括:1 mg·mL-1的 HLM,2 mmol·L-1UDPGA,终浓度为50.0μmol·L-1的阿帕替尼、顺式-3-羟基阿帕替尼或反式-3-羟基阿帕替尼,反应60min。
1.2.6 β-葡萄糖苷酸酶孵化水解试验 取100μL合并血浆,加入2 000U·mL-1的β-葡萄糖苷酸酶溶液100μL,混合并于37℃水浴温孵16 h。
3 结果
3.1 阿帕替尼色谱和质谱分析 阿帕替尼色谱保留时间为11.6 min。低碰撞能量下(图1A),获得[M+H]+离子为m/z 398.199(C24H24N5O+);高碰撞能量下,主要碎片离子有 m/z 371.190、m/z 212.081(相对丰度为100%)和m/z92.051等,推测质谱断裂途径见图1B。断裂主要发生在酰胺键、与吡啶相连的碳-氮键和氰基。本试验将根据这些质谱断裂特点,推测人血浆和尿样中的代谢产物,通过与合成得到的对照品进行色谱、质谱对比,确定代谢物结构。
3.2 患者体内代谢产物鉴定 利用 Metabolynx软件的 Mass Defect Filtering(MDF)和 Dealkylation功能对UPLC/Q-TOF MS数据进行处理,获得血浆和尿样中的代谢物谱(图2)。与空白样品相比,患者口服阿帕替尼后血浆和尿样中共检测到13种相关离子,分别命名为M0~M12,结合紫外检测色谱图(图2),判断患者体内的主要代谢产物。以代谢产物M1、M3和M9为例,阐述代谢产物的结构鉴定过程。
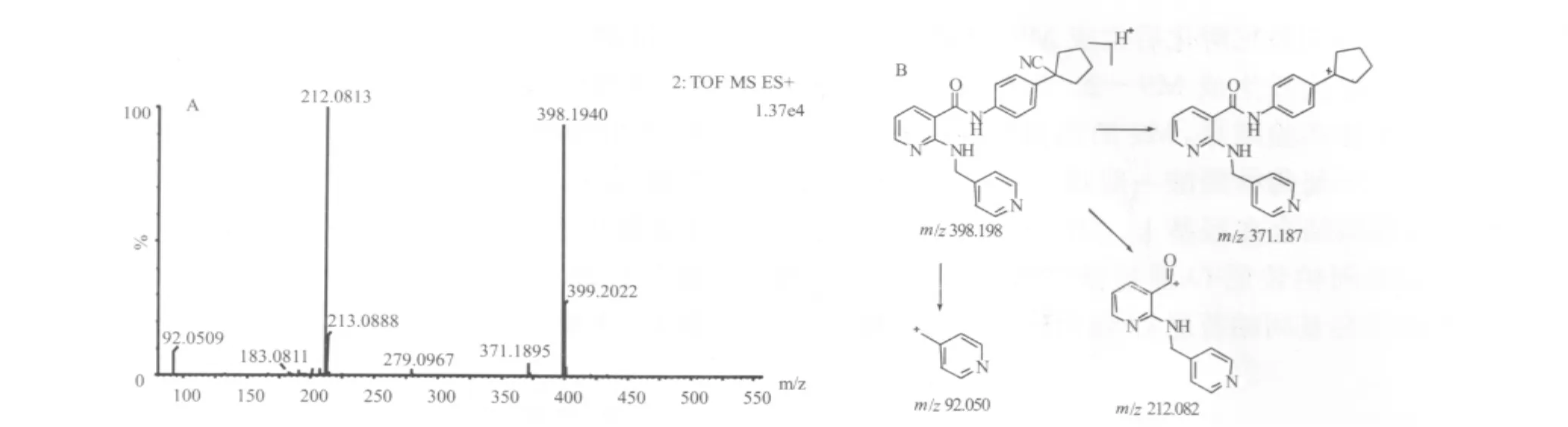
图1 阿帕替尼对照品高碰撞能量全扫描质谱图(A)及推测的质谱断裂途径(B)Fig 1 Mass spectra of the reference substance apatinib under high collision energy with positive detection mode(A)and proposed mass fragmentation pattern of apatinib(B)
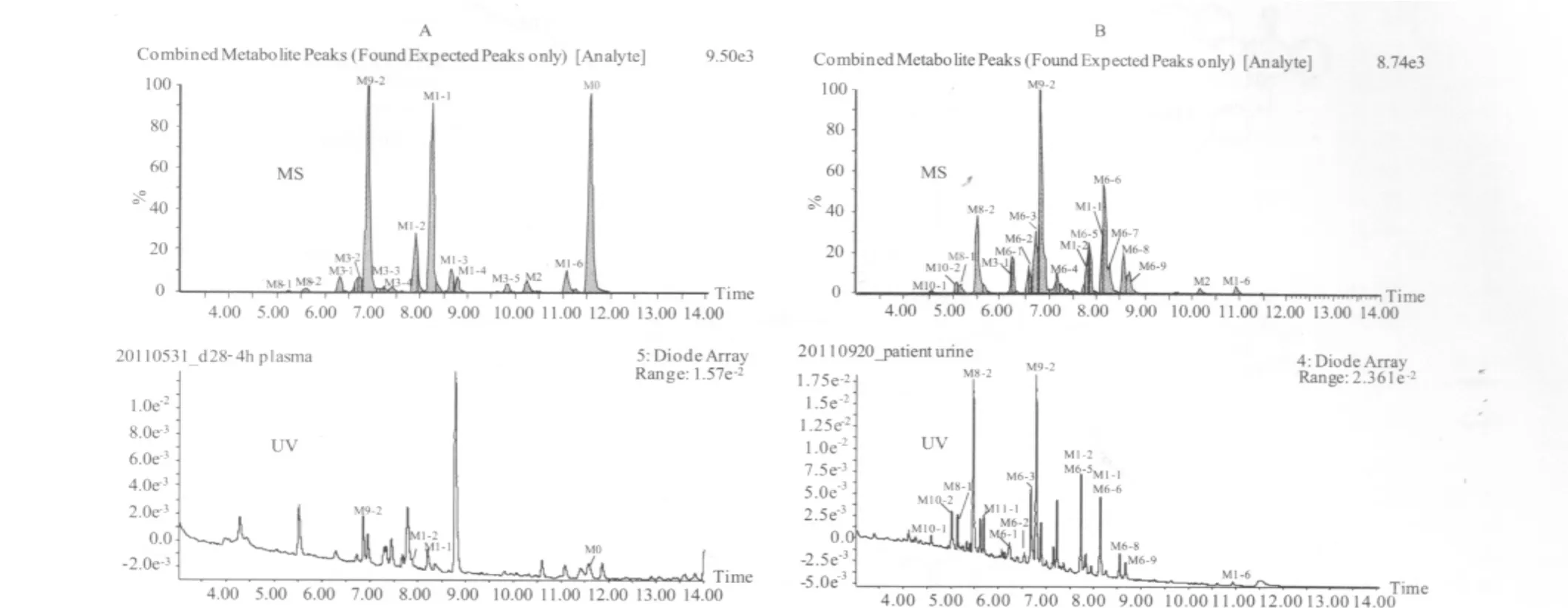
图2 UPLC-UV/Q-TOF MS检测肿瘤患者口服阿帕替尼后血浆(A)和尿(B)的代谢物谱Fig 2 Combined UPLC-UV/Q-TOF MS chromatograms for the metabolites in patient plasma(A)and urine(B)
从低能量 MDF色谱图中提取m/z 414.193(M0+16 Da),在保留时间为8.2、7.9、8.7、8.8、10.3、11.1 min处检测到6个色谱峰,分别命名为M1-1~M1-6。根据精确分子量推测比原形药物增加一个O。在高碰撞能量下,M1-1~M1-4产生的主要碎片离子均为m/z 212.082,与原形相同,推测均为原形酰胺键的氨基部分羟基化产物。通过对比合成的羟基化对照品,确认 M1-1为顺式-3-羟基阿帕替尼,M1-2为反式-3-羟基阿帕替尼。在高碰撞能量下,M1-5产生的主要碎片离子为m/z 228.074,比原形的碎片离子 m/z 212.081增加16 Da,推测M1-5为原形药物酰胺键的酰基部分羟基化产物。在高碰撞能量下,M1-6产生的主要碎片离子包括m/z397.188、228.074、212.089、108.048,其中m/z 228.074和m/z 108.048分别比原形药物的碎片离子m/z212.081和92.051增加16 Da,m/z397.188比 M1-6的分子离子减少17 Da,为N-氧化物的特色碎片断裂方式,m/z 212.089与原形药物相同,推测M1-6为原形药物在吡啶环N-氧化产物。
从低能量 MDF色谱图中提取 m/z 323.151(M0-75 Da),在保留时间为6.3、6.7、7.2、7.4、9.8 min处检测到5个色谱峰,分别命名为M3-1~M3-5。根据精确分子量推测比原形减少C6H5N并增加一个O。在高碰撞能量下,M3-1~M3-4产生的主要碎片离子均为m/z 121.043,比原形的主要碎片离子m/z 212.081减少C6H5N,即一个吡啶甲基。因此推测M3-1~M3-4是为原形药物酰胺键的胺基部分羟基化并N-脱烷基产物。根据人肝微粒体I相代谢孵化结果,反式-3-羟基阿帕替尼孵化后生成 M3-1,顺式-3-羟基阿帕替尼孵化后生成M3-2,因此确定 M3-1是反式-3-羟基阿帕替尼N-脱烷基产物,M3-2是顺式-3-羟基阿帕替尼N-脱烷基产物。在高碰撞能量下,M3-5获得碎片离子m/z 137.0356,比其他 M3的主要碎片离子m/z121.043增加16 Da,推测为原形药物酰胺键的酰基部分羟基化并N-脱烷基产物。
从低能量 MDF色谱图中提取 m/z 590.225(M0+196 Da),在保留时间为6.7 min和6.9 min处检测到2个色谱峰,分别命名为M9-1和M9-2。根据精确分子量推测比原形增加C6H8O7。在高碰撞能量下,M9-1和M9-2产生的主要碎片离子均为 m/z 414.191、212.077和92.052。其中,m/z414.191与M1的分子离子相同且比分子离子m/z590.225减少176 Da(即一个葡萄糖醛酸分子),m/z212.077和m/z 92.052与原形药物相同。因此,推测M9为原形药物羟基化并葡萄糖醛酸结合代谢物。根据人肝微粒体II相代谢孵化结果,反式-3-羟基阿帕替尼孵化后生成 M9-1,顺式-3-羟基阿帕替尼孵化后生成 M9-2。根据β-葡萄糖苷酸酶孵化水解实验结果,M9的色谱峰在孵化后均消失,由于N-葡萄糖醛酸一般难以水解,推测M9的葡萄糖醛酸结合在羟基上。因此确定M9-1是反式-3-羟基阿帕替尼-O-葡萄糖醛酸结合物,M9-2是顺式-3-羟基阿帕替尼-O-葡萄糖醛酸结合物。
3 讨论
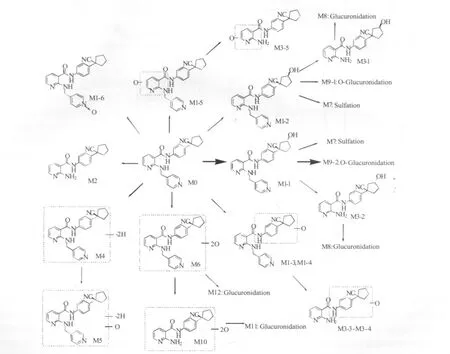
图3 推测的阿帕替尼在肿瘤患者体内的代谢途径Fig 3 Proposed metabolic pathways of apatinib in patients

表1 推测阿帕替尼在人血浆和尿中内代谢产物Tab 1 Identification of apatinib metabolites in human plasma and urine

续表1 推测阿帕替尼在人血浆和尿中内代谢产物Tab 1 Identification of apatinib metabolites in human plasma and urine
阿帕替尼口服给药后在肿瘤患者体内广泛代谢,在肿瘤患者体内共检测到除原形外的49个代谢产物,包括40种I相代谢物及9种II相代谢物,其中血浆中有34个,尿中有43个,推测的代谢途径见图3,代谢产物离子的精确质量信息和元素组成见表1。主要代谢途径为羟基化、N-脱烷基化、氧化脱氢、及葡萄糖醛酸结合。由紫外检测色谱图得知血浆中主要的代谢产物有顺式-3-羟基阿帕替尼、顺式-3-羟基阿帕替尼-O-葡萄糖醛酸结合物和反式-3-羟基阿帕替尼,尿中主要的代谢产物有顺式-3-羟基阿帕替尼-O-葡萄糖醛酸结合物和双羟基化代谢物。血浆中主要代谢物顺式-3-羟基阿帕替尼及其O-葡萄糖醛酸结合物的浓度与原形药物接近或更高,代谢产物的活性和安全性值得关注。
阿帕替尼在人体内羟基化表现出立体选择性,选择性生成更多的顺式-3-羟基阿帕替尼(稳态时顺式-3-羟基阿帕替尼血浆浓度约为反式-3-羟基阿帕替尼浓度的3倍),而体外人肝微粒体孵化过程和化学合成过程均倾向生成更多的反式-3-羟基阿帕替尼。人体内代谢表现出与体外代谢和化学反应相反的立体选择性原因需要进一步研究。
[1]Tian S,Quan HT,Xie CY,eta l.YN968D1is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo[J].Cancer Sci,2011,107(7):1374-1380.
[2]Li J,Zhao XM,Chen L,eta l.Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2inhibitor YN968D1in patients with advanced malignancies[J].BMC Cancer,2010,10:529-536.
[3]Zhu MS,Ma L,Zhang DL,et al.Detection and characterization of metabolites in biological matrices using mass defect filtering of liquid chromatography/high resolution mass spectrometry data[J].Drug Metab Dispos,2006,34(10):1722-1733.
