半纤维素侧链降解酶
——α-葡萄糖醛酸酶的研究进展*
2014-07-01吴金连黎海龙甘礼惠龙敏南
吴金连,薛 勇,黎海龙,甘礼惠,刘 健,龙敏南
(厦门大学能源学院,厦门 361102)
半纤维素侧链降解酶
——α-葡萄糖醛酸酶的研究进展*
吴金连,薛 勇,黎海龙,甘礼惠,刘 健,龙敏南†
(厦门大学能源学院,厦门 361102)
半纤维素是自然界中最丰富的可再生资源之一,将半纤维素降解为单糖并转化为燃料或化学品一直是科学界研究的热点。半纤维素是由木糖基主链以及α-葡萄糖醛酸等侧链共同组成的异质多聚体。α-葡萄糖醛酸酶是半纤维素完全降解过程中的关键酶之一,能够水解4-O-甲基葡萄糖醛酸与木糖之间的α-1,2-糖苷键。本文综述了α-葡萄糖醛酸酶的分类、催化机制及晶体结构、酶学性质和基因克隆表达等方面的研究进展,同时对该研究进行了展望。
半纤维素;α-葡萄糖醛酸酶;结构;催化机理;酶学特性
0 前 言
半纤维素是自然界中最丰富的可再生资源之一,广泛存在于植物细胞壁中,其含量约占植物细胞总干重的25%~40%,储量仅次于纤维素[1]。半纤维素的利用与转化对于解决目前世界石油危机、能源与人争粮、温室效应等全球问题具有非常重要的作用,因此其有效利用日益受到世界各国的广泛关注。但是,与纤维素相比,半纤维素结构成分复杂,除了由 β-D-吡喃木糖残基经 β-1,4-糖苷键连接而成的主链外,还含有不同侧链取代基,如4-O-甲基葡萄糖醛酸侧链、α-L-呋喃型阿拉伯糖侧链以及少量通过L-阿拉伯糖残基连接的阿魏酸或香豆酸侧链等[2]。半纤维素的复杂结构决定了其彻底的降解需要半纤维素酶水解酶系中各种酶的协同作用,主要包括降解木聚糖主链的内切木聚糖酶和β-木糖苷酶,还有降解侧链的 α-阿拉伯呋喃糖苷酶、α-葡萄糖醛酸酶、乙酰木聚糖酯酶和酚酸酯酶等[3]。其中,α-葡萄糖醛酸酶对于半纤维素的生物转化起着非常重要的作用。
α-葡萄糖醛酸酶(EC 3.2.1.131,EC 3.2.1.-)是一种半纤维素侧链水解酶,主要作用于4-O-甲基葡萄糖醛酸与木糖之间的α-1,2-糖苷键,在半纤维素降解过程中与半纤维素降解酶系的其他酶相互促进,实现木聚糖的高效水解[2]。由于该酶的总活性较低,对应的酶促反应往往是半纤维素系列水解反应的控制性步骤。因此,对该酶的研究对于半纤维素的高效利用具有重大意义。相对于半纤维素降解酶系的其他酶,α-葡萄糖醛酸酶被发现较晚,直到1981年才被人们发现[4]。随着对半纤维素及半纤维素酶的深入研究,α-葡萄糖醛酸酶的生物技术潜力越来越受到人们的重视。
1 α-葡萄糖醛酸酶的分类
1991年,Henrissat等[5]根据氨基酸序列的相似性把糖基水解酶分成不同的家族。2009年 Cantarel等[6]将来自不同微生物的 α-葡萄糖醛酸酶分为两大类,即糖苷水解酶(Glycoside hydrolases)第67(GH 67)和第115(GH 115)家族,见表1。其中第67家族α-葡萄糖醛酸酶大多都来自细菌,而第115家族大多来自真菌。
不同家族的α-葡萄糖醛酸酶在作用于葡萄糖醛酸木聚糖时显示出不同的底物特异性。第67家族的α-葡萄糖醛酸酶只能作用于残基数在2~5之间的小分子 4-O-甲基葡糖醛酸低聚木糖,且只能水解非还原末端的4-O-甲基葡萄糖醛酸侧链[7,8]。而GH 115家族的α-葡萄糖醛酸酶具有更广泛的底物特异性,不仅能够从4-O-甲基葡糖醛酸低聚糖的非还原端水解下4-O-甲基葡萄糖醛酸,还能够作用于长链4-O-甲基葡糖醛酸木聚糖内部的4-O-甲基葡萄糖醛酸侧链将 4-O-甲基葡萄糖醛酸从木聚糖主链的 α-1,2-糖苷键中释放[9,10],见图1。

表1 α-葡萄糖醛酸酶的分类Table 1 Classification of α-glucuronidase
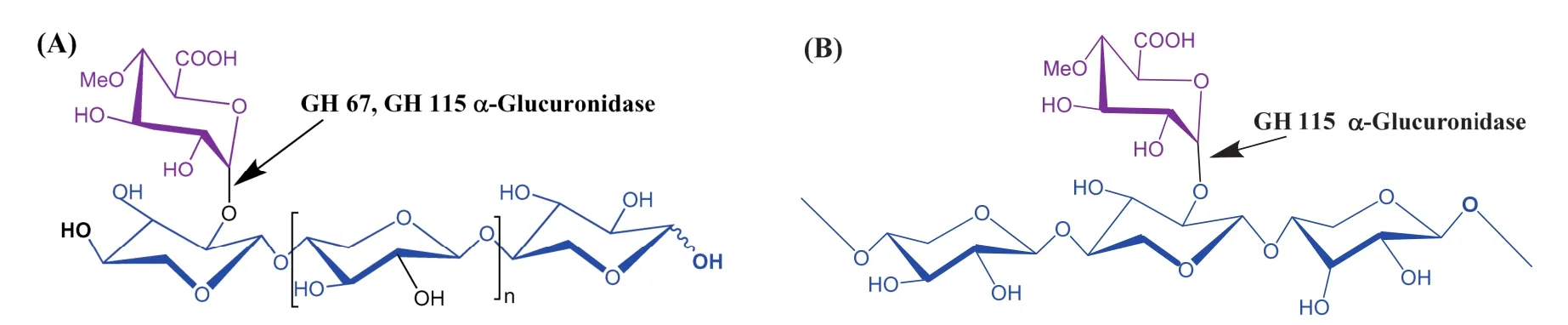
图1 α-葡萄糖醛酸酶GH 67和GH 115底物特异性差异Fig. 1 The substrate specificity between α-glucuronidase GH 67 and GH 115 (A) α-Glucuronidase GH 67 (n=0, 1, 2, 3) and GH 115 (n ≥ 0) release 4-O-methyl glucuronic acid from the terminal non-reducing end xylopyranosyl unit of xylo-oligosaccharides; (B) Family 115 α-glucuronidase also release 4-O-methyl glucuronic acid which is linked to the internal xylosyl residues
2 α-葡萄糖醛酸酶的催化机理及晶体结构
2.1 α-葡萄糖醛酸酶降解葡萄糖醛酸木聚糖的催化机理
在半纤维素的水解过程中,α-葡萄糖醛酸酶(EC 3.2.1.131,EC 3.2.1.-)主要作用于α-葡萄糖醛酸或 4-O-甲基葡萄糖醛酸与主链木糖残基之间的α-1,2-糖苷键,图2简要地显示了半纤维素的结构及半纤维素降解酶系中各酶的作用位点[9]。
目前关于 α-葡萄糖醛酸酶在木聚糖水解过程中具体的催化机制研究较少。迄今为止,研究认为α-葡萄糖醛酸酶在酶水解过程中的催化机制有单一置换机制(Single displacement mechanism)和底物辅助催化机制(Substrate-assisted catalysis mechanism)。不管是属于GH 67家族还是GH 115家族,单一置换机制是目前被广泛认同的 α-葡萄糖醛酸酶催化机制。这种催化机制认为:α-葡萄糖醛酸酶在水解4-O-甲基葡萄糖醛酸低聚糖底物时,酶与底物结合后,底物上的4-O-甲基葡萄糖醛酸(MeGlcA)异头碳构型发生反转(α-端基异构反转成 β-端基异构)从而水解α-1,2-糖苷键;一般在水解过程中,酶分子中的一个羧酸残基作为酸而其他(如底物)作为一般的碱。2000年,Biely等[10]首次提出Aspergillus tubingensis的GH 67家族α-葡萄糖醛酸酶属于这一催化机制。此后,Kolenová等[11]用类似的方法研究,发现GH 115家族的α-葡萄糖醛酸酶也属于这一催化机制。此外,Golan等[12]通过 α-葡萄糖醛酸酶在催化水解底物时“open”和“closed”(催化)构象的改变推测:Asp-364和Glu-392共同激活亲核水分子,亲核水分子将 Glu-285质子化,而质子化了的Glu-285更容易接近带负离子的底物,进而推测α-葡萄糖醛酸酶在水解木聚糖时的催化机制是底物辅助催化机制。

图2 半纤维素结构及半纤维素酶系对其降解作用Fig. 2 Schematic of hemicellulose and hemicellulose-hydrolases
通过对功能性氨基酸残基的深入研究,进一步揭示了α-葡萄糖醛酸酶的催化机制。2002年,Didier等[13]在研究Pseudomonas cellulosaα-葡萄糖醛酸酶GlcA67A的晶体结构时发现 Arg325、Lys288和Lys360有助于酶与底物的识别,Trp543能够促进酶与底物的结合,而Glu292是酶催化活性中心的关键残基。2003年,Nagy等[14]也在Cellvibrio japonicusα-葡萄糖醛酸酶发现了功能性氨基酸 Glu-393和Asp-365具有催化功能;Lys-288、Arg-325和Lys-360在酶与底物的4-O-甲基葡萄糖醛酸羧基结合中起着重要作用,因此这三个氨基酸为酶的底物结合位点功能性氨基酸。同样,Golan等[15]也通过晶体结构和定点突变的研究确定了Geobacillus stearothermophilusα-葡萄糖醛酸酶中Glu386对于酶的催化活性起重要作用,而三个保守氨基酸残基(Glu285、Asp364和 Glu392)是该酶的催化残基;最近,Rogowski等[9]详细研究了Bacteroides ovatusα-葡萄糖醛酸酶的结构后确定了一些功能性氨基酸的催化功能:His422和Tyr420决定酶的底物特异性,Trp249参与酶的催化活力,Tyr792对于酶与木聚糖底物的结合有重大贡献,His422是酶催化装置的重要组成部分,Asp-332或Glu-375在酶水解催化过程中也具有重要作用,但是它们的具体作用还不太清楚,有待进一步深入研究。一般酸性氨基酸诸如谷氨酸、天冬氨酸参与酶的催化活性,一些碱性氨基酸如精氨酸、组氨酸、赖氨酸等是酶底物结合域的关键残基。
2.2 晶体结构
随着对α-葡萄糖醛酸酶研究的不断深入,其分子结构也不断得到确认。通过对酶晶体结构的研究表明,来源于细菌的 α-葡萄糖醛酸酶一般以二聚体的形式实现其催化功能,而大部分来源于真菌的α-葡萄糖醛酸酶在催化水解时没有三维二聚体结构,只以单体蛋白的形式实现酶催化水解[12]。2004年,Golan等[15]通过X射线单晶衍射首次确定了来自G. stearothermophilusα-D-葡萄糖醛酸酶的结构,该酶以二聚体形式存在,每个单体由三个独立的结构域通过环(loops)相互联系:N-末端结构域(1~142)、一个(β/α)8TIM桶状结构域(143~471)和C-末端结构域(472~780)。其中每个结构域之间通过如下位点连接:(β/α)8结构域的Trp-328和Arg-329,C-末端的Glu-536、Arg-548、Glu-654、Asp-657、Arg-665和Lys-666,该酶的结构可见图3。2010年,Fujimoto等[17]对Streptomyces pristinaespiralisα-葡萄糖醛酸酶进行了结晶,并初步分析了该酶的晶体结构。2014,Rogowski等[9]更精确地确定了GH 115家族α-葡萄糖醛酸酶的结构,这是GH 115家族最具代表性的蛋白结构,该酶含有四个结构域:N-末端结构域(33~196)、(β/α)8TIM桶状结构域(197~482)、由5个螺旋束组成的结构域(488~641)和一个典型的β-三明治折叠的C端结构域(1~32,673~844和483~487),通过结构的研究以及结合突变研究技术,该酶的功能性氨基酸也得到了确认。

图3 G. stearothermophilusα-D-葡萄糖醛酸酶的结构[16]Fig 3. Structure ofG. stearothermophilusα-D-glucuronidase [The polypeptide chain is coloured from N terminus (blue) to C terminus (red)]
3 α-葡萄糖醛酸酶的酶学特性
不同微生物所产的α-葡萄糖醛酸酶的分子量、等电点、pH值作用范围、温度作用范围等都有一定的差异,而酶学性质的差异直接影响其使用条件和应用领域,尤其是最适pH和热稳定性。
一般来说,大多数来自细菌的α-葡萄糖醛酸酶的预测分子量约为70 kDa,而来自真菌的葡萄糖醛酸酶单体蛋白分子量较大,约为90 kDa[18]。至今已报道的α-葡萄糖醛酸酶的等电点多数为弱酸性。各种不同来源α-葡萄糖醛酸酶的酶学性质见表2。

表2 几种不同来源α-葡萄糖醛酸酶的酶学特性Table 2 Enzymatic charaterization of α-glucuronidase from different microorganisms
3.1 温度对α-葡萄糖醛酸酶活性的影响
温度对酶活性有很大的影响,在较低的温度范围内,酶反应速率随温度升高而增大,但随着温度的升高,酶蛋白逐渐变性而失活,引起酶反应速率下降。因此,在工业应用中,酶的热稳定性成为重要的考虑因素。
α-葡萄糖醛酸酶的最适反应温度随来源于不同的菌株有较大的差异,一般在40℃~65℃(见表2),但是从海栖热袍菌(Thermotoga maritimeMSB8)中分离纯化得到的α-葡萄糖醛酸酶最适反应温度达到85℃,其活性可在75℃维持140 h以上,在95℃保持5 h以上还有20%的酶活力[20]。耐热菌株的出现有利于酶的贮存和工业化处理,具有很高的工业应用价值。
3.2 pH值对α-葡萄糖醛酸酶活性的影响
多数α-葡萄糖醛酸酶的最适pH值在3.5~6.0之间,但也有部分菌株所产α-葡萄糖醛酸酶的最适pH值为接近中性或弱碱性。如2008年,Iihashi等[28]从细菌Paenibacillus sp.TH501b中纯化的α-葡萄糖醛酸酶在pH值6.0~7.0表现出最大的酶活力,且在pH值为7.0时该酶最稳定。2012年,Lee等[29]从堆肥中的微生物中分离并克隆得到α-葡萄糖醛酸酶基因,该基因表达的酶最适pH值为7~8;还有,从Thermotoga maritima菌中获得的α-葡萄糖醛酸酶最适pH值为7.8[31]。
3.3 金属离子对 α-葡萄糖醛酸酶酶活性的影响
除温度和pH值外,α-葡萄糖醛酸酶的结构及活性也会受到金属离子的影响,在工业应用中某些金属离子对酶的激活或抑制作用也是衡量该酶工业用途的重要参数。研究表明,金属离子的种类以及浓度均会对 α-葡萄糖醛酸酶的活性产生显著影响。例如,一般重金属(Hg2+、Cu2+、Co2+、Zn2+等)和一些有机物(尿素、EDTA、DMSO等)会抑制α-葡萄糖醛酸酶的活力,而Ca2+和Mg2+能够稳定“酶-底物”复合物从而提高酶活力[16]。Ruile等[22]曾报道了Ag+、Cd2+、Hg2+、Pb2+、Cu2+和Zn2+对α-葡萄糖醛酸酶有强烈的抑制作用,而低浓度的Fe2+、Ca2+及K+均可以提高酶的活力。
4 α-葡萄糖醛酸酶基因的克隆及表达
近年来,越来越多的α-葡萄糖醛酸酶从细菌和真菌等微生物中被纯化、克隆和表达(见表2)。细菌来源的酶有Thermoanaerobacteriumpolysaccharolyticum、Cellvibrio japonicus、Ruminococcus albus、Thermotoga maritima、Bacteroides ovatus和Paenibacillus polymyxa等。例如,Ruile等[22]从Thermotoga maritimeMSB8基因文库中筛选得到6.5 kb DNA片段,并对其进行核酸序列分析、缺失实验及在大肠杆菌中表达,最后分离到一个编码674个氨基酸的α-葡萄糖醛酸酶基因。在国内,薛业敏等[32]也从极端嗜热厌氧细菌海栖热袍菌(Thermotoga maritime)中克隆了α-葡萄糖醛酸酶基因并实现了其在大肠杆菌中的高效表达。真菌来源被研究的酶有Aspergillus niger、Talaromyces emersonii、Botryotinia fuckeliana、Pichia stipitis、Schizophyllum commune、Sporisorium reilianum、Thielavia terrestris、Paenibacillussp、Phanerochaete chrysosporium、Aureobasidium pullulans等。被克隆和表达的 α-葡萄糖醛酸酶基因也都大部分来自真菌,如1997年首次从T. reeseiRut-30克隆的α-葡萄醛酸基因grlI,其核酸序列含有2541 bp的开放阅读框,编码847个氨基酸[33];2007年,Heneghan等[19]从嗜热真菌Talaromyces emersonii克隆了 α-葡萄糖醛酸酶aguA基因,该基因没有内含子,由一个2511 bp的开放阅读框组成,能够编码837个氨基酸。2008年,Lee等[29]利用燕麦木聚糖、桦木木聚糖和山毛榉木聚糖作为碳源从堆肥中的混合种群微生物中分离到 3.9 kb的基因组 DNA,进而将克隆到的α-葡萄糖醛酸酶基因deg75-AG转化进大肠杆菌BL21(DE3)pLysE中进行IPTG诱导表达。Rogowski等[9]又从Bacteroides ovatus基因组DNA中克隆得到GH 115家族α-葡萄糖醛酸酶基因BoAgu115A,该基因编码一个824个氨基酸的蛋白质。将来,随着对木聚糖酶系的深入研究,具有各种不同酶学特性的α-葡萄糖醛酸酶将会被一一克隆与表达。
5 α-葡萄糖醛酸酶的应用前景及展望
α-葡萄糖醛酸酶具有良好的应用前景。能源工业方面,α-葡萄糖醛酸酶能够协同内切木聚糖酶和β-木糖苷酶将半纤维素彻底降解为木糖,而木糖可被细菌或真菌转化为液体燃料如酒精等。食品领域方面,α-葡萄糖醛酸酶能够与其他半纤维素酶共同降解果汁、啤酒中的一些多糖,有利于果汁、啤酒的澄清,α-葡萄糖醛酸酶对于提高低聚木糖的产率也具有重要应用价值。在工程菌株的构建方面,α-葡萄糖醛酸酶的研究对于构建能够合理地高产所有半纤维素酶系的工程菌株具有重要作用。
虽然近几年对于α-葡萄糖醛酸酶的研究进展很快,但还存在一些问题需要更加深入的研究。首先,详细阐明 α-葡萄糖醛酸酶催化反应机制对于更好地利用该酶具有重大的意义,然而,现在的研究还不够深入,比如酶与底物相互作用的精确模式等还有待进一步深入研究。其次,目前虽然有文献报道α-葡萄糖醛酸酶能与内切木聚糖酶或 β-木糖苷酶协同并促进降解木聚糖,但还无法完全解释α-葡萄糖醛酸酶与内切木聚糖酶或 β-木糖苷酶协同降解机理;同时,不同家族的α-葡萄糖醛酸酶有不同的水解催化特性,研究也报道了这些差异的存在可能与酶的拓扑学结构有关,但明确的机理还有待更深入的证实。目前,α-葡萄糖醛酸酶已经从不同的微生物中被纯化或克隆表达获得,但所获得的酶活力均不高,因此探索合适的培养基来实现该酶的高效表达,对于工业应用具有很高的价值,这也是今后研究的一个重要方向。此外,如何利用葡萄糖醛酸酶与阿拉伯糖糖苷酶或β-木糖苷酶等半纤维素酶协同作用可控地降解半纤维素,以获得高价值产品,也将是科研工作者的研究方向。
[1] Peng F, Peng P, Xu F, et al. Fractional purification and bioconversion of hemicelluloses[J]. Biotechnol Adv, 2012, 30(4): 879-903.
[2] 阮同琦, 赵祥颖, 刘建军. 木聚糖酶及其应用研究进展[J]. 山东食品发酵, 2008, 1: 42-45.
[3] Han Y, Agarwal V, Dodd D, et al. Biochemical and structural insights into xylan utilization by the thermophilic bacterium Caldanaerobius polysaccharolyticus[J]. J. Biol. Chem, 2012, 287(42): 34946-34960.
[4] Johnson K G, Silva M C, Mackenzie C R, et al. Microbial Degradation of Hemicellulosic Materials[J]. Appl Biochem Biotechnol, 1989, 20(21): 245-259.
[5] Henrissat B. A classification of glycosyl hydrolases based on amino acid sequence similarities[J]. Biochem. J., 1991, 280: 309-316.
[6] Cantarel B L, Coutinho P M, Rancurel C, et al. The Carbohydrate-Active EnZymes database (CAZy): an expert resource for Glycogenomics[J]. Nucleic Acids Res, 2009, 37: D233-D238.
[7] De Wet B J M, Van Zyl W H, Prior B A. Characterization of theAureobasidium pullulansα-glucuronidase expressed inSaccharomyces cerevisiae[J]. Enzyme Microb. Technol, 2006, 38(5): 649-656.
[8] De Wet B J M, Van Zyl W H, Prior B A. Microbial α-glucuronidases: In Lignocellulose Biodegradation[M]. Washington, DC: American Chemical Society, 2004, 241-254.
[9] Rogowski A, Baslé A, Farinas C S, et al. Evidence that GH115 α-glucuronidase activity, which is required to degrade plant biomass, is dependent on conformational flexibility[J]. J. Biol. Chem, 2014, 289(1): 53-64.
[10] Biely P, de Vries R P, Vrsanska M, et al. Inverting character of α-glucuronidase A fromAspergillus tubingensis[J]. Biochim. Biophys. Acta, 2000, 1474: 360-364.
[11] Kolenová K, Ryabova O, Vrsanská M, et al. Inverting character of family GH115 α-glucuronidases[J]. FEBS Lett, 2010, 584(18): 4063-4068.
[12] Shallom D, Golan G, Shoham G, et al. Effect of dimer dissociation on activity and thermostability of the α-glucuronidase fromGeobacillus stearothermophilus: dissecting the different oligomeric forms of family 67 glycoside hydrolases[J]. J. Bacteriol, 2004, 186(20): 6928-6937.
[13] Didier N, Tibor N, Harry J Gilbert, et al. The Structural Basis for Catalysis and Specificity of thePseudomonas cellulosaα-Glucuronidase, GlcA67A[J]. Structure, 2002, 10: 547-556.
[14] Nagy T, Nurizzo D, Davies G J, et al. The α-glucuronidase, GlcA67A, ofCellvibrio japonicusutilizes the carboxylate and methyl groups of aldobiouronic acid as important substrate recognition determinants[J]. J. Biol. Chem, 2003, 278(22): 20286-20292.
[15] Golan G, Shallom D, Teplitsky A, et al. Crystal structures ofGeobacillus stearothermophilusα-glucuronidase complexed with its substrate and products: mechanistic implications[J]. J. Biol. Chem, 2004, 279(4): 3014-3024.
[16] Juturu V, Wu J C. Insight into microbial hemicellulases other than xylanases: a review[J]. J. Chem. Technol. Biotechnol, 2013, 88(3): 353-363.
[17] Fujimoto Z, Ichinose H, Biely P, et al. Crystallization and preliminary crystallographic analysis of the glycoside hydrolase family 115 α-glucuronidase fromStreptomyces pristinaespiralis[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2011, 67: 68-71.
[18] Tenkanen M, Siika-aho M. An α-glucuronidase ofSchizophyllum communeacting on polymeric xylan[J]. J. Biotechnol, 2000, 78: 149-161.
[19] Heneghan M N, McLoughlin L, Murray P G, et al. Cloning, characterisation and expression analysis of α-glucuronidase from the thermophilic fungusTalaromyces emersonii[J]. Enzyme Microb. Technol, 2007, 41: 677-682.
[20] Lee C C, Kibblewhite R E, Wagschal K, et al. Isolation of α-glucuronidase enzyme from a rumen metagenomic library[J]. Protein J, 2012, 31(3): 206-211.
[21] Bronnenmeier K, Meissner H, Stocker S, et al. α-D-Glucoronidases from the xylanolytic thermophilesClostridium stecorariumandThermoanaerobacterium saccharolyticum[J]. Microbiology, 1995, 141: 2033-2040.
[22] Ruile P, Winterhalter C, Liebl W. Isolation and analysis of a gene encoding α-glucuronidase, an enzyme with a novel primary structure involved in the breakdown of xylan[J]. Mol. Microbiol, 1997, 23(2): 267-279.
[23] Chow V, Nong G, Preston J F. Structure, function, and regulation of the aldouronate utilization gene cluster fromPaenibacillussp. strain JDR-2[J]. J Bacteriol, 2007, 189(24): 8863-8870.
[24] Shao W, Obi S, Puls J, et al. Purification and characterization of the α-glucuronidase fromThermoanaerobacteriumsp. strain JW/SL-YS485, an important enzyme for the utilization of substituted xylans[J]. Appl. Environ. Microbiol, 1995, 61: 1077-1081.
[25] Castanares A, Hay A J, Gordon A H, et al. D-Xylan-degrading enzyme system from the fungusPhanerochaete chrysosporium: isolation and partial characterisation of α-(4-O-methyl)-D-glucuronidase[J]. J. Biotechnol, 1995, 43: 183-194.
[26] Ryabova O, Vrsanska M, Kaneko S, et al. A novel family of hemicellulolytic α-glucuronidase[J]. FEBS Lett, 2009, 583(9): 1457-1462.
[27] De Vries R, Poulsen C H, Madrid S, et al. aguA, the gene encoding an extracellular α-glucoronidase fromAspergillus tubingensis, is specifically induced on xylose and not on glucoronic acid[J]. J. Bacteriol, 1998, 180(2): 243-249.
[28] Iihashi N, Nagayama J, Habu N, et al. Enzymatic degradation of amylouronate (α-(1→4)-linked glucuronan) by α-glucuronidase fromPaenibacillussp. TH501b[J]. Carbohydr. Polym, 2009, 77(1): 59-64.
[29] Lee C C, Kibblewhite R E, Wagschal K, et al. Isolation and characterization of a novel GH67 α-glucuronidase from a mixed culture[J]. J. Ind. Microbiol. Biotechnol., 2012, 39 (8): 1245-1251.
[30] Siika-aho M, Tenkanen M, Buchert J, et al. An α-glucuronidase fromTrichoderma reeseiRUT C-30 [J]. Enzyme Microb. Technol., 1994, 16: 813-819.
[31] Suresh C, Kitaoka M, Hayashi K. A thermostable non-xylanolytic α-glucuronidase ofThermotoga maritimaMSB8[J]. Biosci Biotechnol Biochem, 2003, 67(11): 235-236.
[32] 薛业敏, 毛忠贵, 邵蔚蓝. 极端嗜热菌海栖热袍菌α-葡萄糖醛酸酶的高效表达和重组酶的纯化[J]. 生物工程学报, 2004, 20(4): 554-560.
[33] Margoll ES-C, Saloheimo M, Penttila M, et al. The α-glucuronidase gene encoding gene ofTrichoderma reesei[J]. Gene, 1997, 172: 171-172.
Research Progress of α-Glucuronidase, an Enzyme for Degrading Hemicellulose Side-Chain
WU Jin-lian, XUE Yong, LI Hai-long, GAN Li-hui, LIU Jian, LONG Min-nan
(College of Energy, Xiamen University, Xiamen 361102, China)
Hemicellulose is one of the most abundant renewable resources in nature. The bioconversion of hemicellulose into biofuels or chemicals is a research hotspot in the world. Hemicellulose consists of a backbone of xylan residues and some branches like glucuronic acid. α-Glucuronidase, which is capable to hydrolysis the α-1,2-glycosidic bond between xylan and glucuronic acid, is one of the key enzyme to degrade hemicellulose completely. The recent research progresses on catalysis mechanism, structure, charaterization, and gene cloning of α-glucuronidase are summarized in this paper.
hemicellulose; α-glucuronidase; structure; catalysis mechanism; enzymatic charaterization
TK6;Q55
A
10.3969/j.issn.2095-560X.2014.05.001
2095-560X(2014)05-0327-07
吴金连(1989-),女,硕士研究生,主要从事半纤维素酶的表达与生物质能源研究。
2014-08-29
2014-09-06
国家自然科学基金(31170067,21303142);国家重点基础研究发展计划(973计划,2010CB732201);福建省自然科学基金(2012J05029);农业部“引进国际先进农业科学技术”项目(2013-Z70)
† 通信作者:龙敏南,E-mail:longmn@xmu.edu.cn
龙敏南(1965-),男,博士,教授,博士生导师,主要从事生物质转化制生物基燃料与生物基化学品的研究与技术开发。
