高效液相色谱-荧光法测定大鼠体内金丝桃素血药浓度及其药动学
2013-05-25姚婷婷章礼久方海明夏泉朱丽丽杨姣安徽医科大学第二附属医院消化内科安徽合肥3060安徽医科大学第一附属医院药剂科安徽合肥300
姚婷婷,章礼久,方海明,夏泉,朱丽丽,杨姣 (.安徽医科大学第二附属医院消化内科,安徽 合肥 3060;.安徽医科大学第一附属医院药剂科,安徽 合肥 300)
贯叶连翘(Hypericum perforatumL.)为藤黄科金丝桃属多年生草本植物,是国际医药市场上最重要的治疗轻、中度抑郁症的植物制剂原料,萘骈二蒽酮类化合物金丝桃素(Hypericin,Hyp)是贯叶连翘中最具有生物活性的物质,具有光敏性,易溶于吡啶和其他有机胺类[1],是贯叶连翘抗抑郁的有效成分。在欧洲,尤其在德国长期用作抗抑郁药物[2-5]。近年来在抗病毒及癌症的光动力学治疗方面有着十分活跃的研究,具有重要的新药开发价值[6]。贯叶连翘主要分布于我国西南、西北如:河北、河南、陕西等省,生于山区河从草地,山坡和灌丛中。目前国内有关Hyp相关研究主要集中于Hyp分离提取、含量测定及药效学,而Hyp药动学相关研究较少,本试验拟建立大鼠血浆内Hyp浓度高效液相法,并初步探讨Hyp静脉药动学特点。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 日本岛津LC-20AT系列全自动高效液相色谱仪,RF-10A XL荧光检测器,LC solution数据采集处理工作站(日本岛津),TU-1800STC紫外可见分光光度计(北京普析通用仪器公司);TGL-16R高速冷冻离心机(珠海黑马医学仪器有限公司);JK300B超声波清洗器(合肥金尼克机械制造有限公司);HealForceCROB超纯水机(HealForce力康公司)、氮吹仪、WH-2微型漩涡混合仪(上海沪西分析仪器厂有限公司)。Hyp对照品(成都普瑞法科技开发有限公司,纯度98%,批号548-04-9),甲醇、乙腈均为色谱纯,磷酸二氢钠为分析纯。
1.1.2 实验动物 Wistar大鼠,♀♂雌雄各半,平均体质量为(250±5)g,购于安徽长临河医药科技有限公司[许可证号:SCXK(皖)2007-001]。
1.2 方法
1.2.1 Hyp储备液制备 精密称取Hyp对照品溶于甲醇-吡啶(9∶1)混合液中并进行超声溶解,配制成10μg·mL-1储备液。
1.2.2 色谱条件 色谱柱:大连依利特Kromasil C18柱(5μm,4.6 mm×200mm);流动相:甲醇-乙腈-1%磷 酸 二 氢 钠 (65∶30∶5);流 速:1.0mL·min-1;柱温40℃;荧光检测激发波长315 nm、检测波长590nm;进样20μL。
1.2.3 大鼠血浆生物样品处理 参考文献[7]并改良,精密取大鼠血浆100μL,加入300μL甲醇-吡啶(9∶1)混合液后,涡旋振荡1 min,14 000r·min-1离心3 min,后取上清液57℃氮气吹干,加入200μL流动相溶解残渣,再次涡旋振荡1 min,14 000r-1·min离心3 min,取上清液20μL进样分析。
1.2.4 Hyp标准曲线的建立 精密吸取上述储备液适量,分别加入100μL大鼠空白血浆样品,使Hyp血浆样品终浓度分别为5、10、25、100、250ng·mL-1。采用上述处理方法处理血浆后,取样20μL进样测定。记录样品峰面积,对血浆药物浓度进行线性回归,得到血浆样品的线性回归方程。
1.2.5 精密度和回收率 分别取浓度为5、25、250ng·mL-1Hyp血浆样品,在1 d内处理测定5次,并连续5 d分别提取测定,计算日内和日间差异。分别取上述3种浓度的血浆样品,在同1 d内提取,测定,将测定结果代入标准曲线方程,计算回收率。
1.2.6 静脉给药后Hyp在大鼠体内血药浓度 取健康成年大鼠6只,♀♂各半,实验前12 h禁食,自由饮水,经静脉[8-9]给予100μg·kg-1Hyp,于给药前及给药后1、5、10、20、30、40、60、90、120、180min取颈动脉血0.3 mL。12 000r·min-1离心3 min,取上清液100μL按照“1.2.3”方法处理血浆样品后,取上清液-80℃冻存,HPLC测定血药浓度。
1.3 数据处理 血浆药物浓度-时间曲线(C-t)下面积(AUC)、半衰期(t1/2)、清除率(CL)等参数采用DAS2.0药动学软件分析。
2 结果
2.1 方法专属性 大鼠空白血浆、空白血浆加对照品及给药后血浆样品色谱图见图1,Hyp保留时间为6.5 min。在此实验条件下内源性物质不干扰样品测定,方法专属性较好。
2.2 标准曲线及线性范围 取5、10、25、100、250ng·mL-1系列浓度Hyp血浆样品分别进样,测定峰面积,以峰面积(Y)为纵坐标,以对应的Hyp含量(X)为横坐标,绘制标准曲线,回归方程为:Y=25997 X-77321,r=0.9991。
2.3 精密度和回收率 5、25、250ng·mL-1Hyp血浆样品所测日内、日间变异系数及回收率见表1。

表1 大鼠血浆内Hyp日内、日间变异系数及回收率Tab 1 Accuracy and recovery rate of the HPLC method for the analysis of the hypericin in serum of rats
2.4 静脉给药后血浆药动学参数 静脉给药后C-t曲线见图2,AUC0-t为(224.16±28.78)μg·L-1·h,t1/2为(4.283±2.68)h,CL为(0.196±0.08)L·h-1·kg-1。
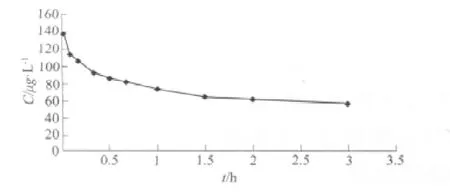
图2 静脉给予 Hyp 100μg·kg-1后的浓度-时间曲线(n=6)Fig 2 Mean plasma concentration-time profiles of hypericin(100μg·kg-1)after intravenous administration(n=6)
3 讨论
Hyp属于萘并二蒽酮类化合物,不溶于水,易溶于吡啶和其他有机胺类,预实验发现Hyp在甲醇-吡啶(9∶1)混合溶液中溶解度较好,同时利用超声波技术使其溶解更加充分。Rückert等[10]采用电化学检测法检测,试验操作过程复杂,需调pH值Hyp保留时间为12 min;B.Isacchi等[11]采用二极管阵列检测器检测,流动相进行梯度洗脱耗时长。综合考虑由于Hyp生物样品浓度较低,采用紫外检测方法其灵敏度较低,与其他检测方法相比,采用荧光检测法测定Hyp血浆浓度灵敏度高,专属性强。另外,鉴于Hyp具有光敏性,试验及保存过程中应注意避光。
静脉注射Hyp后,其体内药动学特征符合二室模型,浓度-时间曲线平缓,提示Hyp体内消除过程较缓。研究表明,Hyp口服生物利用度低[12],其口服药动学特征及生物利用度低的可能原因需要进一步探讨。
[1]叶春苗,王淑秦,赵春燕.金丝桃素的研究进展[J].中兽医医药杂志,2007,1:28-29.
[2]Butterweck V,Schmidt M.John's wort:Role of active compounds for its mechanism of action and efficacy[J].Wien Med Wochenschr,2007,157(13-14):356-61.
[3]Vacek J,Klejdus B,Kubán V.Hypericin and hyperforin:bioactive components of St John's Wort(Hypericum perforatum).Their isolation,analysis and study of physiological effect[J].Ceska Slov Farm,2007,56(2):62-66.
[4]Sosa S,Pace R,Bornancin A,et al.Topical anti-inflammatory activity of extracts and compounds from Hypericum perforatum L[J].Pharm Pharmacol,2007,59(5):703-709.
[5]Zhao J,Zhang ZP,Chen HS.Studies on synthesis and Anti-HIV RT activity of hypericin and ethylhypericin[J].Acta Pharmaceutica Sinica,1998,33(1):67-71.
[6]Kubin A,Wierrani F,Burner U,et al.Hypericin-the facts about a controversial agent[J].Curr Pharm Des,2005,11(2):233-53.
[7]Bauer S,Stormer E,Graubaum HJ,et al.Determination of hyperforin,hypericin,and pseudohypericin in human plasma using high-performance liquid chromatography analysis with fuorescence and ultraviolet detection[J].Journal of Chromatography B,2001,765:29-35.
[8]方海明,梅俏,刁磊,等.奥美拉唑肠道首过效应及机制研究[J].中国医院药学杂志,2010,7:543-547.
[9]Fang HM,Xu JM,Mei Q,et al.Involvement of cytochrome P4503A4 and P-glycoprotein in first-pass intestinal extraction of omeprazole in rabbits[J].Acta Pharmacologica Sinica,2009,30:1566-1572.
[10]Rückert U,Eggenreich K,Likussar W,et al.A High-performance Liquid Chromatography with Electrochemical Detection for the Determination of Total Hypericin in Extracts of St.John’s Wort[J].Phytochem Anal Anal,2006,17(3):162-167.
[11]Isacchi B,Galeotti N,Bergonzi MC,et al.Pharmacological in vivo Test to Evaluate the Bioavailability of some St John's Wort Innovative Oral Preparations[J].Phytother Res,2009,23(2):197-205.
[12]Schulz HU,Schürer M,Bässler D,et al.Investigation of pharmacokinetic data of hypericin,pseudohypericin,hyperforin and the flavonoids quercetin and isorhamnetin revealed from single and multiple oral dose studies with a hypericum extract containing tablet in healthy male volunteers[J].Arzneimittelforschung,2005,55(10):561-568.
