灵芝胶囊对小鼠免疫功能和外周血细胞的影响
2013-05-25蒋定文张洁何颖刘玉明陈伟刘琼王庆蓉沈先荣海军医学研究所上海00433苏州大学江苏苏州53
蒋定文,张洁,何颖,刘玉明,陈伟,刘琼,王庆蓉,沈先荣 (.海军医学研究所,上海 00433,.苏州大学,江苏 苏州 53)
灵芝是指多孔菌科真菌赤芝Ganoderma lucidum (Leyss.ex Fr.)Karst.或紫芝 Ganoderma sinense Zhao,Xu et Zhang的干燥子实体[1]。灵芝自古以来就有仙草、瑞草、还阳草之称,在我国有悠久的药用历史,是滋补强壮、扶正固本的珍品。东汉时期的《神农本草经》中把灵芝列为上品,明代李时珍的《本草纲目》称灵芝味苦、性平、无毒,主治胸中结、益心气、补中、增智慧、不忘、好颜色,久食轻松不老,延年神仙。现代研究表明,灵芝含有多糖、三萜类、核苷、甾醇、生物碱、氨基酸、微量元素等多种化学成分,具有抗肿瘤、调节免疫、保肝、抗衰老、降血糖和镇静等生物活性,其中多数药理活性与灵芝多糖有关[2-7]。现已知灵芝属约有100多种,但列入药典的只有赤芝和紫芝[1],并且只有赤芝和紫芝可作为药食两用资源用于保健食品研制与申报。灵芝水提取物,尤其是水溶性多糖具有明显的免疫调节功能[4-5,8-10],其抗肿瘤活性也主要与灵芝多糖类水提取物的免疫增强作用有关[11]。本研究采用赤芝和紫芝为原料制成灵芝胶囊,观察其对小鼠部分免疫功能及外周血细胞数量的影响,现报道如下。
1 材料与方法
1.1 材料 MEK-5216型血细胞计数仪(日本Nihon Kohden公司);酶标仪(美国 Thermo Electron公司)。灵芝胶囊由本实验室按配方工艺提取制成,方法为粉碎过筛后的赤芝和紫芝子实体按配方比例混合,水煮提取2次,提取物减压浓缩、干燥、粉碎后,加入10%维晶纤维素混匀,装入2号胶囊而成。赤芝子实体和紫芝子实体原料由北京军科联创医药技术研究院提供,购自海南省五指山市,批号分别为20090628和20090702。Balb/c雄性小鼠34只,体质量(20±1)g,购自上海西普尔-必凯实验动物有限公司,实验动物许可证号:SCXK(沪)2008-0016,合格证编号:2008001614561。Yac-1靶细胞,中科院细胞所提供。IL-2,IFN-γ检测试剂盒德国IBL公司产品分装;ConA、MTT为Sigma公司产品;RPMI-1640培养基为Scientific产品;吩嗪二甲酯硫酸盐、乳酸锂、硝基氯化四氮唑、氧化型辅酶I、异丙醇、盐酸、无水乙醇、浓硫酸、蒽酮和葡萄糖等均为国药集团化学试剂有限公司分析纯试剂。
1.2 动物分组及处理 按体质量将实验小鼠随机分为对照组9只 (给予纯化水)和灵芝胶囊低剂量组(50mg·kg-1·d-1)8只、中剂量组(100mg·kg-1·d-1)8只、高剂量(200mg·kg-1·d-1)9只3个剂量组。每天灌胃给药,给药体积为0.20mL/20g,给药浓度分别为5,10,20mg·mL-1,期间动物自由摄食和饮水。连续给药35 d后,所有动物称重,摘眼球取血,进行血细胞计数,分离血清,-80℃保存,血清用于IL-2和IFN-γ水平测定。脱颈处死小鼠,无菌分离脾脏和胸取,称重后,将脾脏先于75%乙醇浸泡1~2 s,马上置于盛有适量无菌RPMI-1640液浸泡,再转移至盛有无血清RPMI-1640培养基平皿中,于200目尼龙网上轻轻将脾磨碎,制成单个细胞悬液。PBS洗涤2次,加入3 mL含10%新生牛血清的RPMI-1640培养基,重悬细胞,显微镜下计数。
1.3 ConA诱导的小鼠脾淋巴细胞转化试验[12]将“1.2”项制备的脾细胞悬液调整细胞密度为3×106个/mL。将每份脾细胞悬液分两孔加入24孔培养板中,每孔1 mL,其中一孔加100μg·mL-1ConA 液75μL(相当于7.5μg·mL-1),另一孔作为对照,将培养板置5%二氧化碳,37℃孵箱中培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI-1640培养液,同时加入 MTT(5 mg·mL-1)50μL/孔,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到96孔板酶标板中,每孔200μL,重复3个平行样,用酶联免疫检测仪,以570nm波长测定光密度值。用加ConA孔的光密度值减去不加ConA孔的光密度值代表淋巴细胞的增殖能力。
1.4 乳酸脱氢酶(LDH)测定法测定NK细胞活性[12]实验前24 h将靶细胞进行传代培养,应用前以 Hank's液洗涤3次,用RPMI-1640完全培养液调整细胞密度为4×105个/mL。用RPMI-1640完全培养液调整脾细胞密度为2×107个/mL。取靶细胞和效应细胞各100μL(效靶比50∶1),加入U型96孔培养板中;靶细胞自然释放孔加靶细胞和培养液各100μL,靶细胞最大释放孔加靶细胞和1%NP40各100μL;上述各项均设3个复孔,于37℃、5%二氧化碳培养箱中培养4 h,然后将96孔培养板以1 500r·min-1离心5 min,每孔吸取上清100μL置平底96孔培养板中,同时加入LDH基质液100μL,反应3 min,每孔加入1 mol·L-1的盐酸30μL,在酶标仪492 nm处测定光密度值(OD)。
按下式计算NK细胞活性,受试样品组的NK细胞活性显著高于对照组的NK细胞活性,即可判定该项实验结果阳性。
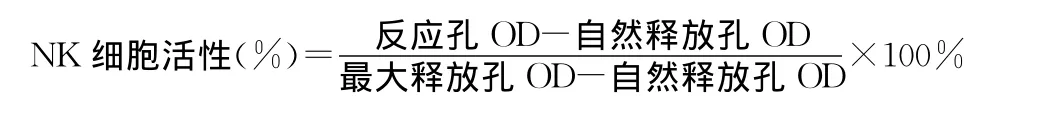
1.5 血清IL-2和IFN-γ水平测定 采用双抗体夹心法试剂盒测定小鼠血清中IL-2和IFN-γ水平。血清解冻后,严格按试剂盒说明书进行操作。
2 结果
2.1 灵芝胶囊对免疫器官脏器指数影响 实验期间动物无死亡,体质量均健康增长,组间体质量差异无显著性。给药后35 d,各组动物脾脏指数和胸腺指数未出现明显差异。见表1。
表1 灵芝胶囊对小鼠胸腺、脾脏指数的影响()Tab 1 Effects of Ganodermacapsule on thymus and spleen index in mice()
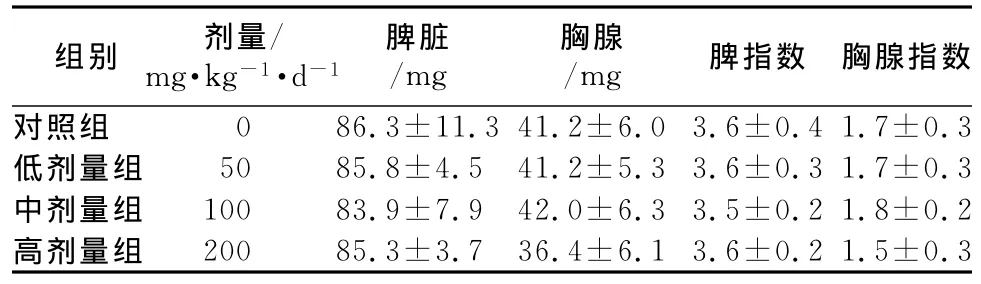
表1 灵芝胶囊对小鼠胸腺、脾脏指数的影响()Tab 1 Effects of Ganodermacapsule on thymus and spleen index in mice()
注:与对照组相比,P>0.05
脾指数 胸腺指数对照组 0 86.3±11.3 41.2±6.03.6±0.4 1.7±0.组别 剂量/mg·kg-1·d-1脾脏/mg胸腺/mg 3低剂量组 50 85.8±4.5 41.2±5.3 3.6±0.3 1.7±0.3中剂量组 100 83.9±7.9 42.0±6.3 3.5±0.2 1.8±0.2高剂量组 200 85.3±3.7 36.4±6.1 3.6±0.2 1.5±0.3
2.2 灵芝胶囊对ConA诱导的小鼠脾淋巴细胞转化能力的影响 灵芝胶囊给药组ConA诱导的脾细胞的淋巴细胞转化率均明显高于对照组,3个剂量组与对照组比较均达到非常显著的统计学差异(P<0.01),提示3个剂量的灵芝胶囊组均能提高免疫抑制小鼠淋巴细胞的增殖能力。见表2。
表2 灵芝胶囊对ConA诱导的小鼠脾淋巴细胞转化能力影响()Tab 2 Effects of Ganodermacapsule on ConA-induced lymphocyte proliferation in mice()
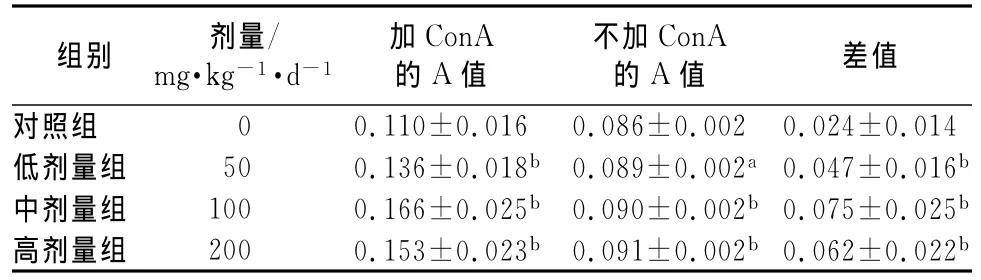
表2 灵芝胶囊对ConA诱导的小鼠脾淋巴细胞转化能力影响()Tab 2 Effects of Ganodermacapsule on ConA-induced lymphocyte proliferation in mice()
注:与对照组相比,aP<0.05,bP<0.01
差值对照组 00.110±0.016 0.086±0.002 0.024±0.组别 剂量/mg·kg-1·d-1加ConA的A值不加ConA的A值014低剂量组 50 0.136±0.018b0.089±0.002a0.047±0.016b中剂量组 100 0.166±0.025b0.090±0.002b0.075±0.025b高剂量组 200 0.153±0.023b0.091±0.002b0.062±0.022b
2.3 灵芝胶囊对小鼠NK细胞活性的影响 由图1可见,灵芝胶囊给药组低(P<0.01)、中(P<0.05)、高(P<0.05)3个剂量组对 NK 细胞杀伤活性明显高于对照组。提示灵芝胶囊对免疫抑制小鼠的NK细胞活性有明显的促进作用。
2.4 灵芝胶囊对小鼠血清IL-2及IFN-γ含量的影响 由表3可知,灵芝胶囊给药组低、中、高3个剂量组血清IL-2含量明显高于对照组(P<0.01),且随着给药剂量的增高呈增高趋势。低剂量组IFN-γ含量与对照组相片无明显差异,但中、高剂量组小鼠血清IFN-γ含量明显高于对照组(P<0.01),也随着给药剂量的增高呈增高趋势,提示灵芝胶囊可提高小鼠血清IL-2和IFN-γ水平,且呈剂量依赖趋势。

图1 灵芝胶囊对小鼠NK细胞活性的影响()注:与对照组相比:aP<0.05,bP<0.01Fig 1 Effects of Ganodermacapsule on NK cell activity in mice()
表3 灵芝胶囊对小鼠IL-2、IFN-γ含量细胞活性的影响()Tab 3 Effects of Ganoderma capsule on concentrations of IL-2 and IFN-γin serum of mice()

表3 灵芝胶囊对小鼠IL-2、IFN-γ含量细胞活性的影响()Tab 3 Effects of Ganoderma capsule on concentrations of IL-2 and IFN-γin serum of mice()
注:与对照组相比,aP<0.01
组别 剂量/mg·kg-1·d-1 IL-2含量/ng·L-1 IFN-γ含量/ng·L-1 0 1875±236 1110±102低剂量组 50 2377±145a1105±81中剂量组 100 2563±156a1240±111a高剂量组 200 2977±439a1402±131对照组a
2.5 灵芝胶囊对小鼠外周血血细胞的影响 中剂量组红细胞数明显高于对照组(P<0.05),中剂量组(P<0.01)和高剂量组(P<0.05)血小板数明显高于对照组;中剂量组和高剂量组白细胞数均高于对照组(P<0.01)。见表4。提示灵芝胶囊可促进小鼠外周血RBC,PLT,WBC含量。
表4 灵芝胶囊对小鼠外周血RBC、WBC和PLT数量的影响()Tab 4 Effects of Ganoderma capsule on number of peripheral blood RBC,WBC and PLT in mice()
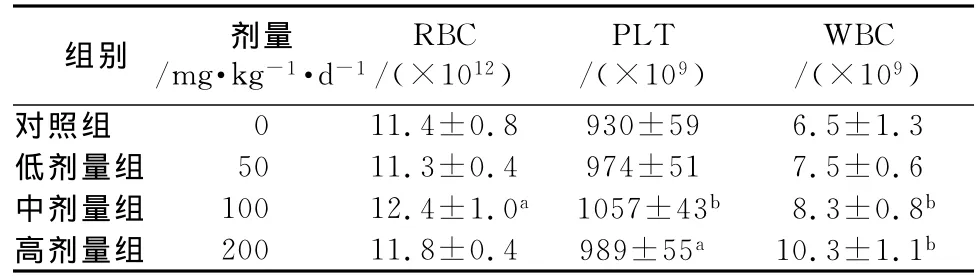
表4 灵芝胶囊对小鼠外周血RBC、WBC和PLT数量的影响()Tab 4 Effects of Ganoderma capsule on number of peripheral blood RBC,WBC and PLT in mice()
注:与对照组相比,aP<0.05,bP<0.01
组别 剂量/mg·kg-1·d-1 RBC/(×1012)PLT/(×109)WBC/(×109)对照组 0 11.4±0.8 930±59 6.5±1.3低剂量组 50 11.3±0.4 974±51 7.5±0.6中剂量组 100 12.4±1.0a1057±43b8.3±0.8b高剂量组 200 11.8±0.4 989±55a10.3±1.1b
3 讨论
已有较多文献报道了灵芝对免疫功能调节作用,不同的灵芝免疫调节作用不尽相同,总的研究表明,灵芝对非特异性免疫和特异性免疫均有增强作用,具有促进吞噬细胞吞噬功能、促进T淋巴细胞增殖、促进细胞因子(如白细胞介素、IFN-γ、肿瘤坏死因子等)的产生、促进B淋巴细胞增殖和抗体的产生、提高NK细胞活性、诱导癌细胞凋亡等功能[2-5,8,13-15]。但也有报道显示灵芝能抑制迟发型超敏反应[8-9],甚至抑制荷瘤小鼠抗体的生成[10]。大部分文献均报道灵芝水提取物对正常小鼠的免疫功能有促进作用,但也有人报道灵芝水煎剂对正常小鼠的免疫功能无明显影响,但能显著提高免疫抑制小鼠的免疫功能[16]。灵芝提高机体免疫功能的重要物质为灵芝多糖,因此,本研究以赤芝和紫芝为原料,采用水提取工艺制备获得灵芝胶囊。从实验结果看,灵芝胶囊对正常小鼠的体质量、胸腺和脾脏指数无明显影响,但可促进ConA诱导的小鼠脾淋巴细胞转化,提示灵芝胶囊可促进机体的细胞免疫;灵芝胶囊可提高小鼠脾脏NK细胞杀伤活性,提高小鼠血清中IL-2和IFN-γ水平,说明以赤芝和紫芝为原料制成的灵芝胶囊可以促进小鼠的非特异性免疫功能。
灵芝对小鼠外周血细胞的影响少见报道,本研究发现,以赤芝和紫芝为原料制成的灵芝胶囊可明显提高正常小鼠外周血红细胞、白细胞和血小板数量,提示灵芝胶囊可能具有补血的功能,灵芝胶囊能否提高免疫抑制动物的外周血血细胞数量,尚需进一步实验观察。灵芝胶囊具有提高机体免疫功能和外周血血细胞数量的结论,使灵芝类产品能更广泛地应用于促进肿瘤化疗等免疫功能低下人群的恢复和生活质量的提高。
[1]中国药典.一部[S].2010:174-175.
[2]张晓云,杨春清.灵芝的化学成分和药理作用[J].国外医药·植物药分册,2006,21(4):152-155.
[3]韩玉复,宋桂芬,苏鑫,等.灵芝的研究进展[J].中药材,1995,18(5):266-268.
[4]刘建萍,刘雪平.灵芝免疫活性成分及其制剂的研究概况[J].天津药学,2004,16(6):43-45.
[5]刘经亮.灵芝多糖的药理研究进展[J].广东药学,2000,10(2):46-48.
[6]Guo-Liang Zhang,Ye-Hong Wang,Wei Ni,et al.Hepatoprotective role of ganoderma lucidumpolysaccharide against BCG-induced immune liver injury in mice[J].World J Gastroenterol,2002,8(4):728-733.
[7]Fenglin Li,Yiming Zhang,Zhijian Zhong.Antihyperglycemic effect of Ganoderma Lucidum polysaccharides on streptozotocin-induced diabetic mice[J].Int J Mol Sci,2011,(12):6135-6145.
[8]郭雯,王英军,姜秀莲,等.赤灵芝提取物对小鼠免疫功能系统的影响[J].中国老年学杂志,2009,29(20):2636-2638.
[9]谭允育,崔德玉.灵芝水煎剂免疫药理作用的实验研究[J].北京中医药大学学报,1996,19(5):61-62.
[10]何来英,戴寅,蔡有余,等.灵芝水提取液对小鼠免疫功能的影响及其毒性[J].中国食品卫生杂志,1997,9(4):21-24.
[11]Lin Zhi-bin,Zhang Hui-na.Anti-tumor and immunoregulatory activities of Ganoderma lucidum and its possible mechanisms[J].Acta Pharmacol Sin,2004,25(11):1387-1395.
[12]中华人民共和国卫生部.保健食品检验与评价技术规范[S].北京:2003:22-34.
[13]李文娟,聂少平,余强,等.黑灵芝多糖对免疫抑制小鼠的免疫调节作用[J].食品科学,2009,30(19):297-299.
[14]宁安红,曹婧,黄敏,等.灵芝多糖对荷瘤小鼠肿瘤免疫系统的影响[J].中国微生态学杂志,2004,16(1):13-14.
[15]陈亚非,陈金显.灵芝多糖免疫调节及抗肿瘤作用综述[J].中国食品添加剂,2002,(4):36-41.
[16]王坤,吴光,戴盛明.广西灵芝对小鼠免疫功能影响的实验研究[J].广西医科大学学报,2003,20(6):871-874.
