过氧化氢干雾对生物安全柜微环境表面消毒效果的研究
2013-01-14孙志平韩文东丁悦娜瞿涤
孙志平,韩文东,丁悦娜,瞿涤,2
1. 上海复旦大学三级生物安全防护实验室,上海 200032; 2. 复旦大学上海医学院教育部/卫生部医学分子病毒学重点实验室,上海 200032
生物安全实验室微环境消毒是控制实验室污染的重要环节,而生物安全柜是生物安全实验室中的关键设备,对感染性病原微生物的操作均应尽量在生物安全柜内进行。因此,生物安全柜存在被污染的风险,特别是在操作抵抗力强的病原微生物(如结核分枝杆菌等)时风险更大。当实验结束后或污染事故(如意外泼洒)发生时,必须进行生物安全柜内表面和空间的微环境消毒。生物安全柜的常规消毒方式主要采用消毒剂擦拭,但该方法无法彻底清除潜在的污染,因此需采用更加有效的空间消毒方式,如消毒剂蒸汽或气溶胶熏蒸[1]。过氧化氢干雾消毒方法广泛应用于病原微生物实验室微环境消毒,但其对不同病原微生物的消毒效果有待研究。
目前,实验室微环境的消毒方式可分为化学消毒法和物理消毒法,其中化学消毒法主要采用甲醛、环氧乙烷、二氧化氯、过氧乙酸等熏蒸或雾化,对病原微生物具有良好的杀菌作用。然而,这些消毒剂在使用中存在一些缺陷:或具有毒性/致癌性,或对环境不友好,或对仪器具有一定的腐蚀性,或易燃、易爆等[2]。过氧化氢是一种强氧化剂,适用于伤口消毒及环境、食品消毒[3]。过氧化氢因毒性小且对环境友好,其在空间消毒中的应用越来越受关注[4-7]。通过干性或湿性雾化后,过氧化氢气溶胶具有更强的氧化性,能均匀弥散至空间的各个角落,其中干性雾化的弥散效果较好,可用于病原微生物实验室或洁净室空间的消毒[6,8-11]。因不同病原微生物对消毒剂及消毒方式的抵抗力存在差异,本文研究了过氧化氢干雾法对生物安全柜的空间及微环境表面常见病原微生物的消毒效果,提出适用于生物安全柜微环境表面干雾消毒的程序和措施。
1 材料与方法
1.1 材料
1.1.1菌种嗜热脂肪芽胞杆菌菌片(SS1.K31)、枯草芽胞杆菌黑色变种(ATCC 9372)购自北京鑫四环消毒技术开发有限公司,耻垢分枝杆菌(MC2155)由第四军医大学徐志凯教授惠赠,金黄色葡萄球菌(ATCC 49230)、表皮葡萄球菌(ATCC 1457)和大肠埃希菌(DH5a)由本实验室课题组保存。
1.1.2试剂胰蛋白胨、酵母提取物、胰蛋白胨大豆肉汤(tryptone soya broth, TSB)购自英国Oxiod公司,溴甲酚紫(染料含量为90%)、无水D-葡萄糖(纯度≥99.5%)购自Sigma公司,Difco Middlebrook 7H9肉汤培养基、Difco Middlebrook 7H10 琼脂培养基、BBL Middlebrook ADC Enrichment培养基和BBL Middlebrook OADC Enrichment培养基购自美国BD公司,过氧化氢溶液(浓度6%)为法国Devea公司产品(O2SAFE)。
1.1.3过氧化氢干雾发生器过氧化氢干雾发生器(法国Devea公司,型号:PHILEAS 20D)通过高速离心方式每分钟发散6 ml过氧化氢,产生粒径<10 μ m的过氧化氢气溶胶(干雾)。
1.2 方法
1.2.1细菌菌片的制备金黄色葡萄球菌(ATCC 49230)、表皮葡萄球菌(ATCC 1457)培养于TSB培养基,大肠埃希菌(DH5a)培养于LB培养基,耻垢分枝杆菌(MC2155)培养于Middlebrook 7H9培养基, 37 ℃振荡培养。金黄色葡萄球菌、表皮葡萄球菌和大肠埃希菌培养12 h,耻垢分枝杆菌培养48 h,分光光度计测定600 nm处光密度(optical density,OD),菌液稀释至OD600=1作为测试原液。金黄色葡萄球菌、表皮葡萄球菌和大肠埃希菌OD600=1时浓度约为1×109CFU/ml,耻垢分枝杆菌浓度约为1×108CFU/ml。分别将细菌测试原液稀释10、100、1 000倍,吸取100 μ l稀释菌液并涂布于0.5 cm×2.0 cm滤纸(Bio-Rad)。金黄色葡萄球菌、表皮葡萄球菌和大肠埃希菌菌片的含菌量分别为1×108、1×107、1×106、1×105CFU;耻垢分枝杆菌菌片的含菌量分别为1×107、1×106、1×105、1×104CFU。嗜热脂肪芽胞杆菌菌片(SS1.K31)、枯草芽胞杆菌黑色变种(ATCC 9372)菌片的含菌量约为1×106CFU。
1.2.2过氧化氢干雾发生器消毒方案将4个稀释度菌片放置于12孔板中,每个稀释度3片,共2块(A、B)板,分别放置于生物安全柜内操作台面左右两端(图1)。各浓度的菌片均设置阴性和阳性对照。以不进行处理的菌片为阴性对照,压力蒸汽灭菌(121 ℃,20 min)处理的菌片为阳性对照。过氧化氢干雾发生器消毒效果检测分为3个阶段。①消毒前准备:在生物安全柜内相应位置放置过氧化氢干雾发生器和细菌菌片(图1),并用薄膜纸封闭生物安全柜的前窗口。②消毒过程:发生器产生过氧化氢干雾的程序可分为连续发生和间断重复发生2种形式,在干雾发生过程中每分钟可将6 ml过氧化氢溶液转化为干雾。一般情况下,短时、多次发生有利于干雾的分散。干雾发生结束后静置120 min。为摸索过氧化氢干雾杀灭细菌的效果,针对生物安全柜(0.8 m3)设计了4个不同的消毒程序(表1)。③消毒结束后检测:开启生物安全柜的通风,待过氧化氢干雾排净后,重新盖上12孔板,在生物安全柜内取出菌片进行培养。
表1过氧化氢干雾发生器消毒程序的设置
Tab.1 The procedures of H2O2dry-mist sterilization

ProcedureGeneration (min)Interval (min)CycleSterilization (min)Total volume of H2O2 (ml)Volume of H2O2 (ppm)12101120121522105120607532101012012015041581204860
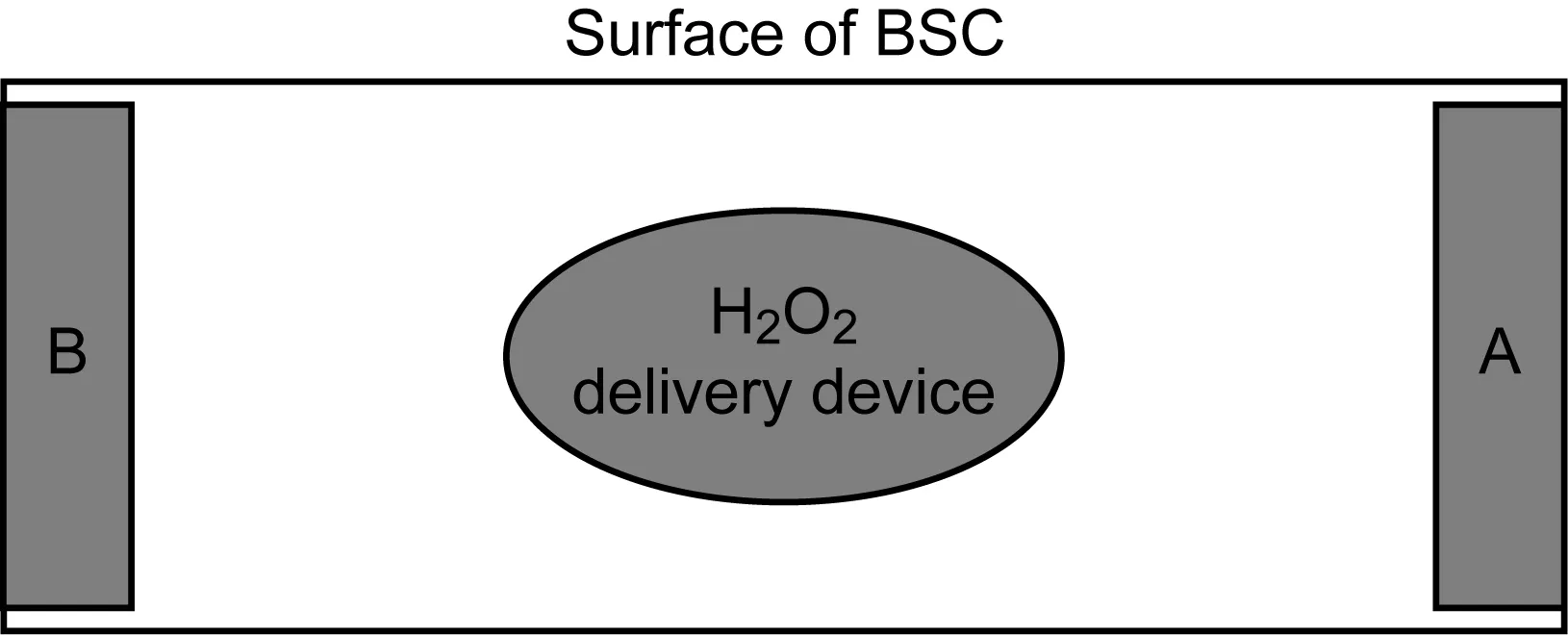
A and B location: the right/left site of the biosafety cabinet (BSC) surface for laying indicator bacteria (B.subtilis,B.stearothermophilus,E.coli,S.aureus,S.epidermidisandM.smegmatis). The middle site of BSC surface for laying H2O2delivery device generating dry-mist.
图1生物安全柜内过氧化氢干雾发生器和菌片的位置
Fig.1 The location of H2O2disinfector and indicators on the BSC surface
1.2.3过氧化氢消毒效果的微生物检测过氧化氢干雾发生器消毒程序结束后取出菌片,置于5 ml相应液体培养基中。其中嗜热脂肪芽胞杆菌菌片培养前需90 ℃孵育60 min。嗜热脂肪芽胞杆菌的培养基为溴甲酚紫葡萄糖蛋白胨培养基(含1%胰蛋白胨、0.5%葡萄糖和0.1%溴甲酚紫乙醇溶液指示剂),56 ℃振荡培养;枯草芽胞杆菌黑色变种和大肠埃希菌的培养基为LB培养基(含0.5%酵母提取物、1%胰蛋白胨和0.5%氯化钠);耻垢分枝杆菌的培养基为Middlebrook 7H9培养基(含10% OADC);金黄色葡萄球菌和表皮葡萄球菌的培养基为TSB培养基(含0.5%大豆蛋白胨、1.5%胰蛋白胨和0.5%氯化钠)。大肠埃希菌、金黄色葡萄球菌、表皮葡萄球菌、耻垢分枝杆菌和枯草芽胞杆菌在37 ℃振荡培养24 h后,培养液澄清,无可见细菌菌落,则判定为无细菌生长。嗜热脂肪芽胞杆菌在56 ℃振荡培养168 h后,培养液为紫色澄清且未变为黄色,无可见细菌菌落,则判定为无细菌生长。
2 结果
2.1 过氧化氢干雾采用不同消毒程序的杀菌效果
为了确定有效的过氧化氢干雾消毒程序,在减少过氧化氢对实验仪器损害的前提下,设定了4个不同的过氧化氢干雾消毒程序,发散循环次数为1、5、10、8次,过氧化氢发散体积分别为15、75、150、60 ppm,静置消毒时间均为120 min(表1),利用枯草芽胞杆菌黑色变种菌片和嗜热脂肪芽胞杆菌菌片作为指示菌进行研究。经不同程序消毒后,分别取出菌片,根据指示菌的相应生长特性进行培养,其中枯草芽胞杆菌37 ℃培养24 h,嗜热脂肪芽胞杆菌56 ℃培养168 h,观察细菌培养液的变化情况。枯草芽胞杆菌菌片经4个程序消毒后,培养24 h,培养液均为透明澄清,未见细菌生长,与经压力蒸汽灭菌的菌片培养结果相同;而未经消毒处理的菌片培养液(24 h)浑浊,可见细菌生长。然而,嗜热脂肪芽胞杆菌菌片经过程序1和2消毒后,培养24 h,培养液均由紫色澄清变为黄色浑浊,与未经消毒处理的菌片培养结果相似;而经程序3和4消毒后,嗜热脂肪芽胞杆菌菌片培养168 h,培养液保持紫色澄清,未见细菌生长(表2、3,图2、3)。比较消毒程序3与4发现,消毒程序4 降低了过氧化氢干雾浓度,减少了对实验仪器的损害,优于消毒程序3。
表2过氧化氢干雾采用不同消毒程序的杀菌效果
Tab.2 Effect of H2O2dry-mist on killing bacterial spores with different procedures in the biosafety cabinet
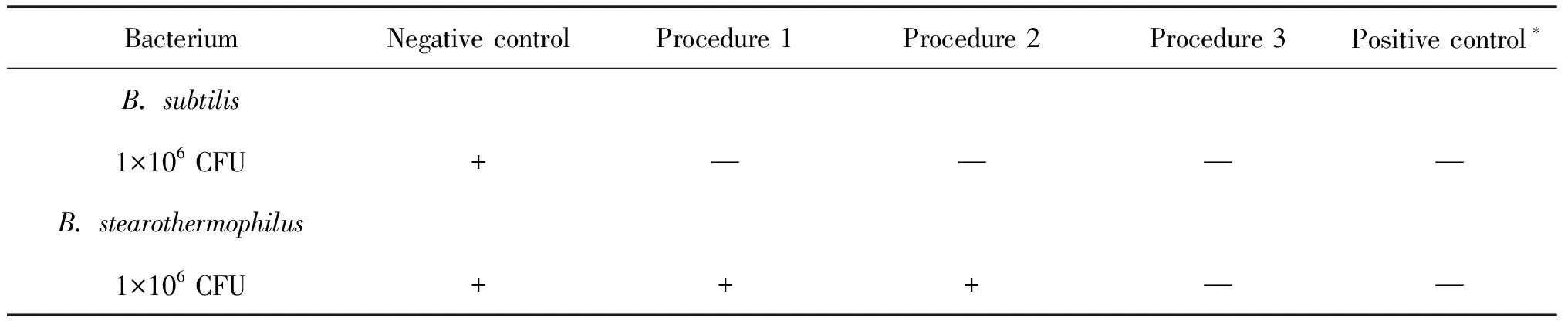
Bacterium Negative controlProcedure 1Procedure 2Procedure 3Positive control∗B. subtilis1×106 CFU+————B. stearothermophilus1×106 CFU+++——
Negative control, the filter paper containing bacterial spores (1×106CFU) without disinfection; Positive control, the filter paper containing bacterial spores sterilized by autoclave (121 ℃, 15 min). The filter papers containing bacterial spores were cultured in the medium for 24 h (B.subtilis, 37 ℃) and 1 week (B.stearothermophilus, 56 ℃). Observe turbidity of the culture. The turbid cultures (+) indicated bacteria growing on the papers. Oppositely, the limpid cultures (-) indicated papers being sterilized. The filter papers containing bacterial spores was disinfected with H2O2dry-mist for procedures 1, 2 and 3. Procedure 1: Generate H2O2dry-mist for 2 min, then sterilize for 2 h. Procedure 2: Generate H2O2dry-mist for 2 min for 5 cycles and suspend for 10 min, and then sterilize for 2 h. Procedure 3: Generate H2O2dry-mist for 2 min for 10 cycles and suspend for 10 min, and then sterilize for 2 h.
表3过氧化氢干雾采用消毒程序4对生物安全柜表面的杀菌效果
Tab.3 Effect of H2O2dry-mist on killing bacterial spores with procedure 4 in the biosafety cabinet

BacteriumNegative controlA locationB locationPositive controlB. subtilis1×106 CFU+———B. stearothermophilus1×106 CFU+———
Negative control, the filter paper containing bacterial spores (1×106CFU) without disinfection; Positive control, the filter paper containing bacterial spores sterilized by autoclave (121 ℃,15 min). A and B locations: the right/left site of the BSC surface for laying indicator bacteria (B.subtilisandB.stearothermophilus). Each bacterial strain had 3 repeats on the plates (12 wells) laying on A and B locations. The filter papers containing bacterial spores were disinfected by H2O2dry-mist with procedure 4 (generate H2O2dry-mist for 1 min for 8 cycles and suspend for 5 min, and then sterilize for 2 h). The filter papers containing bacterial spores were cultured in the medium for 24 h (B.subtilis, 37 ℃) and 1 week (B.stearothermophilus, 56 ℃). Observe turbidity of the culture. The turbid cultures (+) indicated bacteria growing on the papers. Oppositely, the limpid cultures (-) indicated papers being sterilized.
2.2 过氧化氢干雾采用消毒程序4对不同细菌的杀灭效果
采用消毒程序4(发散8次,总体积60 ml/m3空间)研究过氧化氢干雾对常见病原微生物大肠埃希菌(DH5a)、金黄色葡萄球菌(ATCC 25923)、表皮葡萄球菌(ATCC 1457)及耻垢分枝杆菌(MC2155,作为结核分枝杆菌模拟菌)等的消毒效果。首先制备上述细菌不同稀释度的菌片,其中大肠埃希菌、金黄色葡萄球菌和表皮葡萄球菌菌片含菌量为1×105、1×106、1×107和1×108CFU,耻垢分枝杆菌菌片含菌量为1×104、1×105、1×106和1×107CFU,在各稀释度均设置未消毒处理菌片和压力蒸汽灭菌处理菌片分别作为阴性和阳性对照。将各稀释度的菌片(每个稀释度3片)放置于12孔板,分别安放于生物安全柜内操作台面左右两侧(图1),采用过氧化氢干雾消毒程序4进行消毒,取出菌片培养。结果显示,经过氧化氢干雾消毒后,大肠埃希菌1×108CFU菌片仍未见细菌生长;金黄色葡萄球菌和表皮葡萄球菌的1×105和1×106CFU菌片培养液均未见细菌生长,而1×107和1×108CFU菌片培养液均变浑浊;耻垢分枝杆菌1×107CFU菌片培养液浑浊,细菌生长,其余稀释度的菌片培养液均澄清,未见细菌生长(表4、图4)。
3 讨论
生物安全实验室中病原微生物污染最集中的部位是生物安全柜内微环境,包括生物安全柜表面及空气。国家新标准《实验室生物安全通用要求》(GB 19489-2008)要求生物安全实验室在关键部位配备局部消毒装置。研究安全、有效的实验室微环境中微生物消毒方法, 将为实验室生物安全风险评估提供依据, 从而确保生物安全柜微环境中微生物污染的清除,降低实验室感染事件发生的概率,同时也减少消毒剂对实验人员的危害[12]。根据《医疗机构消毒技术规范》,实验室空间消毒方式(紫外线照射、消毒剂熏蒸和喷雾等)主要归类为化学消毒剂和物理作用方式。其中,紫外线的消毒作用较弱,消毒效果难以保证,因此实验室微环境表面消毒通常采用化学消毒剂进行消毒[13]。化学消毒剂主要包括甲醛、环氧乙烷、二氧化氯、过氧乙酸和过氧化氢等。其中,甲醛熏蒸的消毒效果已得到验证,被证实为可靠的实验室空间消毒方式,但仍存在一定的缺陷[14,15]。甲醛熏蒸时,对消毒环境有一定的要求,实验室空间温度和湿度的变化直接影响消毒效果;其次,当环境温度较低时,甲醛蒸汽容易在微环境表面凝结成白色结晶,不易清除,从而对实验室环境和仪器产生较大损伤;熏蒸结束后,残余的甲醛气体对人体具有致癌作用,对操作者和环境极不友好[16]。其他消毒剂如环氧乙烷等也存在对实验室环境不友好等诸多缺点。因此,缺点较少的过氧化氢在实验室微环境消毒中的应用越来越受关注,并不断推出新技术。
表4过氧化氢干雾采用消毒程序4对生物安全柜表面不同细菌的杀灭效果
Tab.4 Effect of H2O2dry-mist on killing bacteria with procedure 4 in the biosafety cabinet

Bacterium (CFU)Negative controlA locationB locationPositive controlE. coli 1×108+——— 1×107+——— 1×106+——— 1×105+———S. aureus 1×108+++— 1×107+++— 1×106+——— 1×105+———S. epidermidis 1×108+++— 1×107+++— 1×106+——— 1×105+———M. smegmatis 1×107+++— 1×106+——— 1×105+——— 1×104+———
Negative control, the filter paper containing bacteria (100 μ l) without disinfection; Positive control, the filter paper containing bacteria (100 μ l) sterilized by autoclave (121 ℃, 15 min). A and B locations: the right/left site of the BSC surface for laying indicator bacteria (E.coli,S.aureus,S.epidermidisandM.smegmatis). Each bacterial strain had 3 repeats at four CFU levels (10 times dilution) on the plates (12 wells) laying on the A and B locations. The filter papers containing bacterial spores disinfected by H2O2dry-mist with procedure 4 (generate H2O2dry-mist for 1 min for 8 cycles and suspend for 5 min, and then sterilize for 2 h). The filter papers containing bacterial spores were cultured in the medium for 24 h. Observe turbidity of the culture. The turbid cultures (+) indicated bacteria growing on the papers. Oppositely, the limpid cultures (-) indicated papers being sterilized.
过氧化氢消毒可分为普通擦拭、雾化、蒸汽及低温等离子体方式[7,11,17-19]。后两者的应用条件比雾化过氧化氢更加严苛,在实验室应用中成本较高,难以推广。因此,雾化过氧化氢更常用于实验室消毒。雾化过氧化氢是在外加能量作用下,液体在气体环境中变成小雾滴的物理过程,液滴粒径1~1 000 μ m。产生雾化的方式有很多,如通过普通喷壶、气溶胶发生器、雾化超声器等。雾化粒径越小,消毒效果越好。当粒径<10 μ m时,液滴在空间中不会沉降,不会聚合产生大液滴,且能进行无规则运动,与表面接触后会反弹而不破裂。干雾能形成很好的空间扩散和表面接触效果,更有利于发挥消毒作用[11,20-22]。
在生物安全柜内进行实验操作过程中,病原微生物易产生气溶胶,污染生物安全柜内微环境,擦拭消毒时有些部位不易接触到,当操作抵抗力强的病原微生物(如结核分枝杆菌等)时潜在的生物安全风险更大。当常规实验结束后或污染事故(如意外泼洒)发生时,必须进行生物安全柜内表面和空间的消毒,及时清除污染,避免微生物污染扩散,防止实验室内感染事件发生[1]。本文研究了过氧化氢干雾发生器对生物安全柜微环境表面病原微生物的消毒效果。这些微生物包括大肠埃希菌、金黄色葡萄球菌和表皮葡萄球菌, 常用的灭菌微生物指示菌枯草芽胞杆菌和嗜热脂肪芽胞杆菌, 以及作为结核分枝杆菌模拟菌的耻垢分枝杆菌。生物安全柜内微环境过氧化氢干雾消毒结果显示,枯草芽胞杆菌对该消毒方法的敏感度高于嗜热脂肪芽胞杆菌:当过氧化氢干雾浓度达到15 ppm时,可杀灭1×106CFU枯草芽胞杆菌,而杀灭1×106CFU嗜热脂肪芽胞杆菌则须达60 ppm。不同细菌的芽胞对氧化氢干雾敏感度的差异有待进一步研究。通过研究发现消毒程序对消毒效果具有重要影响,尤其是发散循环次数直接影响过氧化氢干雾的杀菌效果。本文建立了生物安全柜内微环境过氧化氢干雾的消毒程序:发散1 min,间隔5 min,循环8次,达60 ppm后,消毒120 min。过氧化氢干雾可完全杀灭1×106CFU枯草芽胞杆菌、嗜热脂肪芽胞杆菌及1×108CFU大肠埃希菌。虽然过氧化氢干雾可杀灭1×106CFU金黄色葡萄球菌、表皮葡萄球菌和耻垢分枝杆菌,但对这3种病原微生物1×107CFU则无法完全杀灭。因此,建议在进行过氧化氢干雾消毒前,必须用消毒剂对生物安全柜表面进行擦拭或对溢洒部位进行局部消毒,以降低局部污染微生物的浓度,以期彻底杀灭生物安全柜微环境中污染的病原微生物。

图2过氧化氢干雾采用消毒程序2对生物安全柜表面的杀菌效果
Fig.2 Effect of H2O2dry-mist on killing bacterial spores with procedure 2 in the biosafety cabinet

图3过氧化氢干雾采用消毒程序4对生物安全柜表面的杀菌效果
Fig.3 Effect of H2O2dry-mist on killing bacterial spores with procedure 4 in the biosafety cabinet

图4过氧化氢干雾采用消毒程序4对生物安全柜表面不同细菌的杀灭效果
Fig.4 Effect of H2O2dry-mist on killing bacteria with procedure 4 in the biosafety cabinet
通过过氧化氢干雾对生物安全柜微环境表面和空间的消毒效果,针对常规实验及高浓度病原微生物污染情况,本文提出了相应的过氧化氢干雾消毒方案,以保障实验室生物安全。此外,生物安全实验室空间的消毒也是风险控制的关键环节,以后将进一步研究过氧化氢干雾对实验室空间中常见微生物的消毒效果,摸索针对实验室空间的有效过氧化氢干雾消毒程序,完善生物安全实验室污染控制方案。
[1] 中华人民共和国国务院. 病原微生物实验室生物安全管理条例[EB/OL]. 2004. http://www.gov.cn/gongbao/content/2005/content_63265.htm.
[2] 张文福. 过氧化氢消毒研究进展[J]. 中国消毒学杂志, 1992,9(3): 179-184.
[3] 徐燕, 王玲, 谈智, 陈越英, 吴小成, 戎毅. 复方过氧化氢消毒剂杀灭微生物效果的试验研究[J]. 中国消毒学杂志, 2005, 22(4): 361-364.
[4] 谈智, 孙俊, 徐燕, 王玲, 陈越英, 王晓蕾. 四种化学消毒剂空气消毒效果的观察[J]. 中国消毒学杂志, 2005, 22(3): 247-249.
[5] 蒋学兵, 马骢, 陆晓白, 王珍光, 李艳君, 古东东. 6种常用消毒方法对室内空气消毒效果的比较[J]. 中华医院感染学杂志, 2004, 14(11): 1258-1259.
[6] 关瑞锋, 王纯波, 郝秋华, 许秀萍. 3%过氧化氢超声雾化在婴儿暖箱表面消毒的应用[J]. 牡丹江医学院学报, 2011, 32(5): 55-56.
[7] Rutala WA, Weber DJ. Disinfection of endoscopes: review of new chemical sterilants used for high-level disinfection [J]. Infect Control Hosp Epidemiol, 1999, 20(1): 69-76.
[8] 刘艳朝, 梁婷, 王宁. 超声波雾化过氧化氢雾化装置设计及效果评估[J]. 医疗卫生装备, 2012, 33(3):39-40, 48.
[9] 赵四清, 李纲, 孙蓓. 汽化过氧化氢低温灭菌器在生物安全实验室消毒效果观察[J]. 中国消毒学杂志, 2009, 26(5): 510-512.
[10] 程水生, 王泰健, 夏业才, 严春炎. 美国、加拿大生物安全三级动物实验室考察报告[J]. 中国兽药杂志, 2007, 41(10): 47-49.
[11] Falagas ME, Thomaidis PC, Kotsantis IK, Sgouros K, Samonis G, Karageorgopoulos DE. Airborne hydrogen peroxide for disinfection of the hospital environment and infection control: a systematic review [J]. J Hosp Infect, 2011, 78(3): 171-177.
[12] 中华人民共和国国家质量监督检验防疫总局. 实验室生物安全通用要求[S/OL]. 2008. http://www.doc88.com/p-994529446961.html.
[13] 中华人民共和国国家卫生和计划生育委员会. 医疗机构消毒技术规范[S/OL]. 2012. http://www.moh.gov.cn/zwgkzt/s9495/201204/54510.shtml.
[14] Dolan A, Bartlett M, McEntee B, Creamer E, Humphreys H. Evaluation of different methods to recover meticillin-resistant Staphylococcus aureus from hospital environmental surfaces [J]. J Hosp Infect, 2011, 79(3): 227-230.
[15] French GL, Otter JA, Shannon KP, Adams NM, Watling D, Parks MJ. Tackling contamination of the hospital environment by methicillin-resistant Staphylococcus aureus (MRSA): a comparison between conventional terminal cleaning and hydrogen peroxide vapour decontamination [J]. J Hosp Infect, 2004, 57(1): 31-37.
[16] 夏德生, 陈慧娇. 甲醛消毒效果验证及残留验证方法研究[J]. 山西医药杂志, 2011, 40(7): 720-721.
[17] Johnston MD, Lawson S, Otter JA. Evaluation of hydrogen peroxide vapour as a method for the decontamination of surfaces contaminated with Clostridium botulinum spores [J]. J Microbiol Methods, 2005, 60(3): 403-411.
[18] Otter JA, Cummins M, Ahmad F, van Tonder C, Drabu YJ. Assessing the biological efficacy and rate of recontamination following hydrogen peroxide vapour decontamination [J]. J Hosp Infect, 2007, 67(2): 182-188.
[19] Bentley K, Dove BK, Parks SR, Walker JT, Bennett AM. Hydrogen peroxide vapour decontamination of surfaces artificially contaminated with norovirus surrogate feline calicivirus [J]. J Hosp Infect, 2012, 80(2): 116-121.
[20] Bartels MD, Kristoffersen K, Slotsbjerg T, Rohde SM, Lundgren B, Westh H. Environmental meticillin-resistant Staphylococcus aureus (MRSA) disinfection using dry-mist-generated hydrogen peroxide [J]. J Hosp Infect, 2008, 70(1): 35-41.
[21] Shapey S, Machin K, Levi K, Boswell TC. Activity of a dry mist hydrogen peroxide system against environmental Clostridium difficile contamination in elderly care wards [J]. J Hosp Infect, 2008, 70(2): 136-141.
[22] Piskin N, Celebi G, Kulah C, Mengeloglu Z, Yumusak M. Activity of a dry mist-generated hydrogen peroxide disinfection system against methicillin-resistant Staphylococcus aureus and Acinetobacter baumannii [J]. Am J Infect Control, 2011, 39(9): 757-762.
