抗人类免疫缺陷病毒广谱中和抗体与疫苗设计
2013-01-14王若珂郭建影张林琦
王若珂,郭建影,张林琦
清华大学医学院艾滋病综合研究中心,北京 100084
自从1983年人类免疫缺陷病毒1型(human immunodeficiency virus type 1,HIV-1)被分离以来[1],人们不断努力研发抵御HIV感染的疫苗。HIV-1具有高度变异、表面受糖基化保护、病毒颗粒表面的膜蛋白稀少的特点[2]。以往成功的疫苗以减毒、灭活的病毒作为疫苗,或用基因工程的方式将病毒的一部分作为疫苗。HIV-1的灭活和减毒疫苗因为安全性问题而无法实施。将HIV-1膜蛋白作为免疫原确实可诱生HIV-1特异性抗体,但这些抗体只能中和自体病毒,无交叉保护作用。这些因素都使得传统的疫苗策略不再适用。最近的RV144疫苗获得了30%的保护性[3],使人们在抗艾滋病中备受鼓舞,但该疫苗的保护性差强人意。因此,人们必须从更全面和深入的层次研究保护性免疫反应,这样才能研制出更有效的疫苗[4]。
研究结果显示,传统HIV-1疫苗策略很难诱导广谱中和抗体(broadly neutralizing antibody,bnAb),但10%~30%的患者在感染2年后血清中可出现针对不同病毒的中和活性。通过评价,将血清广谱性和中和活性特别强的患者(约1%)称为“精英患者”[2],他们的血清在体外可中和多种亚型的HIV-1,输送给动物模型能使其免于HIV-1感染,从而产生被动保护[5]。
深入探索这些患者的免疫系统如何产生广谱中和抗体,通过疫苗重现广谱中和抗体的发生过程,这是当今艾滋病研究领域内的重点和难点。
1 抗HIV广谱中和活性抗体筛选的新技术
血清中的广谱中和活性,可能是多种单克隆抗体产生的协同作用,也可能是有限的几种单克隆抗体所发挥的作用。如果有这种单克隆抗体存在,其是否能强到阻止个体感染HIV-1?近几年的研究表明,具有广谱中和活性的单克隆抗体在体内是存在的,但不能完全排除多个抗体协同的抗病毒作用。
早些年研究者分离出一些能中和多个HIV-1亚型的抗体,其中b12是Burton等[6,7]用HIV-1阳性患者骨髓所建立的噬菌体表面展示Fab库与gp120膜蛋白结合的方式筛选得到的,为非自然抗体,其抗体重链和轻链可能来自不同的B细胞。2F5、4E10、2G12是Buchacher等[8]将患者外周血单核细胞(peripheral blood mononuclear cell,PBMC)永生化,再用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)筛选IgG阳性和HIV-1阳性细胞系得到的。近10年来,人们逐渐分离获得更广谱、更高中和活性的单克隆抗体,尤其是近5年来分离的中和抗体在广谱性和中和活性方面有了极大提高[4]。
应用流式细胞术可直接通过B细胞表面标记分子分离到符合要求的记忆B细胞。Nussenzweig等[9]发展了通过反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)和特异性引物设计,克隆出单个B细胞抗体重链、轻链可变区的方法;并在近2年改进了引物设计,克隆出的可变区包含更多的原有突变位点。将可变区克隆到含有对应恒定区的载体上并转染293细胞,获得可纯化的并保持特异性的抗体。
如果通过记忆细胞直接获得IgG,可避免构建大量抗体基因的克隆,实现高通量的B细胞初筛。Walker等[10]将记忆B细胞以1.3个/孔的密度分选到384孔板中,刺激并培养8 d后,用培养上清液进行亲和试验及中和试验筛选B细胞。Kwakkenbos等[11]对记忆B细胞培养优化,将每6~8个记忆 B细胞分到一个孔中,并通过引入Bcl-6和Bcl-xL及Tfh帮助分泌大量IgG。Walker等[10]改进96孔板中和试验,在384孔板上用15 μ l上清液进行,使以往复杂的抗体中和试验变得更加高通量。
仅靠亲和性筛选可能会筛出无交叉中和活性的抗体。大量免疫原性高的可变区表位隐藏了真正的中和表位。除直接用中和特性筛选记忆B细胞外,研究人员还设计了只含有保守表位的特异性钓饵,如RSC3、2CC等,钓出了一系列具有很好广谱中和活性的抗体,如VRC01[4]。其他实验室也有用gp41的近膜胞外结合区域(membrane-proximal external region,MPER)做钓饵,分选记忆B细胞,但筛出的抗体广谱性较差。
利用高通量测序可获得大量抗体重链或轻链可变区的序列,据此推测广谱中和抗体的亲和成熟过程,对研究病毒逃逸与抗体进化的关系、疫苗的研发具有重要启示。然而,抗体高通量测序的弊端是无法得到一一对应的抗体重链和轻链序列[12]。
2 HIV-1广谱中和抗体
广谱中和抗体所识别的HIV-1膜蛋白敏感区域可分为四大类(表1):gp120(识别CD4并与其结合,产生结构变化暴露膜融合位点)与CD4结合的部位 (CD4 binding site,CD4bs)、可变区1和2(variable regions 1 and 2,V1V2)的糖基化位点、可变区3(variable region 3,V3)的糖基化位点、gp41(介导膜融合)的MPER(图1)。分离出的具有代表性的广谱中和抗体及其分类详细介绍如下。
表1 HIV-1广谱中和抗体的分类和特征[2]
Tab.1 Categories and features of HIV-1 bnAbs

bnAbsBreadthIC80(μ g/ml)Recognition featuresGenetic charactersSimilar nAbsCD4bs b1233%2.70Sensitive to V1 and V2 substitu-tions D368R,E370R,D477VDerived from phage library NA HJ1630%0.77Proximity of the CD4bs b12 epitope NA VRC0187%0.98CD4 mimicryVH1-2,5 amino acids length of CDRL3 VRC02, VRC03, NIH45-46, 3BNC60, BNC62, 3BNC117, 12A12, 12A21, 12A30, VRC-PG04, VRC-CH31 8ANC13157%4.02CD4 mimicryVH1-46,5 amino acids length of CDRL38ANC37, 8ANC134 CH10334%8.00CDR H3 mode of recognition and reasonable affinity maturationNRV1V2 PG970%0.31Preferred binding to trimeric Env Extended CDRH3 (28 amino acids)PG16,CH01-04 PGT14560%0.31Discontinuous conformational epitopesPGT141-144V3 2G1218%4.85Glycan only recognitionNR PGT12153%0.08Recognizes V1/V2 and V3 glycansPGT122,PGT123 PGT12856%0.11Recognizes V3 glycanPGT125-127, PGT130,PGT131 PGT135<30%NRRecognizes V3 and V4 glycansIGHV4-39, IGKV3-15PGT136,PGT137MPER 2F548%9.42ELDKWAS peptide recognitionm66 4E1088%8.98Sequence before transmembrane domain NR 10E897%2.05A narrow stretch of highly con-served gp41-hydrophobic resi-dues7H6 Z13<20%NRWNWFDITN peptide recognitionDerived from phage libraryNR
NA, not applicable; NR, not reported in the literature.

图1 HIV-1广谱中和抗体在膜蛋白上的表位示意图[4]
Fig.1 Major vulnerable sites on HIV-1 recognized by bnmAbs
2.1 识别CD4bs表位的抗体
为了保证感染过程,病毒与受体CD4结合的区域CD4bs必须非常保守,一直被认为是广谱中和抗体很好的靶点。然而,自从利用酵母展示的抗体库筛出针对CD4bs的b12以后,很长时间都未再筛选到CD4bs抗体,且由于b12仅重链参与表位结合,轻链不参与,人们怀疑这种抗体是否可天然产生。
2009年Corti等[13]用改进的EB病毒(Epstein-Barr virus, EBV)永生化记忆B细胞的方法,结合多种重组形式的HIV-1膜蛋白进行筛选,得到了抗体HJ16。其表位邻近b12表位,但不重叠,广谱性与b12和2F5相当。HJ16识别的表位与抗核心抗体相似,位于gp120外侧区与内侧区之间的α 5螺旋。
Wu等[14]改造HIV-1膜蛋白,去除V1V2、V3区域和C端的一部分,仅保留CD4bs的结合区域,将其他表面抗原区域用猴免疫缺陷病毒(simian immunodeficiency virus,SIV)或其他非HIV-1的病毒残基代替。以蛋白RSC3作为钓饵分选HIV感染患者的记忆B细胞,分选出与RSC3结合但无法与突变的Δ RSC3结合的记忆B细胞,获得了VRC01、VRC02、VRC03共3个单克隆抗体。其中VRC01是最有效的中和抗体,能中和173种HIV-1病毒株。VRC01模仿了CD4与gp120的结合,73%的CD4 N端区域与VRC01重叠,最初的CD4接触位点中有98%被VRC01覆盖。gp120的V5区和loop D的氨基酸改变的病毒突变体对VRC01天然耐受,说明这些区域是VRC01识别的关键位点。同时它还识别276位的N多糖[15]。此后,科学家们用类似方法筛选了大量具有广谱中和抗体的患者,获得了一系列广谱中和抗体,包括从74号患者中筛出的VRC-PG04、 VRC-PG04b[16],从CH0219患者中筛出的VRC-CH30-34[17]。PG04可中和178株HIV-1病毒株中的76%,中和活性和广谱性与PG9相当。与VRC01相比,VRC-PG04抗体与gp120的结合并没有促进辅助受体表位的暴露,由此认为CD4bs抗体也可通过不同方式识别和靠近CD4bs,CD4bs抗体对CD4的模拟与中和活性并无明显相关性。VRC-CH30-34的重链同样来源于IGHV1-2*02,具有80%~90%的广谱中和性。
Scheid等[18]用CD4结合状态下缺少V1V2和V3区的gp120糖蛋白(2CC)及YU-2 gp140三聚体作为钓饵,分选4例血清广谱中和能力很强患者的记忆B细胞。2CC除钓取CD4bs抗体外,还可将结合CD4诱导表位(CD4-induced epitope,CD4i)的抗体筛选出来。分离的NIH45-46、3BNC60、8ANC131、12A12等CD4bs抗体均可模拟CD4与gp120的结合,暴露辅助受体的结合位点,促进CD4i抗体的结合。值得注意的是,3BNC117平均80%抑制浓度(80% inhibitory concentration,IC80)值达0.3 μ g/ml,比VRC01有更好的广谱性和高效性。VRC01的突变体NIH45-46是利用YU-2 gp140三聚体筛选出的,NIH45-46和gp120的共结晶分析显示,NIH45-46在CDRH3有4个氨基酸插入,增强了NIH45-46与gp120内侧区的结合。NIH45-46的中和活性比VRC01更高,但不如3BNC117。而8ANC195识别的表位不是传统的CD4bs位点。
2.2 识别V1V2和V3表位的抗体
2009年Walker等[10]用标记CD3、CD14、CD16、IgM、IgA、IgD的磁珠富集IgG阳性记忆B细胞,用gp120、gp41进行ELISA阳性筛选,同时用高通量的中和试验筛选,获得2个中和抗体PG9和PG16,可分别中和162株HIV-1不同亚型毒株中的127株和119株,而对B亚型中和效果较差。竞争ELISA和突变株中和试验表明,PG9和PG16识别位点位于gp120上V2、V3的保守区域,且V2中156和160位上的天冬酰胺起关键作用,倾向于与三聚体结合,而与gp120、gp41单体不结合。
PGT系列抗体分离的方法与PG9相同,从4例“精英患者”中筛选出18个中和抗体,分别是PGT121~PGT123、PGT125~PGT131、PGT135~PGT137、PGT141~PGT145,其中多个抗体的中和活性比PG9、VRC01等强约10倍。同一患者中的不同克隆均由相同B细胞高频突变而来,且效价不同,如PGT131、 PGT136、 PGT137、 PGT144比其他相同来源的克隆IC50值大10~50倍。有的突变抗体之间中和活性相似但广谱性不同,如PGT128与PGT125~PGT127中和活性相似,但更加广谱。PGT135~PGT137在分离出的抗体中广谱性较差,但仍可高效中和30%的HIV-1 C亚型病毒。PGT141~PGT145抗体有明显结合HIV膜蛋白三聚体的趋势;而其他单克隆抗体可结合gp120单体,且均竞争结合2G12。此外,PGT135~PGT137还竞争V3特异性单克隆抗体。所有单克隆抗体无法结合去糖基化的gp120。实验证明,PGT125~PGT128、 PGT130特异性结合Man8GlcNAc2和Man9GlcNAc2。与2G12不同的是,它们不竞争结合甘露糖或Man4,提示不同的糖识别模式。假病毒突变中和试验证明,332和(或)301位点的N多糖对中和识别有重要作用。在gp120上糖的排布位置也对中和识别活性起关键作用。PGT系列抗体识别的新表位可能会成为疫苗设计的新靶点[19]。
借助于结合分离记忆B细胞、单克隆和多克隆培养、单细胞分选、EBV转化和重组抗体生产,Bonsignori等[20]从HIV-1 A亚型感染患者中的IgG阳性记忆B细胞中获得CH01~CH04中和抗体。CH01~CH04可中和91株HIV-1 tier2 假病毒中的38%~49%毒株,而未突变的B细胞原型的抗体只能中和16%的假病毒,与E.A244株gp120的亲和性可激活B细胞。这些抗体有相同的V(D)J重排、HCDR3长度(24个氨基酸残基)及相似的HCDR3、LCDR3,重链突变频率为11.5%~14.3%,识别的空间构象与PG9/PG16相似。不同的是,它们对127、159、171和181位具有中和敏感性,推测CH01~CH04结合分散的表位,或从不同方向结合PG9/PG16的表位。CH03有自身反应性,CH01~CH03有多反应性。值得注意的是,CH01~CH03与分离得到针对CD4bs的抗体VRC-CH31均来自同一患者CH0219[21]。这2类抗体的广谱性涵盖了患者血清的广谱性,能中和95%的病毒亚型,为设计可诱生多位点广谱中和活性的多价疫苗提供了依据。
在接种RV144疫苗的人群中,针对gp120的V1V2中和抗体的存在与HIV-1感染率呈明显负相关。针对V1V2的中和抗体在免疫人群中具有保护性,说明了V1V2表位的重要性[22]。
2.3 识别MPER表位的抗体
1994年Buchacher等[8]将HIV-1感染者的PBMC通过杂交瘤细胞永生化,筛选出2F5和4E10,其识别MPER的线性表位,通过抑制HIV-1膜蛋白与宿主细胞膜的融合发挥中和作用,2F5和4E10均有较强的自身反应性。有观点认为针对MPER的中和抗体难以产生是由于其祖先在发育早期免疫耐受形成时被清除。但也有观点认为其自身反应性是在免疫耐受形成后,通过体细胞高频突变获得的,没有被免疫耐受清除[4]。2001年Zwick等[23]用具有广谱中和血清的患者骨髓RNA构建噬菌体展示的抗体库,用MN多肽链 (LLELDKWASLWNWFDITNWLW)经过6轮亲和力筛选,得到中和抗体Z13,能中和HIV-1 B、CE亚型的一些病毒株。Nelson等[24]通过突变库筛选获得Z13的突变体Z13e1,比Z13的亲和性高100倍,同时具有高中和活性。
2012年Huang等[25]培养“精英患者”的记忆B细胞,从16 500个B细胞中分离获得10E8抗体。虽然也是针对MPER区域,但并没有与脂类结合和自身反应的特性,且广谱性达到98%,平均IC50值为0.35 μ g/ml。10E8 Fab与MPER肽段结构复合体显示MPER形成100o夹角的2个α 螺旋,10E8主要结合gp41疏水氨基酸残基和跨膜区之前的第681位氨基酸。78例患者中有8%产生了类似10E8特异性的抗体。
2.4 HIV-1广谱中和抗体的特征
HIV-1广谱中和抗体的特征为IgG突变率高,且CDRH3较长。人IgG抗体重链可变区大多含有10~20个碱基突变,交叉中和活性的HIV-1特异性IgG重链可变区的碱基突变提高了1倍,而广谱中和抗体的突变达到80个之多。有些抗体存在罕见的插入或缺失突变[12]。VRC01类抗体在抗体框架区也积累很多突变[4]。许多广谱中和抗体的天然B细胞无法被HIV-1膜蛋白激活,推测可能广谱中和抗体的亲和力成熟途径复杂,激活这些天然B细胞的有可能是其他病菌或自身蛋白[26]。B细胞VDJ重排过程中形成较长CDRH3的概率比较小,且在B细胞成熟过程中会因自身反应而清除大部分。CDRH3较长的抗体易出现自身反应性和多反应性。记忆B细胞中多反应性抗体的比例为23%左右,但HIV-1膜蛋白特异性的抗体中多反应性抗体比例高达70%[4]。
3 HIV疫苗设计启示
随着人们对膜蛋白结构及其表位与广谱中和单抗复合物结构的解析,研究人员试图通过膜蛋白的改造(截掉可变区、增加糖基化、增强空间构象稳定性等)尽量维持表位正确的折叠构象,还可避免非自然表位和非中和表位的暴露,以获得较好的免疫效果。如截去gp41跨膜区后的gp140形成三聚体结构,且嵌入序列加强三聚体的形成和稳定;去掉V3等免疫原性强的区域,减少非广谱中和抗体产生;引入计算机设计的突变,将gp120单体的核心区进行改造去除内侧区的表位, 使更多糖基化掩盖其他表位;直接截去内侧区序列;或选择较小的结构域,如CD4-binding β -15 loop或 MPER连到其他蛋白上作为骨架稳定表位[27]。

图2激活特定广谱中和抗体初始B细胞的疫苗策略[31]
Fig.2 Vaccine strategies to activate naïve B cells to produce bnAbs
研究人员还从广谱中和抗体发生过程的角度设计并改造HIV-1膜蛋白。Georgiev等[28]分析了30个中和抗体与34个HIV-1亚型的中和相关性,对患者血清中针对各个表位的中和活性抗体的贡献进行初步量化,发现有些患者血清的中和活性主要针对一个膜蛋白的保守表位,而其他患者体内的抗体可针对2个甚至更多HIV-1膜蛋白靶点[4]。
Zhou等[12]对5例血清中有VRC01类抗体的患者进行高通量测序和抗体结构解析,发现各患者中VRC01类抗体的成熟过程非常接近。每个个体中的VRC01类抗体都来源于一个或几个天然B细胞。产生VRC01类抗体的天然B细胞存在于正常人体内的概率很大。通过设计HIV-1膜蛋白抗原,激活CD4bs抗体的初始B细胞,可增加产生CD4bs广谱中和抗体的可能性。如果进一步刺激使抗体向识别CD4bs表位定向进化,可诱导产生CD4bs类抗体。Jardine等[29]借助于计算机设计并改造gp120膜蛋白,通过多个CD4bs广谱中和抗体与其初始B细胞的结合进行体外筛选,获得eOD-GT6抗原,可激活CD4bs广谱中和抗体的初始B细胞;McGuire等发现[30],如果将位于膜蛋白D环和V5区的2个糖基化位点除去,此膜蛋白就可识别并激活VRC01的初始B细胞。他们认为是糖基化遮挡了初始B细胞的识别。这些尝试性研究为疫苗的初免免疫原设计起指导作用。然而,这些B细胞后续进化为识别CD4bs表位需多步免疫加强,突出保守表位。如何诱导出针对CD4bs的广谱中和抗体还需进一步探索(图2)。
Liao等[31]研究了CH505患者的病毒-中和单克隆抗体CH103共进化的过程。CH103经历13%~17%的突变获得了55%的中和广谱性,并随突变获得了多反应性。研究发现,CH103的初始B细胞可结合感染病毒(founder virus)的膜蛋白,但无法结合异源病毒膜蛋白和RSC3。30、53、78周自体病毒膜蛋白失去了对CH103初始B细胞的结合能力,只结合过渡的抗体和CH103~CH106。而78周后出现的2个膜蛋白突变,使其失去了与过渡抗体和CH103~CH106抗体的结合力,病毒的逃逸有助于血清广谱性产生。研究人员认为,CH505患者在感染6个月,病毒膜蛋白就在CH103抗体谱系的表位区域(CD4bs)积累了大量突变,而其他患者在1年后才出现此位置的突变,这可解释CH505患者体内较早产生广谱中和抗体的现象。由此提出免疫策略:CH505患者感染病毒的膜蛋白可作为初免,再用不同时间点的自体病毒膜蛋白加强免疫,重现HIV-1感染者体内抗体亲和力成熟与病毒逃逸过程,这有待实验证实(图3)。
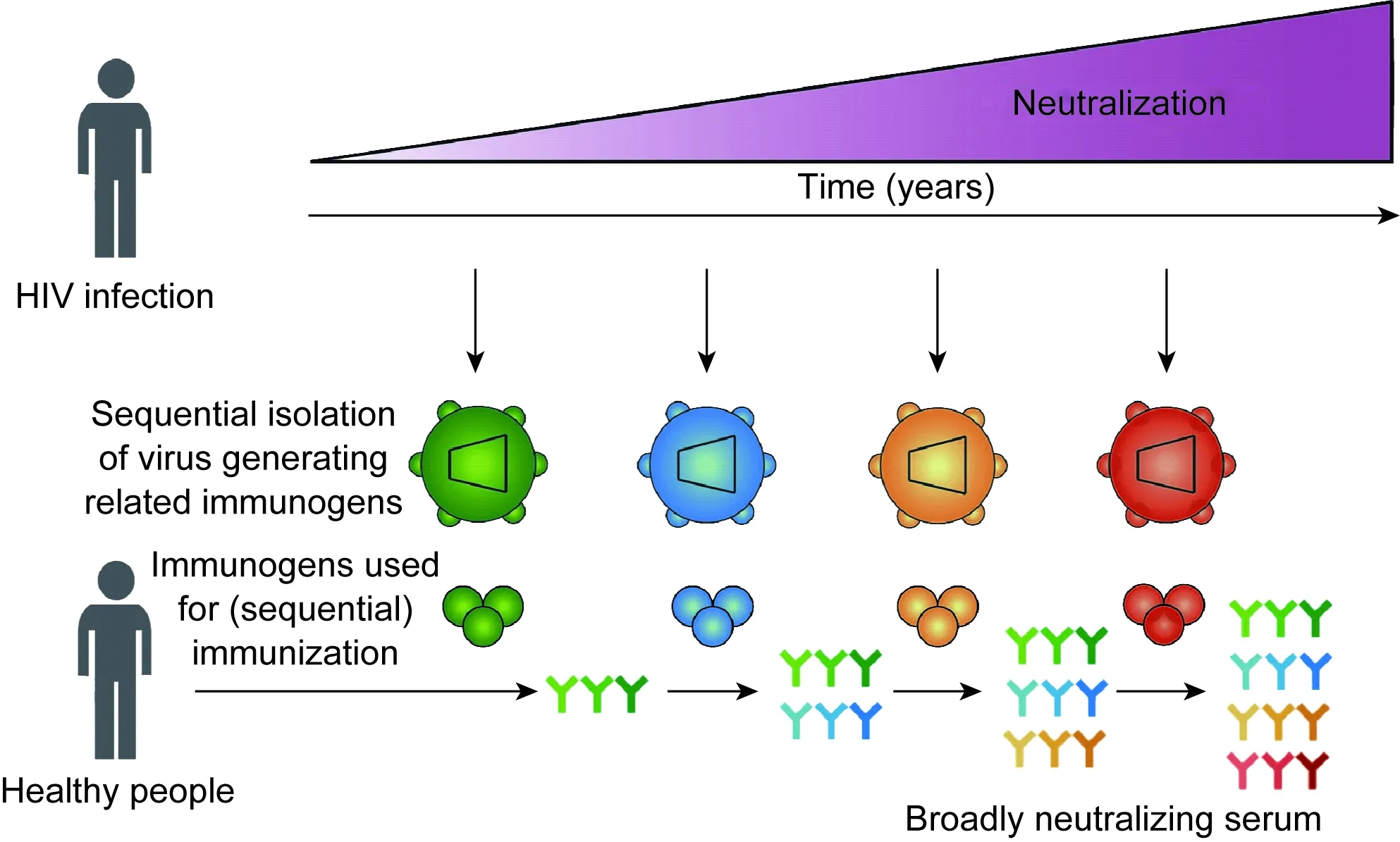
图3顺序免疫精英患者逃逸病毒Env的疫苗策略[4]
Fig.3 Vaccine strategies based on sequential immunization
Moore等[32]在CAP256患者中也对病毒逃逸和抗体进化做了细致研究。该患者在感染HIV-1 C亚型3个月后,被V2区抗体敏感的HIV-1重复感染,初次感染和重复感染的病毒在体内发生重组,最终患者产生了针对V2区R166、K169及高效广谱的中和抗体。针对V1V2的自身抗体用11周就进化为针对相同区域的中和重复感染病毒的高效价抗体,说明免疫系统可短时间内产生针对V2区的广谱抗体。 SIV感染恒河猴实验显示了类似结果,N160和N332依赖的抗体普遍在恒河猴个体中出现,提示识别糖的中和抗体在自然感染时容易产生,可作为疫苗靶点[33]。抗体进化与病毒逃逸的相互关系显示,患者时序性血清对不同亚型病毒的中和能力呈现出3个波段:①最初抗体识别N167,病毒发生N167D部分逃逸,抗体进化产生针对N160的抗体,产生交叉活性,形成第1个波峰;②病毒部分逃逸,发生N160突变,但这是短暂的逃逸,因为N160突变暴露了其他中和位点,免疫系统产生第2个波峰,通过病毒突变逃逸实验推测这时抗体识别依赖糖的 CD4bs,类似HJ16;③病毒在T278A/N279D和R456W后又产生了针对第2波峰的血清逃逸。CAP257患者体内出现PG9抗体后,出现了类HJ16抗体,且在其他有多类中和抗体的患者血清中均能分离到针对V2和CD4bs的抗体。如果利用几个逃逸的病毒膜蛋白作为疫苗顺序免疫,有可能免疫出类似CAP257患者的几个血清波峰,产生针对多处的多类抗体,协同保护机体,防止HIV-1感染。
综上所述,先进技术的使用促进了高效广谱中和抗体的分离、表位结构的鉴定和对中和抗体发生过程的重现。通过“精英患者”深入了解HIV-1与免疫系统的相互作用过程,研究人员提出了一些疫苗设计策略:①将广谱中和抗体的初始B细胞作为靶点,特定诱导这些有潜力的B细胞分化、增殖,定向诱导为广谱中和单克隆抗体;②选择不同时间点“精英患者”的病毒序列顺序免疫,重现逃逸与抗体进化过程,诱导产生多类中和抗体,产生协同保护作用;③采用反向疫苗设计思路,主动设计并改造膜蛋白形式,将HIV-1广谱中和抗体的关键表位转化为高效的HIV-1疫苗,这将是未来研究的主要方向。但是,哪种疫苗策略能真正在人体中诱导保护性广谱中和抗体,还需进一步探索。我们坚信,随着对HIV表面蛋白和广谱中和抗体结构及功能的深入研究,一定能在不远的将来成功研发出有效的艾滋病疫苗,为人类的健康事业作出贡献。
[1] Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vézinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS) [J]. Science, 1983, 220(4599): 868-871.
[2] Kwong PD, Mascola JR, Nabel GJ. Broadly neutralizing antibodies and the search for an HIV-1 vaccine: the end of the beginning [J]. Nat Rev Immunol, 2013, 13(9): 693-701.
[3] Rerks-Ngarm S, Pitisuttithum P, Nitayaphan S, Kaewkungwal J, Chiu J, Paris R, Premsri N, Namwat C, de Souza M, Adams E, Benenson M, Gurunathan S, Tartaglia J, McNeil JG, Francis DP, Stablein D, Birx DL, Chunsuttiwat S, Khamboonruang C, Thongcharoen P, Robb ML, Michael NL, Kunasol P, Kim JH, MOPHTAVEG Investigators. Vaccination with ALVAC and AIDSVAX to prevent HIV-1 infection in Thailand [J]. N Engl J Med, 2009, 361(23): 2209-2220.
[4] Klein F, Mouquet H, Dosenovic P, Scheid JF, Scharf L, Nussenzweig MC. Antibodies in HIV-1 vaccine development and therapy [J]. Science, 2013, 341(6151): 1199-1204.
[5] Mascola JR, Montefiori DC. The role of antibodies in HIV vaccines [J]. Annu Rev Immunol, 2010, 28: 413-444.
[6] Burton DR, Pyati J, Koduri R, Sharp SJ, Thornton GB, Parren PW, Sawyer LS, Hendry RM, Dunlop N, Nara PL, et al. Efficient neutralization of primary isolates of HIV-1 by a recombinant human monoclonal antibody [J]. Science, 1994, 266(5187): 1024-1027.
[7] Burton DR, Barbas CR, Persson MA, Koenig S, Chanock RM, Lerner RA. A large array of human monoclonal antibodies to type 1 human immunodeficiency virus from combinatorial libraries of asymptomatic seropositive individuals [J]. Proc Natl Acad Sci USA, 1991, 88(22): 10134-10137.
[8] Buchacher A, Predl R, Strutzenberger K, Steinfellner W, Trkola A, Purtscher M, Gruber G, Tauer C, Steindl F, Jungbauer A, et al. Generation of human monoclonal antibodies against HIV-1 proteins; electrofusion and Epstein-Barr virus transformation for peripheral blood lymphocyte immortalization [J]. AIDS Res Hum Retroviruses, 1994, 10(4): 359-369.
[9] Tiller T, Meffre E, Yurasov S, Tsuiji M, Nussenzweig MC, Wardemann H. Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning [J]. J Immunol Methods, 2008, 329(1-2): 112-124.
[10] Walker LM, Phogat SK, Chan-Hui PY, Wagner D, Phung P, Goss JL, Wrin T, Simek MD, Fling S, Mitcham JL, Lehrman JK, Priddy FH, Olsen OA, Frey SM, Hammond PW, Protocol G Principal Investigators, Kaminsky S, Zamb T, Moyle M, Koff WC, Poignard P, Burton DR. Broad and potent neutralizing antibodies from an African donor reveal a new HIV-1 vaccine target [J]. Science, 2009, 326(5950): 285-289.
[11] Kwakkenbos MJ, Diehl SA, Yasuda E, Bakker AQ, van Geelen CM, Lukens MV, van Bleek GM, Widjojoatmodjo MN, Bogers WM, Mei H, Radbruch A, Scheeren FA, Spits H, Beaumont T. Generation of stable monoclonal antibody-producing B cell receptor-positive human memory B cells by genetic programming [J]. Nat Med, 2010, 16(1): 123-128.
[12] Zhou T, Zhu J, Wu X, Moquin S, Zhang B, Acharya P, Georgiev IS, Altae-Tran HR, Chuang GY, Joyce MG, Do KY, Longo NS, Louder MK, Luongo T, McKee K, Schramm CA, Skinner J, Yang Y, Yang Z, Zhang Z, Zheng A, Bonsignori M, Haynes BF, Scheid JF, Nussenzweig MC, Simek M, Burton DR, Koff WC, NISC Comparative Sequencing Program, Mullikin JC, Connors M, Shapiro L, Nabel GJ, Mascola JR, Kwong PD. Multidonor analysis reveals structural elements, genetic determinants, and maturation pathway for HIV-1 neutralization by VRC01-class antibodies [J]. Immunity, 2013, 39(2): 245-258.
[13] Corti D, Langedijk JP, Hinz A, Seaman MS, Vanzetta F, Fernandez-Rodriguez BM, Silacci C, Pinna D, Jarrossay D, Balla-Jhagjhoorsingh S, Willems B, Zekveld MJ, Dreja H, O'Sullivan E, Pade C, Orkin C, Jeffs SA, Montefiori DC, Davis D, Weissenhorn W, McKnight A, Heeney JL, Sallusto F, Sattentau QJ, Weiss RA, Lanzavecchia A. Analysis of memory B cell responses and isolation of novel monoclonal antibodies with neutralizing breadth from HIV-1-infected individuals [J]. PLoS One, 2010, 5(1): e8805.
[14] Wu X, Yang ZY, Li Y, Hogerkorp CM, Schief WR, Seaman MS, Zhou T, Schmidt SD, Wu L, Xu L, Longo NS, McKee K, O'Dell S, Louder MK, Wycuff DL, Feng Y, Nason M, Doria-Rose N, Connors M, Kwong PD, Roederer M, Wyatt RT, Nabel GJ, Mascola JR. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1 [J]. Science, 2010, 329(5993): 856-861.
[15] Zhou T, Georgiev I, Wu X, Yang ZY, Dai K, Finzi A, Kwon YD, Scheid JF, Shi W, Xu L, Yang Y, Zhu J, Nussenzweig MC, Sodroski J, Shapiro L, Nabel GJ, Mascola JR, Kwong PD. Structural basis for broad and potent neutralization of HIV-1 by antibody VRC01 [J]. Science, 2010, 329(5993): 811-817.
[16] Falkowska E, Ramos A, Feng Y, Zhou T, Moquin S, Walker LM, Wu X, Seaman MS, Wrin T, Kwong PD, Wyatt RT, Mascola JR, Poignard P, Burton DR. PGV04, an HIV-1 gp120 CD4 binding site antibody, is broad and potent in neutralization but does not induce conformational changes characteristic of CD4 [J]. J Virol, 2012, 86(8): 4394-4403.
[17] Wu X, Zhou T, Zhu J, Zhang B, Georgiev I, Wang C, Chen X, Longo NS, Louder M, McKee K, O'Dell S, Perfetto S, Schmidt SD, Shi W, Wu L, Yang Y, Yang ZY, Yang Z, Zhang Z, Bonsignori M, Crump JA, Kapiga SH, Sam NE, Haynes BF, Simek M, Burton DR, Koff WC, Doria-Rose NA, Connors M, NISC Comparative Sequencing Program, Mullikin JC, Nabel GJ, Roederer M, Shapiro L, Kwong PD, Mascola JR. Focused evolution of HIV-1 neutralizing antibodies revealed by structures and deep sequencing [J]. Science, 2011, 333(6049): 1593-1602.
[18] Scheid JF, Mouquet H, Ueberheide B, Diskin R, Klein F, Oliveira TY, Pietzsch J, Fenyo D, Abadir A, Velinzon K, Hurley A, Myung S, Boulad F, Poignard P, Burton DR, Pereyra F, Ho DD, Walker BD, Seaman MS, Bjorkman PJ, Chait BT, Nussenzweig MC. Sequence and structural convergence of broad and potent HIV antibodies that mimic CD4 binding [J]. Science, 2011, 333(6049): 1633-1637.
[19] Walker LM, Huber M, Doores KJ, Falkowska E, Pejchal R, Julien JP, Wang SK, Ramos A, Chan-Hui PY, Moyle M, Mitcham JL, Hammond PW, Olsen OA, Phung P, Fling S, Wong CH, Phogat S, Wrin T, Simek MD, Protocol G Principal Investigators, Koff WC, Wilson IA, Burton DR, Poignard P. Broad neutralization coverage of HIV by multiple highly potent antibodies [J]. Nature, 2011, 477(7365): 466-470.
[20] Bonsignori M, Hwang KK, Chen X, Tsao CY, Morris L, Gray E, Marshall DJ, Crump JA, Kapiga SH, Sam NE, Sinangil F, Pancera M, Yongping Y, Zhang B, Zhu J, Kwong PD, O'Dell S, Mascola JR, Wu L, Nabel GJ, Phogat S, Seaman MS, Whitesides JF, Moody MA, Kelsoe G, Yang X, Sodroski J, Shaw GM, Montefiori DC, Kepler TB, Tomaras GD, Alam SM, Liao HX, Haynes BF. Analysis of a clonal lineage of HIV-1 envelope V2/V3 conformational epitope-specific broadly neutralizing antibodies and their inferred unmutated common ancestors [J]. J Virol, 2011, 85(19): 9998-10009.
[21] Bonsignori M, Montefiori DC, Wu X, Chen X, Hwang KK, Tsao CY, Kozink DM, Parks RJ, Tomaras GD, Crump JA, Kapiga SH, Sam NE, Kwong PD, Kepler TB, Liao HX, Mascola JR, Haynes BF. Two distinct broadly neutralizing antibody specificities of different clonal lineages in a single HIV-1-infected donor: implications for vaccine design [J]. J Virol, 2012, 86(8): 4688-4692.
[22] Haynes BF, Gilbert PB, McElrath MJ, Zolla-Pazner S, Tomaras GD, Alam SM, Evans DT, Montefiori DC, Karnasuta C, Sutthent R, Liao HX, DeVico AL, Lewis GK, Williams C, Pinter A, Fong Y, Janes H, DeCamp A, Huang Y, Rao M, Billings E, Karasavvas N, Robb ML, Ngauy V, de Souza MS, Paris R, Ferrari G, Bailer RT, Soderberg KA, Andrews C, Berman PW, Frahm N, De Rosa SC, Alpert MD, Yates NL, Shen X, Koup RA, Pitisuttithum P, Kaewkungwal J, Nitayaphan S, Rerks-Ngarm S, Michael NL, Kim JH. Immune-correlates analysis of an HIV-1 vaccine efficacy trial [J]. N Engl J Med, 2012, 366(14): 1275-1286.
[23] Zwick MB, Labrijn AF, Wang M, Spenlehauer C, Saphire EO, Binley JM, Moore JP, Stiegler G, Katinger H, Burton DR, Parren PW. Broadly neutralizing antibodies targeted to the membrane-proximal external region of human immuno-deficiency virus type 1 glycoprotein gp41 [J]. J Virol, 2001, 75(22): 10892-10905.
[24] Nelson JD, Brunel FM, Jensen R, Crooks ET, Cardoso RM, Wang M, Hessell A, Wilson IA, Binley JM, Dawson PE, Burton DR, Zwick MB. An affinity-enhanced neutralizing antibody against the membrane-proximal external region of human immunodeficiency virus type 1 gp41 recognizes an epitope between those of 2F5 and 4E10 [J]. J Virol, 2007, 81(8): 4033-4043.
[25] Huang J, Ofek G, Laub L, Louder MK, Doria-Rose NA, Longo NS, Imamichi H, Bailer RT, Chakrabarti B, Sharma SK, Alam SM, Wang T, Yang Y, Zhang B, Migueles SA, Wyatt R, Haynes BF, Kwong PD, Mascola JR, Connors M. Broad and potent neutralization of HIV-1 by a gp41-specific human antibody [J]. Nature, 2012, 491(7424): 406-412.
[26] Bonsignori M, Alam SM, Liao HX, Verkoczy L, Tomaras GD, Haynes BF, Moody MA. HIV-1 antibodies from infection and vaccination: insights for guiding vaccine design [J]. Trends Microbiol, 2012, 20(11): 532-539.
[27] Kwong PD, Mascola JR, Nabel GJ. Rational design of vaccines to elicit broadly neutralizing antibodies to HIV-1 [J]. Cold Spring Harb Perspect Med, 2011, 1(1): a007278.
[28] Georgiev IS, Doria-Rose NA, Zhou T, Kwon YD, Staupe RP, Moquin S, Chuang GY, Louder MK, Schmidt SD, Altae-Tran HR, Bailer RT, McKee K, Nason M, O’Dell S, Ofek G, Pancera M, Srivatsan S, Shapiro L, Connors M, Migueles SA, Morris L, Nishimura Y, Martin MA, Mascola JR, Kwong PD. Delineating antibody recognition in polyclonal sera from patterns of HIV-1 isolate neutralization [J]. Science, 2013, 340(6133): 751-756.
[29] Jardine J, Julien JP, Menis S, Ota T, Kalyuzhniy O, McGuire A, Sok D, Huang PS, MacPherson S, Jones M, Nieusma T, Mathison J, Baker D, Ward AB, Burton DR, Stamatatos L, Nemazee D, Wilson IA, Schief WR. Rational HIV immunogen design to target specific germline B cell receptors [J]. Science, 2013, 340(6133): 711-716.
[30] McGuire AT, Hoot S, Dreyer AM, Lippy A, Stuart A, Cohen KW, Jardine J, Menis S, Scheid JF, West AP, Schief WR, Stamatatos L. Engineering HIV envelope protein to activate germline B cell receptors of broadly neutralizing anti-CD4 binding site antibodies [J]. J Exp Med, 2013, 210(4): 655-663.
[31] Liao HX, Lynch R, Zhou T, Gao F, Alam SM, Boyd SD, Fire AZ, Roskin KM, Schramm CA, Zhang Z, Zhu J, Shapiro L, NISC Comparative Sequencing Program, Mullikin JC, Gnanakaran S, Hraber P, Wiehe K, Kelsoe G, Yang G, Xia SM, Montefiori DC, Parks R, Lloyd KE, Scearce RM, Soderberg KA, Cohen M, Kamanga G, Louder MK, Tran LM, Chen Y, Cai F, Chen S, Moquin S, Du X, Joyce MG, Srivatsan S, Zhang B, Zheng A, Shaw GM, Hahn BH, Kepler TB, Korber BT, Kwong PD, Mascola JR, Haynes BF. Co-evolution of a broadly neutralizing HIV-1 antibody and founder virus [J]. Nature, 2013, 496(7446): 469-476.
[32] Moore PL, Sheward D, Nonyane M, Ranchobe N, Hermanus T, Gray ES, Abdool KS, Williamson C, Morris L. Multiple pathways of escape from HIV broadly cross-neutralizing V2-dependent antibodies [J]. J Virol, 2013, 87(9): 4882-4894.
[33] Walker LM, Sok D, Nishimura Y, Donau O, Sadjadpour R, Gautam R, Shingai M, Pejchal R, Ramos A, Simek MD, Geng Y, Wilson IA, Poignard P, Martin MA, Burton DR. Rapid development of glycan-specific, broad, and potent anti-HIV-1 gp120 neutralizing antibodies in an R5 SIV/HIV chimeric virus infected macaque[J]. Proc Natl Acad Sci USA, 2011, 108(50): 20125-20129.
