全反式维甲酸联合TK基因治疗对骨肉瘤旁观者效应的研究
2013-01-02霍洪亮李晋惠原元凯张桦栋
霍洪亮, 吕 智, 冯 毅, 李晋惠, 原元凯, 张桦栋
在骨肉瘤的基因治疗研究中,自杀基因(TK)系统受到广泛的重视,自杀基因系统的旁观者效应更是引起肿瘤消退的重要因素。我们以人骨肉瘤U-2细胞株为研究对象,观察全反式维甲酸能否增强自杀基因/丙氧鸟苷质粒(plRES-EGFP-TK/GCV)系统对人骨肉瘤U-2细胞的杀伤力和旁观者效应。
1 材料和方法
1.1 材料与主要试剂 人骨肉瘤U-2细胞株购自南京凯基生物科技发展有限公司;TK基因cDNA片段、表达载体plRES-EGFP购自武汉三鹰生物技术有限公司;Lipofectamine 2000转染试剂盒购自Invitrogen公司;全反式维甲酸(ATRA)、更昔洛韦(丙氧鸟苷,GCV)购自Sigma公司;ELISA试剂盒购自上海西唐科技有限公司。
1.2 人骨肉瘤U-2细胞培养和转染 人骨肉瘤U-2细胞用含10%胎牛血清的DMEM液培养,于5%CO2,37 ℃恒温培养箱中。以每孔约1×105个细胞的密度将人骨肉瘤U-2细胞接种于六孔板中,培养至约70%覆盖率。用Lipofectamine 2000作为转染载体。去除培养基,PBS洗涤细胞2~3次,将10 μL(2 μg)TK质粒溶于240 μL无抗无血清培养液中,另取5 μL Lipofectamine 2000溶于245 μL无抗无血清培养液中,置室温5 min后将二者轻柔混合,室温孵育20 min后将lipo-TK复合体轻铺于6孔板中,再加入无抗无血清培养液至2 mL,37 ℃,5%CO2培养4 h后,更换含血清完全培养基。培养24 h后荧光显微镜下观察转染百分率,在流式细胞仪上检测荧光蛋白阳性细胞率,即转染率。
1.3 筛选稳定转染表达系 将人骨肉瘤U-2细胞稀释至1 000个/mL,接种至含有100 μL培养基的24孔板中,每孔中的G418浓度分别为0、100、200、300、400、500、600、700、800、900、1 000、1 100 ng/mL,共12个级别,培养48 h,以最低细胞全部死亡浓度为基准,筛选时比该浓度再高一级别进行筛选,维持筛选时,使用该浓度的一半。将转染的细胞以1∶4的比例传代,贴壁24 h后加选择性培养基开始筛选,大部分细胞死亡后,把这些细胞经24孔板、6孔板放大操作,得到稳定转染表达系。
1.4 旁观者效应的测定 将稳定表达细胞以每孔约1×103个接种于96孔板,分别以100、50、10、5、0 μmol/L为终质量浓度加入GCV,24 h后MTT法分别计算细胞成活率;分别取对数生长期的TK+U-2细胞和U-2细胞并培养,用培养液制成1×105个/mL悬液;按TK+U-2/U-2分别为0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%混合,将细胞接种于96孔板,每孔100 μL,放入5%CO237 ℃培养箱培养;24 h后,每孔加入终质量浓度为100 μmol/L GCV或GCV(终质量浓度为100 μmol/L)+ATRA(终质量浓度为10-6mol/L),同时设立对照组;于加药后24 h、48 h、72 h取出1块96孔板,每孔加入20 μL MTT液(浓度为5 g/L),继续培养4 h后吸去培养液,每孔加入150 μL二甲基亚砜(DMSO),摇床振荡10 min使蓝紫色沉淀颗粒完全溶解,在酶标仪上492 nm时测定各孔吸光度(A)值,计算细胞抑制率。实验重复3次。抑制率(%)=(1-实验组平均A值/对照组平均A值)×100%。
1.5 CX43蛋白的检测 以每孔约1×105个细胞的密度将人骨肉瘤U-2细胞接种于六孔板中,培养至约80%覆盖率,将终质量浓度10-6mol/L ATRA加入孔中,设置PBS组和空白对照组,分别培养24 h、36 h、72 h后将细胞上清液收集,根据ELISA试剂盒说明书操作,酶标仪450 nm测吸光值,绘制标准曲线,得出CX43蛋白的含量。
1.6 统计学方法 运用SPSS12.0软件分析,统计学方法采用q检验、t检验, 以P<0.05为差异有统计学意义。
2 结果
2.1 人骨肉瘤U-2细胞转染结果 倒置荧光显微镜下观察,成功将重组质粒导入到人骨肉瘤U-2细胞中,流式细胞仪测定转染荧光效率为61.8%。图1~3。
图1 TK基因转染人骨肉瘤U-2细胞24 h后荧光显微镜下观察(×20)
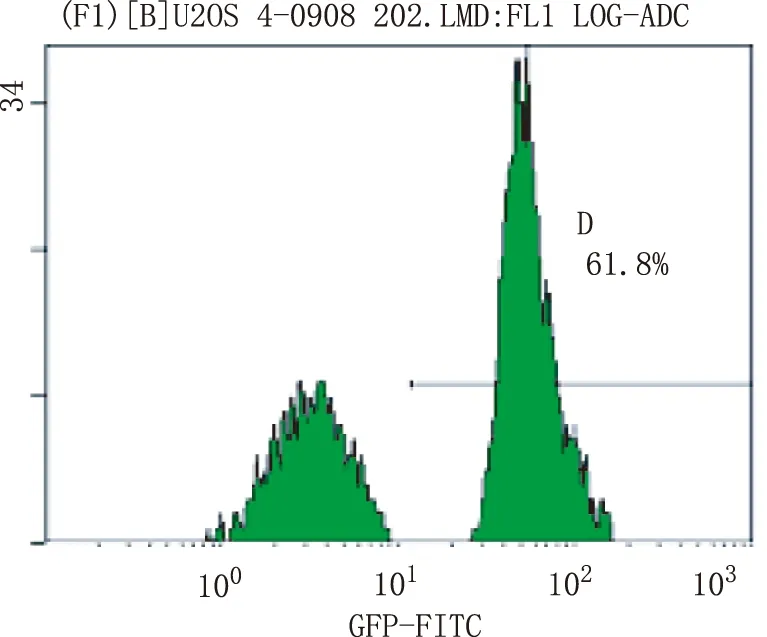
图2 流式细胞仪测定实验组转染效率
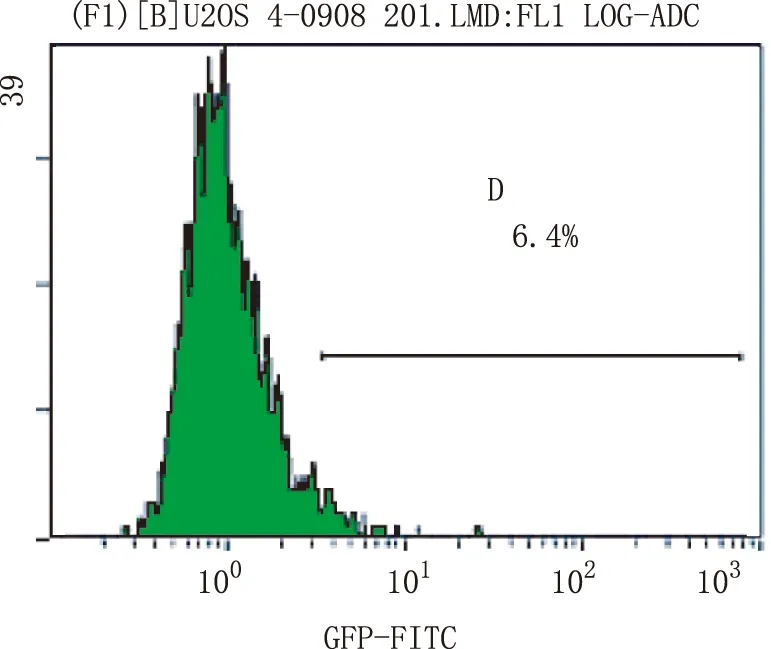
图3 流式细胞仪测定对照组转染效率
2.2 ATRA对plRES-EGFP-TK/GCV系统治疗人骨肉瘤U-2细胞旁观者效应的影响 plRES-EGFP-TK/GCV系统联合或不联合ATRA治疗人骨肉瘤U-2细胞旁观者效应的比较见表1,混合培养时TK+∶TK-U-2细胞在6∶4到2∶8之间采用两独立样本t检验,差异有统计学意义(P<0.05),而在其他混合比例之间差异无统计学意义。plRES-EGFP-TK/GCV系统对人骨肉瘤U-2细胞旁观者效应在TK+∶TK-细胞混合比例为5∶5时明显出现(P<0.05),而联合ATRA后,在TK+∶TK-细胞混合比例为3∶7时就明显出现(P<0.05),plRES-EGFP-TK/GCV系统联合ATRA作用人骨肉瘤U-2细胞后,细胞抑制率均达到50%时,与单纯plRES-EGFP-TK/GCV系统作用时TK+细胞降低20%。
2.3 ATRA(终质量浓度为10-6mol/L)处理后CX43蛋白表达水平的影响 ATRA未处理组中,CX43蛋白表达量为(0.208±0.005)ng/mL,加入ATRA之后的24 h、48 h、72 h的结果见图4,差异有统计学意义(P<0.01)。
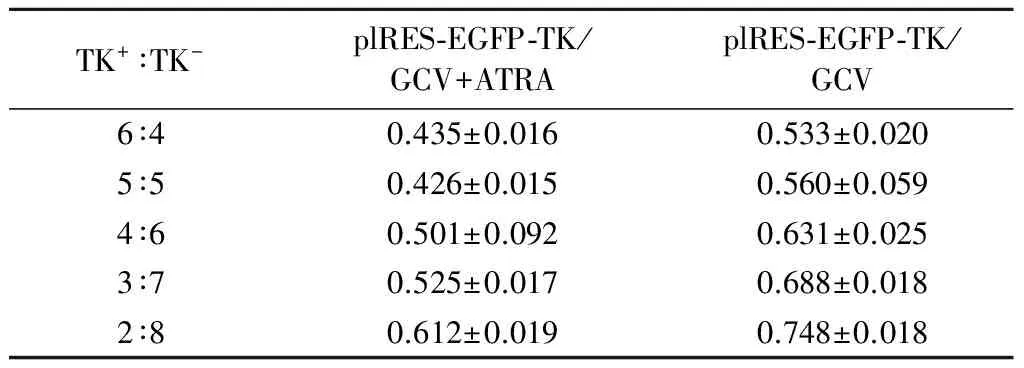
表1 ATRA与plRES-EGFP-TK/GCV系统联合与否对U-2细胞旁观者效应的影响(细胞存活率,×100%,n=4)
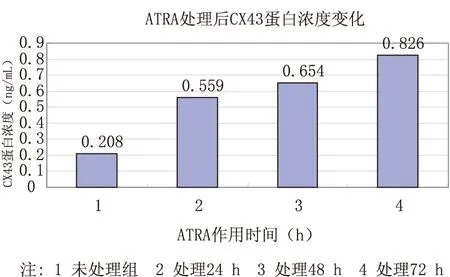
图4 ATRA处理人骨肉瘤U-2细胞后CX43蛋白浓度变化
3 讨论
骨肉瘤是青少年最常见的原发恶性骨肿瘤,其恶性程度高,发现时常已有微小肺转移,且预后普遍较差[1-2]。随着医学的发展,骨肉瘤的治疗方案在不断的改进,特别是上世纪八十年代开展的新辅助化疗使其5年生存率从30多年前的不到20%提高到现在的60%左右,手术保肢率也明显提高[3]。虽然新辅助化疗的广泛应用使骨肉瘤患者的生存率得到明显提高,但是肿瘤的多药耐药性严重影响了化疗效果[4]。因此寻找其他治疗途径显得尤为重要,近年来研究显示,HSV-TK/GCV自杀基因治疗系统是较有应用前景的肿瘤基因治疗方案之一[5],本实验中,我们观察ATRA联合自杀基因治疗骨肉瘤细胞的影响。
自杀基因治疗系统中除了转染TK基因本身的“自杀效应”外,抑制肿瘤的另一重要机制就是“旁观者效应”(BE)[6]。在前药存在的条件下,BE可将转染TK基因的肿瘤细胞产生的毒性产物引起未转染TK基因的肿瘤细胞的死亡。因此,增加自杀基因的BE,则可以增强自杀基因系统抗肿瘤的效果。本研究结果显示,ATRA联合plRES-EGFP-TK/GCV系统对人骨肉瘤U-2细胞的旁观者效应明显高于单独plRES-EGFP-TK/GCV系统作用。因此,ATRA可以明显提高plRES-EGFP-TK/GCV系统对人骨肉瘤U-2细胞的旁观者效应。
旁观者效应的具体作用机制现在仍未阐明,研究发现肿瘤和转化细胞中普遍存在缝隙连接蛋白的表达异常和缝隙连接通讯功能的缺陷,细胞缝隙连接蛋白的表达和缝隙连接通讯的恢复与肿瘤的生长控制和转化表型的抑制相关,缝隙连接蛋白基因表现出肿瘤抑制基因的特点,缝隙连接蛋白43(CX43)表达异常和多种肿瘤的发生有关[7]。CX43是CX基因家族中数量最为丰富的成员,迄今已发现存在于 34种组织和 46 种细胞中[8],在缝隙连接通迅方面发挥着重要的作用。骨肉瘤细胞中主要表达CX43,主要分布在基底细胞的细胞膜上。骨肉瘤细胞中的CX43蛋白的浓度与肿瘤细胞的分化程度成正相关,提示CX43能影响骨肉瘤细胞的发展。本实验也证实了骨肉瘤U-2细胞中CX43蛋白的低表达,ATRA(终质量浓度为10-6mol/L)作用下,CX43蛋白的量由24 h的0.559±0.018 ng/mL,逐渐增加到48h的(0.654±0.023)ng/mL和72h的(0.826±0.065)ng/mL(P<0.01)。本实验发现,CX43蛋白在U-2细胞上表达随ATRA作用时间的延长显著增加,呈时间依赖性。
ATRA是维生素 A 族类化合物,已被公认为一种广谱分化诱导剂,并广泛应用于肿瘤细胞的诱导分化和生长抑制。有研究结果表明,ATRA可诱导肿瘤细胞分化和抑制增殖,上调多种肿瘤细胞CX43基因的表达[9]。本研究结果表明,ATRA可以通过诱导人骨肉瘤U-2细胞的CX43蛋白的表达,增强细胞间的缝隙连接,从而增强plRES-EGFP-TK/GCV系统治疗人骨肉瘤U-2细胞的旁观者效应,增强其对肿瘤的作用。
有研究显示,虽然病毒载体转染效率高,但是存在严重的安全问题如具有细胞毒性、免疫原性、潜在的致瘤性,且目的基因容量小、制备复杂、成本高[10],而脂质体介导的各种基因药物储存在脂质体内,具有靶向、缓释,降低药物毒性,保护基因药物免受体内生物酶降解等优点[11]。本实验中运用脂质体介导的TK/丙氧鸟苷(GCV)系统相比病毒载体更安全、低毒,转染效率也较高。
[1] Dai X,Ma W,He X,et al.Review of therapeutic strategies for osteosarcoma,chondrosarcoma,and Ewing's sarcoma [J].Med Sci Monit,2011,17(8): 177-190.
[2] Hameed M,Dorfman H.Primary malignant bone tumors-recent developments[J].Semin Diagn Pathol,2011,28(1):86-101.
[3] Ta HT,Dass CR,Choong PFM,et al.Osteosarcoma treatment: state of the art[J].Cancer Metastasis Reviews,2009,28(1): 247-263.
[4] Melguizo C,Prados J,Rama AR,et al.Multidrug resistance and rhabdomyosarcoma[J].Oncol Rep,2011,26(4): 755-761
[5] 申聪香,文忠,关小芳,等.hTERT及CMV双调控TK基因靶向杀灭鼻咽癌细胞的实验研究[J].中国现代医学杂志,2010,20(20):3048-3052.
[6] Boucher PD,Im MM,Freytag SO,et al.A novel mechanism of synergistic cytotoxicity with 5-fluorocytosine and ganciclovir in double suicide gene therapy[J].Cancer Res,2006,66 (6) : 3230-3237.
[7] Kanczuga-Koda L,Koda M,Sulkowski S,et al.Gradual loss of functional gap junction within progression of colorectal cancer—a shift from membranous CX32 and CX43 expression to cytoplasmic pattern during colorectal carcinogenesis[J].In Vivo,2010,24 (1):101-107.
[8] Laird DW.Life cycle of connexins in health and disease[J].Biochem J,2006,394(Pt3): 527-543.
[9] Long AC,Bomser JA,Grzybowski DM,et al.All-trans retinoic Acid regulates CX43 expression,gap junction communication and differentiation in primary lens epithelial cells [J].Curr Eye Res,2010,35(8):670-679.
[10] Hsu CY,Uluda H.Effects of size and topology of DNA molecules on intracellular delivery with non-viral gene carriers[J].BMC Biotechnol,2008,8(23):1-15.
[11] Malam Y,Loizidou M,Seifalian AM.Liposomes and nanoparticles:nanosized vehicles for drug delivery in cancer [J].Trends Pharmacol Sci,2009,30(11):592-599.
