基因修饰的脐血MSCs移植对帕金森病大鼠旋转行为研究
2015-07-06樊志刚王东
樊志刚 王东
[摘 要] 背景:目前临床治疗帕金森病以药物为主,细胞移植治疗逐渐成为一种趋势,基因修饰过的脐血干细胞能否改善症状鲜见报道。目的:观察TH修饰的HUMSCs移植对帕金森病大鼠旋转行为的影响。方法:将酶切鉴定后的新构建质粒pEGFP-C2-TH经电穿孔法转染培养第4代HUMSCs,注射到PD大鼠模型右侧脑室,观察大鼠行为学变化,移植细胞在大鼠脑组织内的迁移。结果与结论:质粒pEGFP-C2-TH转染HUMSCs移植后8周,细胞逐渐向脑室转移,PD大鼠症状显著改善(P<0.05),移植细胞可以在PD大鼠脑内存活。TH修饰的大鼠HUMSCs经脑室移植对PD大鼠具有明显治疗作用,为临床中干细胞移植的应用提供实验依据。
[关键词] 基因治疗;脐血来源间充质干细胞;帕金森病;大鼠;酪氨酸羟化酶
中图分类号:R394 文献标识码: A 文章编号:2095-5200(2015)03-030-05
帕金森病(Parkinsondisease,PD)的病因尚未明确,与遗传在内的多种因素有关[1] 。其病理特征为黑质致密部的色素脱失和多巴胺神经元的大量死亡[2]。好发于中老年人,平均始发年龄为57岁,60岁以上患病率达1%~2%。目前,据统计,世界上约有500万名帕金森病患者[3],其中170万在中国[4] 。随着人口老龄化,患病率和发病率呈明显的增长趋势[5]。虽然近年来药物治疗[6]方面的研究使帕金森病症状得到有效控制,但仍有许多问题亟待解决,比如:药物不良反应、药效降低、痴呆、平衡障碍等,如何进行个性化治疗[7] 给现有药物治疗提出了巨大挑战。帕金森病的外科治疗主要包括苍白球损毁术、脑深部电刺激等,应用受限于手术的适应证、手术技术的高要求、并发症的高风险[8]、昂贵的医疗价格等。
目前,细胞治疗成为新方向,主要是将各种多巴胺能细胞移植入纹状体,多年来人们尝试各种细胞作为种子细胞进行研究。干细胞移植和基因治疗为帕金森病[9-11]临床治疗开拓了广阔前景,PD也是公认的适合进行细胞移植和基因治疗的病种之一[12-15]。细胞治疗比药物治疗更接近于患者生理模式。干细胞因其具有向多巴胺能神经元分化的潜能而成为细胞治疗中极为常用的种子细胞,主要包括胚胎干细胞[16]、成人神经干细胞、骨髓间充质干细胞等。但是它们面临道德伦理、来源受限、免疫排斥等棘手问题,临床研究发展受到极大限制。
脐血是胎儿出生时脐带内和胎盘近胎儿一侧血管内的血液。脐血中含有丰富的造血干细胞和间充质干细胞(mesenchymal stem cells.MSCs)[17],是近几年来发现的一类具有与骨髓干细胞相同的多向分化潜能的原始祖细胞,并且来源丰富,免疫排斥低。酪氨酸羟化酶(tyrosine hydroxylase,TH)是儿茶酚胺类神经递质即多巴胺、去甲肾上腺素、肾上腺素生物合成过程所需的限速酶,也是DA能神经元的标志酶,它以四氢生物喋呤啶(BH4)为辅酶,催化酪氨酸的羟化而生成多巴(DOPA)。
本实验将大鼠酪氨酸羟化酶(tyrosinehydroxy-lase,TH)基因修饰的人脐血来源间充质干细(Humanumbilical cord blood -derived mesenchymal stem cell,HUMSCs)立体定向注射到PD大鼠脑室内,观察经TH修饰后的HUMSCs在大鼠脑内的存活、迁移情况,以及移植后对帕金森大鼠旋转行为影响,为进一步实验和临床移植途径选择提供实验依据。
1 材料和方法
1.1 材料
2012年3月至10月在郑州大学医学院干细胞研究中心完成随机对照动物实验。健康雄性SD大鼠30只,体质量200~400g,购自河南省实验动物中心。实验过程中对动物的处理符合科技部2006年颁布的《关于善待实验动物的指导性意见》标准。主要试剂:6-羟基多巴胺、阿朴吗啡购自Sigma公司;小鼠抗酪氨酸羟化酶购自Gibco公司;DMEM购自天津TBD公司;淋巴细胞分离液(1. 077 g/cm3)购自北京中杉公司;NucleofectorTM 细胞核转染仪购自德国Amaxa公司。
1.2 方法
pEGFP-C2-TH构建:将pGEM—TH-3在引物1:5ˊ-TACTTGAGCGCCCACCCC-3ˊ,引物2:5ˊ-GTGTCTACTTAATGGCACTCA-3ˊ扩增后的TH基因与pEGFP-C2连接,引入XhoⅠ和SaⅡ双酶,行酶切电泳检测。
PD模型的建立:用35g/L水合氯醛(350mg/kg)腹腔注射麻醉SD大鼠后,将大鼠固定于立体定向器上,以前囟为零点,参照包新民等[18]的《大鼠脑立体定位图谱》,确定大鼠右侧MFB和VTA两点坐标(MFB为前囟后4.0mm,矢状缝右侧1.8mm,颅骨下7.9mm;VTA为前囟后4.6mm,矢状缝右侧1.4mm,颅骨下7.9mm)。向每点用微量进样器注射新鲜配置的6-OHDA溶液6 μL(3g/L,溶于含质量分数为2 g/L抗坏血酸的生理盐水中),注射速度为0.5μL/min,留置空针10 min,以1mm/min的速度缓慢退针。1周后腹腔注射阿朴吗啡(1.0mg/kg)以诱发旋转实验,随机将26只造模成功大鼠分成实验组与对照组,每组13只。
pEGFP-C2-TH转染 HUMSCs:脐血来源于郑州市妇幼保健医院产科,参照文献[19]分离并纯化HUMSCs,取第三代MSCs,在NucleofectorTM仪 A=31程序下进行转染.然后继续培养3d,进行TH免疫组化,计算转染率和融合蛋白表达率。
HUMSCs的移植:将调整细胞浓度调整为2.0×105μL-1,立即进行细胞移植。将帕金森病模型大鼠麻醉后固定于立体定位器上,以前囟为零点,定位右侧纹状体2个移植点:前囟前1.2 mm,矢状缝右2.8mm,颅骨下5.2 mm;前囟前1.2 mm,矢状缝右2.8mm,颅骨下7.2mm。实验组每点注射6μLHUMSCs,注射速度0.5μL/min,注射完毕后留针10min,以1mm/min的速度缓慢退针。对照组按上述方法和坐标,注入6μL的PBS。
1.3 观察指标及统计分析
①移植后每周1次腹腔注射阿朴吗啡(1.0 mg/kg)观察帕金森病大鼠旋转行为的改善。②移植后8周、12周取脑制作冰冻切片。用荧光显微镜观察HUMSCs细胞的存活与迁移情况。
统计学分析:数据以均数±标准误表示。采用SPSS11.0版软件包对帕金森病大鼠移植前后旋转次数行重复测量数据的方差分析,检验水准α=0.05。
2 结果
2.1 实验动物数量
30只实验大鼠,造模成功的26只全部进入结果分析。
2.2 HUMSCs的分离和纯化
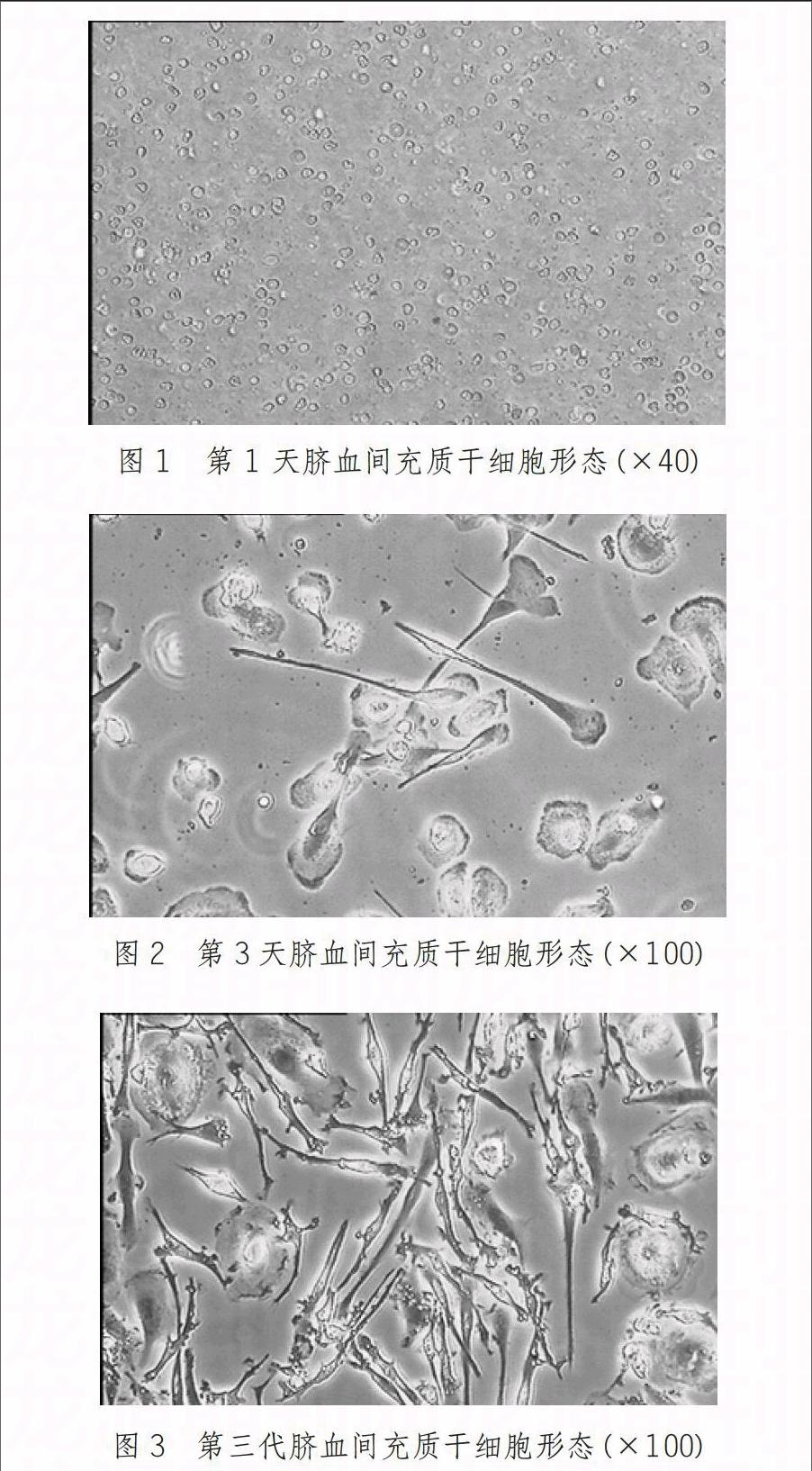
HUMSCs接种后第1天,细胞基本呈圆形,悬浮状;3天后贴壁,原代细胞呈细长型,圆锥状,散在分布,数目稀少,消化后继续传代培养,1周后,细胞生长达90%融合,多数HUMSCs细胞呈长梭型,贴壁牢固,排列紧密,取第三代细胞备用。(图1-图3)
2.3 质粒pEGFP-C2-TH的酶切鉴定
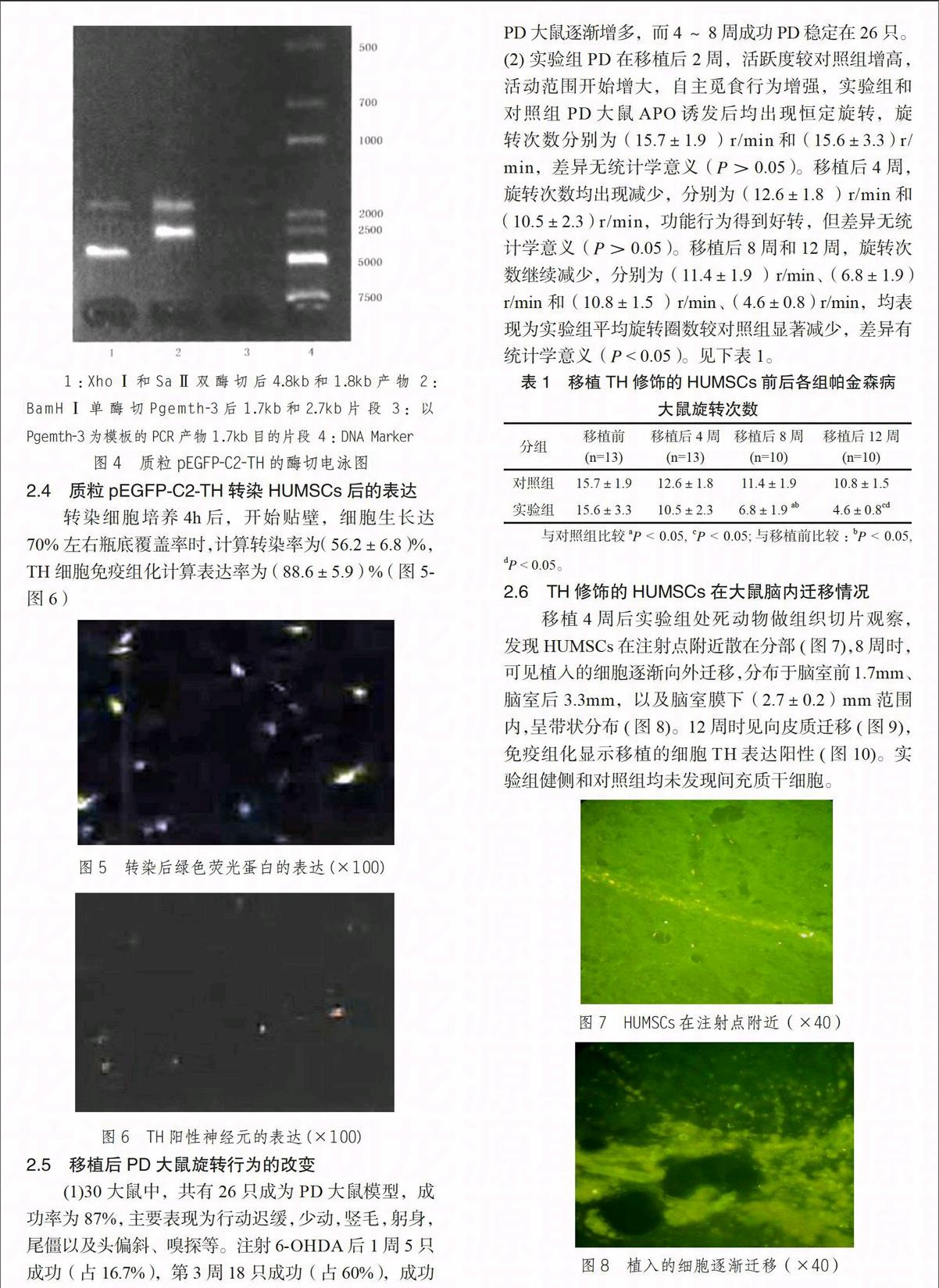
电泳结果中,质粒pEGFP-C2-TH在双酶切后表达的目的片段及质粒pGEMTH-3经PCR扩增后的DNA片段与质粒pGEMTH-3酶切下释放的TH基因(1.77kb)大小一致。(图4)
1:XhoⅠ和SaⅡ双酶切后4.8kb和1.8kb产物 2:BamHⅠ单酶切Pgemth-3后1.7kb和2.7kb片段 3:以Pgemth-3为模板的PCR产物1.7kb目的片段 4:DNA Marker
图4 质粒pEGFP-C2-TH的酶切电泳图
2.4 质粒pEGFP-C2-TH转染 HUMSCs后的表达
转染细胞培养4h后,开始贴壁,细胞生长达70%左右瓶底覆盖率时,计算转染率为(56.2±6.8)%,TH细胞免疫组化计算表达率为(88.6±5.9)%(图5-图6)
2.5 移植后PD大鼠旋转行为的改变
(1)30大鼠中,共有26只成为PD大鼠模型,成功率为87%,主要表现为行动迟缓,少动,竖毛,躬身,尾僵以及头偏斜、嗅探等。注射6-OHDA后1周5只成功(占16.7%),第3周18只成功(占60%),成功PD大鼠逐渐增多,而4~8周成功PD稳定在26只。
(2)实验组PD在移植后2周,活跃度较对照组增高,活动范围开始增大,自主觅食行为增强,实验组和对照组 PD大鼠APO诱发后均出现恒定旋转,旋转次数分别为(15.7±1.9 )r/min和(15.6±3.3) r/min,差异无统计学意义(P>0.05)。移植后4周,旋转次数均出现减少,分别为(12.6±1.8 )r/min和(10.5±2.3) r/min,功能行为得到好转,但差异无统计学意义(P>0.05)。移植后8周和12周,旋转次数继续减少,分别为(11.4±1.9 )r/min、(6.8±1.9) r/min和(10.8±1.5 )r/min、(4.6±0.8) r/min,均表现为实验组平均旋转圈数较对照组显著减少,差异有统计学意义(P < 0.05)。见下表1。
2.6 TH修饰的HUMSCs在大鼠脑内迁移情况
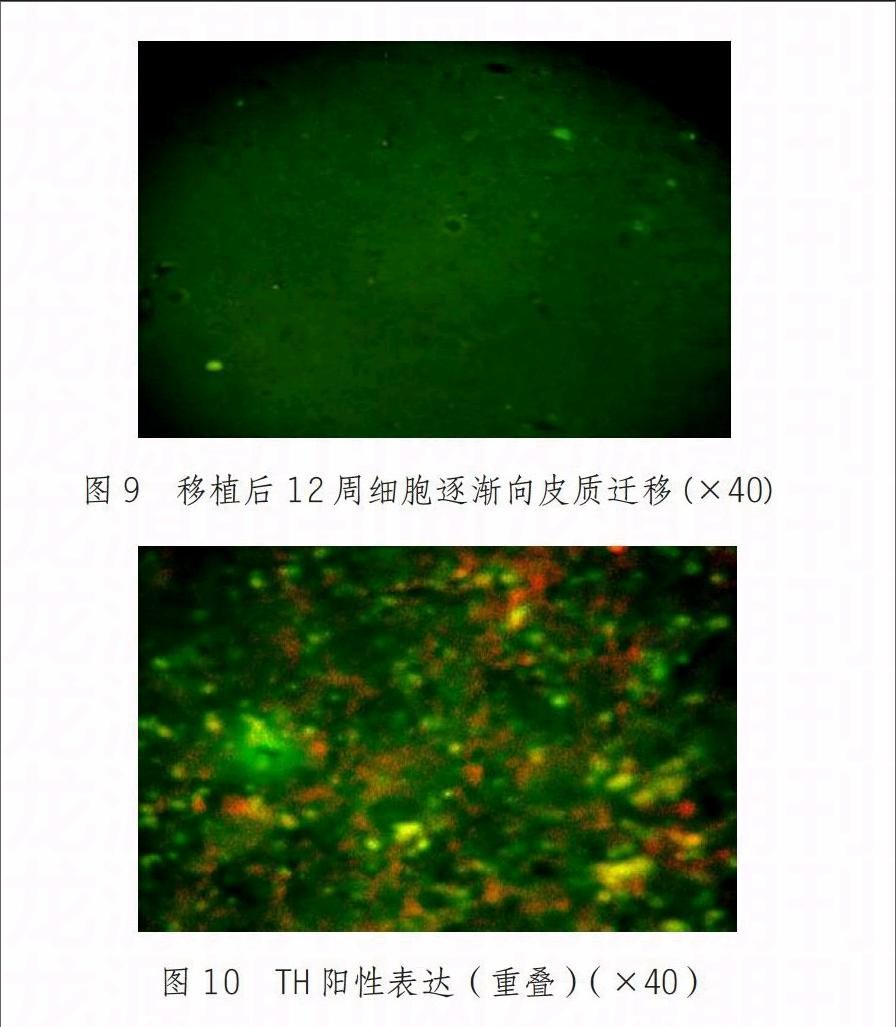
移植4周后实验组处死动物做组织切片观察,发现HUMSCs在注射点附近散在分部(图7),8周时,可见植入的细胞逐渐向外迁移,分布于脑室前1.7mm、脑室后3.3mm,以及脑室膜下(2.7±0.2)mm范围内,呈带状分布(图8)。12周时见向皮质迁移(图9),免疫组化显示移植的细胞TH表达阳性(图10)。实验组健侧和对照组均未发现间充质干细胞。
3 讨论
PD是一种与年龄相关的神经变性疾病,主要是黑质纹状体区的多巴胺能神经元的减少或消失。目前,干细胞生物学的研究与应用日益受到关注,干细胞具有自我更新和多向分化潜能[20],骨髓间充质干细胞研(Bone mesenchymal stem cells.BMSCs)研究较多[21-23],有实验表明,BMSCs在体外纯化后,移植入PD大鼠脑内,可在脑内分化为多巴胺能神经元,明显增加多巴胺含量[24],可改善症状,但脐血来源间充质干细胞较少报道,脐血作为一种新的可靠干细胞来源,有自身很多优点,尤其是HUMSCs在适当条件下具有向神经细胞、成骨细胞、肝细胞等组织细胞的多项分化潜能[25-27],并且HUMSCs容易获取、能有效表达外源基因。体外研究中,HUMSCs可在多种因子的共同诱导下表达TH[28],而TH阳性的表达正是多巴胺能神经元的基本特征,在体内定向分化的报道不是很多。和其他来源干细胞相比,脐血来源广泛,脐血中淋巴细胞的免疫功能不够成熟,免疫原性较弱,移植物抗宿主病发生率较低;脐血中间充质干细胞易于分离[29]。本研究以HUMSCs为种子细胞,为进一步的实验及临床应用奠定基础。
质粒pEGFP-C2-TH修饰后的HUMSCs表达TH及增强型绿色荧光蛋(EGFP),TH是DA合成的限速酶,在PD患者脑内TH蛋白质含量与细胞内THmRNA含量是同步降低的,有实验表明未修饰的脐血间充质干细胞植入纹状体内可显著提高中脑内DA的含量[30],但并不稳定,且提高的含量有限。因此,本实验采用TH基因修饰的干细胞植入纹状体内,使其表达TH基因,使HUMSCs具有DA能神经细胞的部分特征;另一方面,共表达EGFP作为指示剂,是TH基因表达及移植细胞迁移的客观观察指标,本研究中TH和EGFP的共表达率为88.6%,使HUMSCs在PD大鼠移植后的追踪及TH的表达更为直接和可视化。
本研究移植TH修饰的HUMSCs后,荧光显微镜下观察显示4周时,外源性细胞主要分布注射点附近,8周时,开始向周围迁移,12周时迁移至皮质周围。PD组模型大鼠旋转行为在4周时,与对照组相比,下降了约16%,统计显示P>0.05,8周时,下降了45%,12周时,下降了60%,统计显示均P<0.05,与免疫组化结果相一致。荧光显微镜下观察提示了HUMSCs在大鼠冠切面上可以在室管膜下沿脑室呈带状分布。由此初步认为HUMSCs可以穿过血脑屏障而在脑组织内存活,与此前研究中发现骨髓源及胎源干细胞可以通过血脑屏障相类似[9],但是其通过血脑屏障机制尚不清楚。现对于单纯的脐血脑内移植治疗PD[31],经基因TH修饰的细胞活动范围更大,存活时间更长。
TH基因修饰的HUMSCs可以通过脑室移植途径对PD大鼠起到一定的治疗作用,为基础研究和临床治疗提供了依据,HUMSCs虽然在脑内可以表达TH抗原,但是否能分泌多巴胺,除了表达TH外,是否能分化为其他相关神经递质类细胞,如:肾上腺能,胆碱能神经元等,都有待进一步研究。
参 考 文 献
[1] Peter A. LeWitt.Levodopa for the treatment of Parkinson s disease[J].N Engl J Med,2008,359(23):2468-2476.
[2] Olanow CW,Kordower JH,Iang AE,et a1.Dopanfinergie trans-plantation for Parkinsons disease current status and futureprospects[J].Ann Neurol,2009,66:591-596.
[3] Lonneke ML de Lau,Monique MB Breteler.Epidemiology of Parkinsons discase[J]. Lancet Neurol,2006,5(6):525-535.
[4] ZHANG Zhenxin,Gustavo C Roman,HONG zhen,et al.Parkinsons disease in China:prevalence in Beijing,Xian,and Shanghai[J].The Lancet, 2005, 365(9459):595-597.
[5] 王刚,陈生弟.老龄化社会的阵痛--老年性神经变性疾病的社会解读[J].医学与哲学,2006,27(5):59-60.
[6] Changsheng Wang,Jianhua Lin,Chaoyang Wu,Rongsheng ChenDepartment of Spinal Surgery,First Affiliated Hospital of Fujian Medical University,Fuzhou,,Fujian Province,China.Adenovirus-mediated human brain-derived neurotrophic factor gene-modified bone marrow mesenchymal stem cell transplantation for spinal cord injury[J].Neural Regeneration Research,2011(16):13-18.
[7] Diaze NI.Ⅵaters CH Current strategies in the treatment of Parkinson s disease and a personalized approach tomanagement[J].Expert Rev Neurother,2009,9:1781-1789.
[8] 高国栋,张华,王学廉,等.帕金森病的定向手术适应证[J].中华神经外科杂志,2002,18(1):12-14.
[9] Grade S,Bernardino L,Malva JQ. Oligodendrogenesis fromneural stem cells:Perspectives for-remyelinatingstra-tegies[J].IntJDev Neurosei. 2013,(01):5736-5748.
[10] 刘晓艳,康慧聪,胡琦,等.基因修饰的骨髓间充质干细胞移植治疗帕金森病的实验研究[J].华中科技大学学报(医学版),2011,40(4):396-399.
[11] 赵钢勇,张平,赵慧新,等. 移植脑源性神经生长因子修饰骨髓问充质干细胞对帕金森病大鼠模型治疗作用的实验研究[J]. 重庆医科大学学报,2013,38(1):28-32.
[12] Tinmarla F. Oo,Deanna M. Marchionini,Olga Yarygina,et al.Brain-derived neurotrophic factor regulates early postnatal developmental cell death of dopamine neurons of the substantia nigra in vivo[J].Molecular and Cellular Neuroscience,2009,41(4):440-447.
[13] 宋承伟,方明,高开波,等.自体外周血造血干细胞移植治疗帕金森病10例.中国组织工程研究与临床康复,2009,13(36):7186-7188.
[14] Rodrigo Somoza,Carlos Juri,Mauricio Baes,et al.Intranigral transplantation of epigenetically induced bdnf-secreting human mesenchymal stem cells: implications for cell-based therapies in parkinsons disease[J]. Biology Blood and Marrow Transplantation,2010,16(11):1530-1540.
[15] 杜望春,王坚,丁正同,等.微囊化牛视网膜脱色素上皮细胞移植治疗帕金森大鼠的研究[J].中国病理生理杂志,2007,23(2):361-365.
[16] Yasuhara T,M sukawa N,Hara K,et a1.Transplantation of human neural stem cells exeas neuroprotection in a rat model of Parkinsons disease[J].J Neurosci,2006,26(48):12497-125l.
[17] 赵俊昧,孟爱国,陈乃耀,等.人脐血问充质干细胞移植对创伤性脑损伤大鼠VEGF分泌及血管新生的影响[J]. 中国神经免疫学和神经病学,2013,20(4):267-273.
[18] 包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社, 1991. 44.
[19] 丁妍,卢智勇,袁雅红,等.脐血浆分离培养人脐带间充质干细胞[J].解剖学杂志,2013,36(2):144-144.
[20] Salehi Z,Mashayekhi F.Brain derived neurotrophic factor concentrationsin the cerebrospinal fluid of patients with Parkinsons disease.[J].J Clin Neurosci,2009,16(1):90-93.
[21] 徐胜利,周明, 陈彪,等.神经营养因子基因修饰的神经干细胞在帕金森病大鼠模型中的治疗作用[J].中华老年医学杂志,2010,29(1):58-63.
[22] 张可华,蔡哲.神经干细胞向多巴胺能神经元分化机制的研究进展[J].中国康复理论和实践,2012.16(4):314-318.
[23] 刘洪斌,杨静,李东华,等.骨髓间充质干细胞对大鼠胰腺损伤的修复[J].中国组织工程研究与临床康复,2010,1(23):4252-4255.
[24] Biuqstud K B,Tenq Y G,Redmond D E,et a1.Human neural stem cells migrate along the nigrostriatal pathway in a primatemodel of Parkinsons disease[J].Exp Neurol,2008,211(2):362-369.
[25] 王蒙,杨媛,史春梦,等.人脐血源性MSCs成骨诱导分化后对DCs的免疫抑制研究[J].免疫学杂志,2012,28(11):959-963.
[26] Viaro Riccardo,MORARI michele,Franchi Gianfranco.Progressive motor cortex functional reorganization following 6-hydroxydopamine lesioning in rats.[J].The Journal of Neuroscience,2011,31(12):4544-4554.
[27] 李恒,李晓红,毕建芬,等.全反式维甲酸促人脐血多能干细胞向多巴胺能神经元分化[J].山东大学学报(医学版),2012,50(6):92-96.
[28] LI Yunchun,TAN Tianzhi,ZHENG Jianguo,et al.Anti-sense oligonucleotide labeled with technetium-99m using hydrazinonictinamide derivative and n-hydroxysuccinimidyl s-acetylmercaptoacetyltriglycline: a comparison of radiochemical behaviors and biological properties.[J].World Journal of Gastroenterology,2008,14(14):2235-2240.
[29] PAILL? V,PICCONI B,BAGETTA V,et al.Distinct levels of dopamine denervation differentially alter striatal synaptic plasticity and nmda receptor subunit composition.[J].The Journal of Neuroscience,2010,30(42):14182-14193.
[30] 刘芳. 脐血间充质干细胞移植后帕金森大鼠纹状体内多巴胺含量的变化[J].中国组织工程研究与临床康复,2010,1(23):4239-4242.
